带myc标签的人造血相关PBX相互作用蛋白真核表达载体的构建及其功能研究
李玲,闫志风,蒋昊,冯滢滢,冀全博,黄蓉,周丽英,王鹏,徐小洁,叶棋浓
1.军事医学科学院 生物工程研究所,北京 100850;2.解放军总医院 妇产科,北京 100853;3.第二炮兵总医院,北京 100088
造血相关PBX相互作用蛋白(hematopoietic PBX-interacting protein,HPIP)是 2000年 Abramov⁃ich 等[1]以 PBX1(hematopoietic pre-B-cell leukemia transcription factor 1)作为诱饵,利用酵母双杂交技术从胎儿肝脏cDNA文库中筛选得到的。2002年DiMartino等[2]报道,HPIP参与维持胚胎期造血干细胞的定向分化和成熟血细胞正常的有丝分裂,能够强烈抑制原癌基因E2A-PBX与DNA的模序(AT⁃CAATCAA)结合,调节造血干细胞正常生长分化过程。2006年Manavathi等[3]揭示HPIP能够与雌激素受体α及微管相互作用并磷酸化AKT和MAPK,因此它在雌激素受体信号通路中具有重要作用。2013年本实验室[4]研究表明,miR-148a能降低HPIP在肝癌细胞中的表达水平,并通过AKT/ERK/FOXO4/ATF5途径抑制AKT和ERK,进而抑制mTOR的表达。
我们拟构建带myc标签的HPIP真核表达载体,并验证其升高磷酸化AKT和ERK水平的功能,为进一步研究HPIP在肿瘤发生发展中的关系奠定基础。
1 材料和方法
1.1 材料
人肝癌细胞系HepG2由本室传代培养;质粒pcDNA3.0-HPIP、pXJ-40-myc载体为本实验室保存;限制性内切酶、DNA连接酶、PCR试剂均购自Ta⁃KaRa公司;质粒提取、胶回收、PCR回收试剂盒购自Promega公司;VigoFect为威格拉斯生物技术有限公司产品;DMEM及小牛血清均购自Gibco公司;引物由北京赛百盛生物技术有限公司合成;测序由北京博迈德科技发展有限公司完成。
1.2 myc-HPIP重组质粒的构建与测序
以pcDNA3.0-HPIP质粒为模板,根据文献报道的HPIP的编码序列合成上游引物(5'-CGGGATCC ATGGCCTCCTGCCCAGACTCTG-3')和 下 游 引 物(5'-CCCAAGCTTTCAGCCCCGGTGGTGGTGGTGG-3')。利用PCR方法扩增人HPIP的编码序列(扩增条件:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸150 s,30个循环;72℃延长7 min),最后用胶回收试剂盒回收PCR产物。
用BamHⅠ和HindⅢ双酶切pXJ-40-myc载体,经12 g/L琼脂糖凝胶电泳后,胶回收载体大片段;将PCR片段回收后再用BamHⅠ和HindⅢ酶切,形成带有粘端的双链,用DNA T4连接酶连接到pXJ-40-myc载体中,转化大肠杆菌DH5α,挑取阳性克隆培养后提取质粒,用BamHⅠ和HindⅢ双酶切鉴定,酶切鉴定正确的克隆送北京博迈德科技发展有限公司测序。
1.3 哺乳动物细胞转染和Western印迹检测
按常规方法进行转染。用含双抗、10%胎牛血清的DMEM培养基将HepG2细胞接种于2个6 cm皿中,接种量以转染时细胞密度达70%~80%为宜,培养24 h后进行转染,转染前1 h换液。将4 μL VigoFect与200 μL NaCl混合,再将总量为10 μg的重组质粒与200 μL NaCl混合,然后将上述2种溶液轻轻混合,室温放置15 min,加入6 cm皿中,并以同样方法转染空pXJ-40-myc载体作为对照,37℃、5%CO2常规培养,4~6 h后换液,24 h后收集细胞,加入2×SDS上样缓冲液煮沸15 min,高速离心2 min,取上清液进行SDS-PAGE后,电转移至硝酸纤维素膜上;用5%脱脂奶粉于4℃封闭1 h,加入用5%脱脂奶粉以1∶5000稀释的用HRP标记的抗myc标签鼠单克隆抗体,室温轻摇1 h,TBST洗膜3次,每次5 min;用化学发光法显色5 min,压片显影。
若显影结果显示myc-HPIP表达,再行Western印迹至4℃封闭1 h后,加入用5%脱脂奶粉以1∶500稀释的抗pAKT(Thr308)的兔多克隆抗体、抗总AKT的鼠单克隆抗体及抗pERK(Thr202/Tyr204)的鼠单克隆抗体、抗总ERK的兔多克隆抗体,室温轻摇1 h,TBST洗膜3次,每次5 min;加入用5%脱脂奶粉稀释的以1∶2000稀释的HRP偶联的羊抗兔IgG、羊抗鼠IgG,室温轻摇1 h,TBST洗膜3次,每次5 min;用化学发光法显色10 min,压片显影。
2 结果
2.1 myc-HPIP重组质粒的构建与鉴定
以pcDNA3.0-HPIP质粒为模板,PCR扩增人HPIP的编码序列,获得长约2100 bp的DNA片段,与预期大小一致(图1)。将PCR产物用BamHⅠ和HindⅢ双酶切后与用经同样酶切的pXJ-40-myc载体连接,转化大肠杆菌DH5α,挑克隆后进行菌液PCR鉴定,若获得与目的条带2100 bp大小接近(图2)的克隆,则初步认为是带有人HPIP基因的阳性重组克隆。将所得阳性克隆提质粒,经酶切鉴定,可切出2条长度分别约为5000和2100 bp的条带,而相应的空载体酶切只见大片段,符合预期结果(图3)。测序结果表明,插入片段的DNA序列与人HPIP基因的编码序列完全一致(序列略)。
2.2 Western印迹检测myc-HPIP在HepG2细胞中的表达

图1 PCR扩增人HPIP的编码序列
将构建的myc-HPIP重组质粒和空载体分别转染HepG2细胞系,24 h后提取蛋白进行SDS-PAGE,Western印迹检测myc-HPIP的表达。结果显示,转染重组质粒后,用myc-HRP抗体能在相对分子质量约100×103处检测到明显的特异性条带,空载体无条带(图4);与空载体对照相比,转染重组质粒后总的AKT、ERK水平保持不变,但磷酸化AKT、ERK的水平升高(图4)。说明myc-HPIP重组蛋白在HepG2细胞中能够正确表达,且能升高AKT、ERK的磷酸化水平。
3 讨论
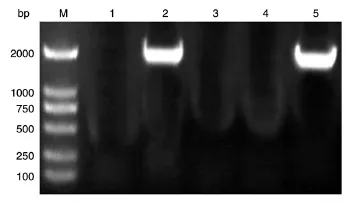
图2 重组质粒myc-HPIP的菌液PCR结果电泳图谱
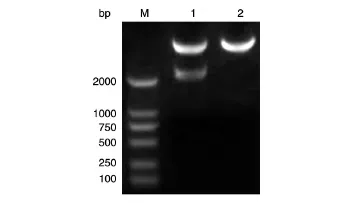
图3 重组质粒myc-HPIP的BamHⅠ/HindⅢ双酶切电泳图谱
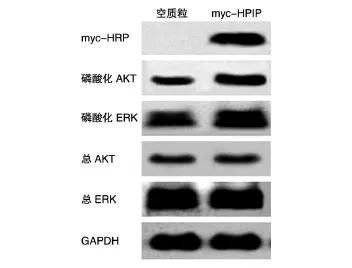
图4 Western印迹检测myc-HPIP和磷酸化AKT、ERK的表达
HPIP包含731个氨基酸残基,目前没有发现与已知蛋白有同源性。HPIP主要位于细胞质中,只有少量位于细胞核中。HPIP具有抑制PBX-HOX二聚体与靶序列结合的能力,能强烈抑制原癌基因E2APBX的转录活性[1,3,5]。
研究表明,HPIP在乳腺癌细胞的细胞迁移和增殖作用中具有重要作用[6-7]。雌激素受体在乳腺癌的发生发展中也起重要作用[8-10]。PI3K/Akt信号通路作为细胞内重要的信号转导通路之一,通过影响下游多种效应分子的活化状态,在细胞内发挥着抑制凋亡、促进增殖的关键作用,与人类多种肿瘤的发生发展密切相关[10]。Akt是细胞生存通路PI3K/Akt中的关键分子,其持续活化与肿瘤的发生发展密切相关,现已被定义为癌基因。Akt的Ser473、Thr308个位点在 P13K(phosphatidylinositol-3 kinase,磷脂酰肌醇-3激酶)、PDK1(3-phosphoinositide-dependent kinase-1,3-磷酸肌醇依赖性蛋白激酶1)、ILK(inte⁃grin linked kinase,整合素连接激酶)的作用下发生磷酸化从而获得活性[11]。活化状态的Akt通过磷酸化mTOR、Foxo家族等多种作用底物,促进肿瘤细胞的生长增殖,抑制细胞凋亡,促进细胞侵袭和转移,促进血管生成,抵抗化疗和放疗中细胞的凋亡。
在信号网络中,丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)信号传递途径起着极为重要的作用,控制着细胞的多种生理过程,如细胞生长、发育、分裂、死亡等[12]。胞外信号调节激酶(extracellular signal-regulated kinase,ERK)是MAPK家族的一员,调节着细胞的增殖、分化和存活,是多种生长因子的下游蛋白,ERK及其信号途径在肿瘤侵袭和转移过程中发挥重要作用[13]。
HPIP已被证明在癌症的发生发展中发挥重要作用,但其促进癌细胞生长、调节癌细胞增殖的确切机制尚不清楚。在本研究中,我们将构建的myc-HPIP重组质粒转染肝癌HepG2细胞后获得表达,以便进行下一步的功能实验。检验AKT、MAPK信号通路中总AKT、总ERK及磷酸化AKT、磷酸化pERK的水平变化,发现总AKT、ERK水平不变,而磷酸化的AKT、ERK水平上调,与文献报道一致[4]。总之,本研究结果为进一步了解HPIP的生物学功能,及其在肿瘤发生、发展中的作用奠定了基础。
[1]Abramovich C,Shen W F,Pineault N,et al.Functional clon⁃ing and characterization of a novel nonhomeodomain protein that inhibits the binding of PBX1-HOX complexes to DNA[J].Biol Chem,2000,275(34):26172-26177.
[2]DiMartino J F,Swlleri L,Traver D,et al.The Hox cofactor and proto-oncogene Pbx1 is required for maintenance of defin⁃itive hematopoiesis in the fetal liver[J].Blood,2002,98(4):618-626.
[3]Manavathi B,Acconcia F,Rayala S K,et al.An inherent role of microtubule network in the action of nuclear receptor[J].Proc Natl Acad Sci USA,2006,103(43):15981-15986.
[4]Xu X,Fan Z,Kang L,et al.Hepatitis B virus X protein re⁃presses miRNA-148a to enhance tumorigenesis[J].J Clin In⁃vest,2013,123(2):630-645.
[5]Abramovich C,Chavez E A,Lansdorp P M,et al.Functional characterization of multiple domains involved in the subcellu⁃lar localization of the hematopoietic Pbx interacting protein(HPIP)[J].Oncogene,2002,21(44):6766-6771.
[6]Manavathi B,Lo D,Bugide S,et al.Functional regulation of pre-B-cell leukemia homeobox interacting protein 1(PBXIP1/HPIP)in erythroid differentiation[J].Biol Chem,2012,287(8):5600-5614.
[7]Wang X,Yang Z,Zhang H,et al.The estrogen receptor inter⁃acting protein HPIP increases estrogen-responsive gene expres⁃sion through activation of MAPK and AKT[J].Biochim Bio⁃phys Acta,2008,17(6):1220-1228.
[8]Ferguson A T,Davidson N E.Regulation of estrogen receptor α function in breast cancer[J].Crit Rev Oncog,1997,8(1):29-46.
[9]Klinge C M.Estrogen receptor interaction with co-activators and corepressors[J].Steroids,2000,65(5):227-251.
[10]Saji S,Jensen E V,Nilsson S,et al.Estrogen receptors α and β in the rodent mammary gland[J].Proc Natl Acad Sci USA,2000,97(1):337-342.
[11]Persad S,Attwell S,Gray V,et al.Regulation of protein ki⁃nase B/Akt—serine 473 phosphorylation by integrin-linked ki⁃nase:critical roles for kinase activity and amino acids argi⁃nine 211 and serineg 343[J].JBiolChem,2001,276(29):27462-27469.
[12]Köbel M,Pohl G,Schmitt WD,et al.Activation of mitogenactivated protein kinase is required for migration and inva⁃sion ofplacentalsitetrophoblastic tumor[J].Am JPathol,2005,167(3):879-885.
[13]Obata T,Brown G E,Yaffe M B,et al.MAP kinase path⁃waysactivated by stress:the p38 MAPK pathway[J].Crit Care Med,2000,28(4 Suppl):N67-77.

