内皮和造血系统特异性敲除Rictor基因对胎肝造血的影响
穆晓环,王伟丽,赵云泽,倪艳丽,李专,顾洁,张丽艳,汪晓敏,程涛,刘汉芝,袁卫平,刘兵
1.中国医学科学院&北京协和医学院 血液学研究所,血液病医院实验血液学国家重点实验室,天津 300020;2.军事医学科学院 附属医院肿瘤学研究室,北京 100071
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是哺乳动物雷帕霉素的作用靶点[1],调节机体多种生理活动[2]。mTOR可以形成2种蛋白复合体mTORC1和mTORC2,而Rictor(rapamy⁃cin-insensitive companion of TOR)是mTORC2不可或缺的组成部分[3]。mTORC2影响PI3K-Akt通路中Akt S473位点的磷酸化,PI3K-Akt通路不仅在感受营养信号、调节细胞生长与抑制中起重要作用,而且其调节异常时还会诱发肿瘤的生成[4]。虽然mTOR信号通路一直是生命科学研究的热点,但有关胚胎造血中Rictor的研究几乎空白。通过探讨Rictor对胚胎造血的影响,将有利于研究血液系统肿瘤及研发靶向治疗的新药。
在胚胎发育过程中,第一个造血干细胞(hema⁃topoietic stem cell,HSC)出现在主动脉-性腺-中肾区(aorta-gonad-mesonephros region,AGM区),随后出现在胎盘、卵黄囊[5]。近来,我们发现头部与AGM区类似,是造血干细胞产生的又一位点[6]。不同位点产生的造血前体细胞或造血干细胞通过血液循环迁移到胎肝,在胎肝中成熟或扩增[7]。研究表明,胚胎第12 d(E12.0)小鼠胎肝约含有100个造血干细胞,在E15达到顶峰,大约扩增10倍左右[8]。
基于Cre-LoxP的条件基因打靶技术为造血发育的研究带来新的机遇,Cre转基因介导的细胞谱系示踪策略可为造血干细胞起源研究提供最有力的生理证据。2008~2009年,利用VEC-Cre(vascular en⁃dothelial cadherin-Cre)转基因小鼠的谱系示踪系统内皮细胞的命运,Iruela-Arispe和Speck先后证明一群特殊的血管内皮细胞(而非间质细胞或其他中胚层前体)是造血干细胞发育的直接前体[9-10]。而Vav1-Cre能够示踪所有的血细胞[11]。通过这2种小鼠模型,可以准确地观察特定基因对造血发生不同阶段的作用。
我们利用 VEC-Cre、Vav1-Cre与 Rictorf/f小鼠特异性基因敲除系统,在小鼠发育过程中特异性敲除具有VEC启动子活性或Vav1启动子活性的细胞中的Rictor基因,在E15左右取出胎肝,通过流式细胞术分析在内皮及造血系统特异敲除Rictor基因后对胎肝造血的影响。
1 材料与方法
1.1 材料
Rictorf/f小鼠及Vav1-Cre小鼠均来自天津血液学研究所国家重点实验室,VEC-Cre小鼠由清华大学郭伟教授惠赠,均在SPF级动物实验室饲养;普通PCR试剂TransStart Fast Pfu DNA聚合酶购自北京全式金生物技术有限公司;引物购自Invitrogen公司;流式抗体 Lin-Biotin(Ter119、GR-1、Mac-1、B220、CD3、CD4、CD8)、SAVAPC-CY7、Sca-1 APC、c-Kit PE-Cy7、CD150 PE、CD48 FITC、GR-1 PE-Cy7、Mac-1 PE-Cy7、AA4.1 PE-Cy7、CD19 APC均购自eBioscience公司;DNA浓度测定仪器为Thermo公司的NANODROP 2000;PCR仪器为ABI公司的2720 Thermal Cycler;流式细胞分析及分选所用的仪器为BD公司的FACSAriaⅡ;流式细胞分析软件为FlowJo 7.6,数据分析软件为GraphPad Prism5,统计学处理方法为t检验。
1.2 小鼠繁育及胚胎的处理
雄鼠Rictorf/+;VEC-Cre+由Rictorf/f小鼠与VECCre+小鼠交配所得;雄鼠Rictorf/+;Vav1-Cre+由Rictorf/f小鼠与Vav1-Cre+小鼠交配所得;分别与雌鼠Rictorf/f合笼,第2 d检查阴道栓,见栓的当天中午为E0.5,于E15解剖孕鼠取出胚胎。解剖所得胎肝,置于含10%胎牛血清的IMDM培养液中,用1 mL射器吹打成单个细胞悬液,置于4℃备用。取相应的胚胎鼠尾进行基因型鉴定。
1.3 小鼠及胚胎基因型的鉴定
将小鼠脚趾或胚胎鼠尾裂解并提取其基因组DNA,测定浓度,调节DNA浓度为100~200 ng/μL。配置 PCR 反应体系 25 μL,包括 5×缓冲液 5 μL,2.5 mmol/L dNTP 2.5 μL,Fast Pfu DNA 聚合酶0.5 μL,ddH2O 14 μL,DNA 模板 1 μL,上、下游引物各2 μL。Rictor正义引物为5'-ACTGAATATGT TCATGGTTGTG-3',反义引物为5'-GAAGTTATTC AGATGGCCCAGC-3';VEC-Cre正义引物为 5'-GC CTGCATTACCGGTCGATGC-3',反义引物为5'-CA GGGTGTTATAAGCAATCCC-3';Vav1-Cre正义引物为5'-AGATGCCAGGACATCAGGAACCTG-3',反义引物为5'-ATCAGCCACACCAGACACAGAGATC-3';内参基因正义引物为5'-GAAGTTATTCAGATG GCCCAGC-3',反义引物为5'-GAAGTTATTCAGAT GGCCCAGC-3'。PCR反应条件:95℃预变性2 min,然后以95℃变性20 s、56℃退火20 s、72℃延伸15 s行35个循环,72℃延伸5 min。反应产物每管加5 μL 6×DNA上样缓冲液,进行EB染色的2%琼脂糖凝胶电泳,用凝胶成像系统观察结果并拍照记录。
1.4 流式分析及分选
野生型(WT),Rictor敲除型(KO)的胎肝细胞于4℃、310 r/min离心5 min,弃上清,用 100 μL含0.1%BSA的PBS重悬,按流式抗体说明书,每个样本加定量的流式抗体进行标记,4℃反应30 min后转移至流式管中,加2 mL PBS洗去非特异结合的抗体,再用200~300 μL 含0.1%BSA的PBS重悬,过滤膜,进行流式分析。
2 结果
2.1 小鼠基因型的鉴定
Rictor基因的特异性敲除是利用Cre-LoxP基因敲除系统实现的(图1A)。鉴定基因型时,取每只胚胎鼠尾,裂解后利用异丙醇抽提的方法提取基因组DNA,再通过PCR扩增特定条带,经EB染色的琼脂糖凝胶电泳确定基因型(图1B)。其中,VEC-Cre诱导敲除的KO为Rictorf/f;VEC-Cre;Vav1-Cre诱导敲除的KO为Rictorf/f;Vav1-Cre,WT为Rictorf/f或Rictorf/+。
2.2 流式细胞术分析VEC-Cre和Vav1-Cre敲除Ric⁃tor后对各系细胞的影响
通过预实验分析VEC-Cre和Vav1-Cre敲除Ric⁃tor后E15胎肝中各系细胞比例的变化。用CD3富集T细胞,用Gr-1和Mac-1富集粒-单核系(GM)细胞,用CD19富集B细胞。结果表明,用VEC-Cre(图2A)和Vav1-Cre(图2B)2种条件敲除Rictor基因后胎肝各系细胞比例均降低。
2.3 流式细胞术分析VEC-Cre和Vav1-Cre敲除Ric⁃tor基因后对B细胞的影响
根据文献报道,Rictor基因对成体造血系统各系细胞的影响以B系最为明显[13]。因此,我们进一步用AA4.1和CD19富集胎肝B细胞,利用流式细胞术分析VEC-Cre和Vav1-Cre敲除Rictor基因后E15胎肝中B细胞比例的变化,结果也表明用2种条件敲除Rictor基因后胎肝B细胞比例降低(图3)。
2.4 流式细胞术分析VEC-Cre和Vav1-Cre敲除Ric⁃tor基因后对HSC的影响

图1 小鼠基因型鉴定

图2 流式细胞术分析VEC-Cre(A)和Vav1-Cre(B)敲除Rictor基因后各系细胞比例的变化
LSK(Lin-Sca-1+c-Kit+)是富集HSC最常用的表面标志。造血干细胞又分为长期造血干细胞(LTHSC)和短期造血干细胞(ST-HSC),其中LT-HSC可以恢复致死剂量照射后的受体的终身造血能力。LT-HSC常用的富集标志为SLAM(Lin-Sca-1+c-Kit+CD150+CD48-)[12]。我们利用LSK和SLAM表型组合分析了VEC-Cre和Vav1-Cre特异敲除Rictor基因后HSC的变化。首先取出E15胎肝,吹打成单个细胞并标记荧光抗体,鉴定基因型后通过流式细胞术分析WT组与KO组E15小鼠胚胎胎肝的LSK和SLAM比例。结果显示,用2种条件敲除Rictor基因后,KO组胎肝中HSC的比例均明显降低(P<0.05)(图4)。
3 讨论
HSC的自我更新和多向分化特性使之可以在整个生命过程中为机体提供不同阶段、所有类型的血细胞,在这一过程中,多种信号通路及其基因发挥调节作用,当调节异常时则会导致白血病等血液系统疾病的发生。例如在急性髓系白血病(AML)和急性淋巴细胞白血病(ALL)患者中,发现PI3K/Akt信号通路中一些关键基因的表达异常,其中包括mTOR和Rictor表达异常,这说明mTOR信号通路及Rictor的异常与白血病细胞的生长相关[14]。并且,mTORC2和Rictor对成体造血有调节作用[13]。为了进一步研究Rictor在HSC尤其是胚胎造血中的作用,我们利用针对内皮系统(VEC-Cre)和造血系统(Vav1-Cre)的2种条件敲除小鼠,特异性地敲除Rictor基因,在E15胎肝中的造血干细胞数量及比例达到峰值时,观察Rictor基因敲除对造血系统的影响。结果发现无论是内皮系统还是血液系统敲除Rictor基因后,胎肝中的造血干细胞及各系细胞比例均有所降低。这表明Rictor基因在胚胎造血发育中发挥促进作用,当其表达异常时,胎肝的造血发育则受到阻碍。
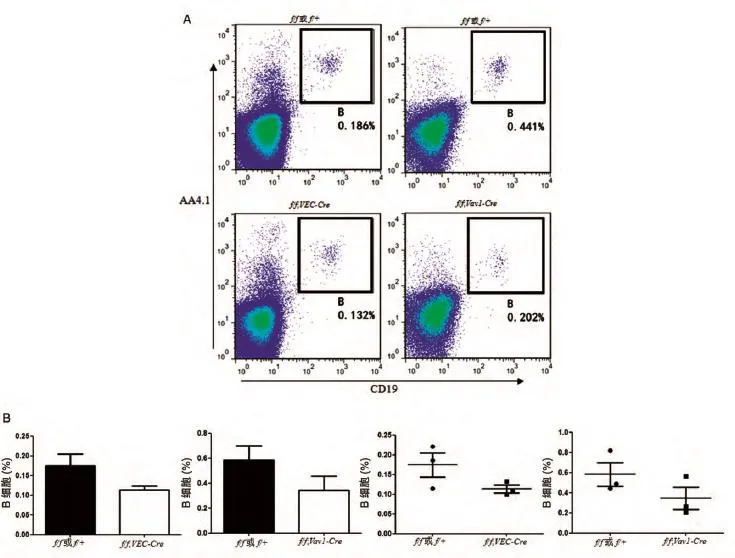
图3 流式细胞术分析VEC-Cre和Vav1-Cre敲除Rictor基因后B细胞的变化

图4 流式细胞术分析VEC-Cre和Vav1-Cre敲除Rictor基因后HSC比例的变化
HSC能够产生所有类型的血细胞,但Rictor基因敲除后对不同类型细胞的影响却不一样,在成体造血的研究中敲除Rictor基因,HSC向各系的分化不平衡,向B系分化的减少更明显[13]。本研究Rictor基因敲除后各系细胞比例均降低,以B细胞最为明显,基本与成体中Rictor基因敲除后对造血的影响一致。在研究中我们发现,同样是E15的胎肝,VEC组和Vav1组的WT中各系细胞比例却不同,Vav1组的WT中各系细胞比例明显高于VEC组。这可以从以下2个方面解释:第一,虽然都是E15的野生型胎肝,但我们从见栓的当天中午记为E0.5,所以E15的野生型胎肝也可能存在早晚不同,不同时间的胎肝中造血干细胞向各系分化的情况不同,导致Vav1组的WT中各系细胞比例明显高于VEC组;第二,不同实验流式细胞分析中电压等不同也会造成结果的差异。VEC组和Vav1组中各组组内的WT与KO进行比较,2组间比例不同并不影响结果的判定。
综上所述,内皮和血液系统敲除Rictor基因后影响胎肝造血,在血液系统敲除Rictor基因后对胎肝中各系细胞的产生也有一定的影响。表明Rictor基因及由其组成的mTORC2信号通路调控HSC发育。但是,该基因在造血发育过程中其他时间点以及对其他造血位点的影响还有待进一步阐明,其调控造血的机制也值得进一步探讨。
[1]Sabatini D M.mTOR and cancer:insights into a complex rela⁃tionship[J].Nat Rev Cancer,2006,6:729-734.
[2]Zoncu R,Efeyan A,Sabatini D M.mTOR:from growth sig⁃nalintegration to cancer,diabetesand ageing[J].NatRev Mol Cell Biol,2011,12:21-35.
[3]Kumar A,Harris T E,Keller S R,et al.Muscle-specific de⁃letion of Rictor impairs insulin-stimulated glucose transport and enhances Basal glycogen synthase activity[J].Mol Cell Bi⁃ol,2008,28:61-70.
[4]Xu Q,Simpson S E,Scialla T J,et al.Survival of acute my⁃eloid leukemia cells requires PI3 kinase activation[J].Blood,2003,102:972-980.
[5]Muller A M,Medvinsky A,Strouboulis J,et al.Development of hematopoietic stem cell activity in the mouse embryo[J].Immunity,1994,1:291-301.
[6]Li Z,Lan Y,He W,et al.Mouse embryonic head as a site for hematopoietic stem cell development[J].Cell Stem Cell,2012,11:663-675.
[7]Samokhvalov I M,Samokhvalova N I,Nishikawa S.Cell trac⁃ing shows the contribution of the yolk sac to adult haemato⁃poiesis[J].Nature,2007,446:1056-1061.
[8]Cumano A,Godin I.Ontogeny of the hematopoietic system[J].Annu Rev Immunol,2007,25:745-785.
[9]Zovein A C,Hofmann J J,Lynch M,et al.Fate tracing re⁃veals the endothelialorigin ofhematopoietic stem cells[J].Cell Stem Cell,2008,3:625-636.
[10]Chen M J,Yokomizo T,Zeigler B M,et al.Runx1 is re⁃quired for the endothelial to haematopoietic cell transition but not thereafter[J].Nature,2009,457:887-891.
[11]Ruiz-Herguido C,Guiu J,D'Altri T,et al.Hematopoietic stem cell development requires transient Wnt/β-catenin activity[J].J Exp Med,2012,209:1457-1468.
[12]Kiel M J,Yilmaz O H,Iwashita T,et al.SLAM family recep⁃tors distinguish hematopoietic stem and progenitor cells and revealendothelialnichesforstem cells[J].Cell,2005.121:1109-1121.
[13]Magee J A,Ikenoue T,Nakada D,et al.Temporal changes in PTEN and mTORC2 regulation of hematopoietic stem cell self-renewaland leukemia suppression[J].CellStem Cell,2012,11:415-428.
[14]王伟丽,张英弛,曾慧敏,等.PI3K/AKT信号通路在急性白血病中调控机制的初步研究[J]. 中国实验血液学杂志,2012,20:18-21.

