表达猴免疫缺陷病毒Env蛋白的重组鸡痘病毒的构建和筛选
朱羿龙,李昌,刘存霞,杜寿文 ,王茂鹏,叶飞,谭鹏,邢彬,刘继,朱光泽,郭焱,金宁一
1.军事医学科学院 军事兽医研究所,吉林 长春 130122;2.长春中医药大学,吉林 长春 130117
据世界卫生组织统计,2010年新感染人免疫缺陷病毒(HIV)的患者约270万人,而截至2010年底,约有3400万人携带HIV,所以迫切需要安全、有效的疫苗来应对HIV的蔓延。但是,由于抗原表位的时常突变、免疫原性弱,以及疫苗所诱导的抗原免疫反应时间短等原因,导致疫苗研发屡遭挫败[1-3]。对于其他病毒传染病,如麻疹、腮腺炎和风疹等,这种类似于免疫原性的问题是通过发展减毒疫苗株来解决的[4],但是对于HIV和猴免疫缺陷病毒(SIV)而言,减毒活疫苗虽然很具有吸引力[5-6],但却存在前病毒整合和某些情况下转变为野生毒株的风险[7]。相反,活病毒在作为HIV疫苗载体时具备了相当优秀的免疫原性[8-11],其中以禽痘病毒为载体的HIV疫苗已开始临床应用,如Aventis Pasteur公司开发的重组金丝雀病毒载体ALVAC与gp120亚单位疫苗联合应用,并均可在受试者中检测到CTL反应[12]。
SIV与HIV-1具有一定的同源性,部分SIV毒株接种于亚洲猴子,会使其感染并产生类似艾滋病的症状[13],因此,用SIV感染亚洲猴属作为模型被推荐替代HIV-1感染,使得SIV作为HIV的模式病毒在疫苗领域得到广泛应用。包膜糖蛋白(Env)在病毒进入宿主细胞的过程中起着至关重要的作用,我们以SIV env作为目的基因,以中国鸡痘病毒(fowlpox virus,FPV)疫苗株FPV282E4为载体,以EGFP为标记基因,采用挑斑方法筛选重组FPV,利用PCR、RT-PCR和Western印迹进行鉴定和遗传稳定性分析,最终获得一株稳定表达SIV Env蛋白的重组FPV,通过其所产生的免疫应答反应,可为HIV疫苗研究提供可资借鉴的数据。
1 材料和方法
1.1 材料
含有SIV env基因的质粒pVR-SIV env由中国疾病预防控制中心病毒病预防控制所冯霞博士惠赠;穿梭质粒 pTKET[14]、大肠杆菌 DH5α、FPV282E4株由本实验室保存;8~10日龄SPF鸡胚购自北京梅里亚维通实验动物技术有限公司,用于制备鸡胚成纤维细胞(CEF)。
1.2 重组质粒的构建
以pVR-SIV env为模板设计扩增SIV env的引物 F(5'-GCCACCATGGGATGCCTGGGAAAC-3',添加KpnⅠ酶切位点及kozak序列)和R(5'-TCACTG CCTCAGCTTAGCCAG-3',添加SalⅠ酶切位点)。反应条件:94℃变性 30 s;60℃退火 30 s,72℃延伸130 s,30个循环,72℃延伸10 min。将PCR产物连接到pMD18-T载体上,酶切鉴定正确后进行DNA测序。用KpnⅠ与SalⅠ双酶切T载体上测序正确的目的基因片段,插入FPV穿梭载体pTKET的相应位点,构建重组FPV质粒pTKET-SIV env(图1)。
1.3 FPV的重组、筛选和纯化
以5MOI(感染复数)的FPV282E4感染生长至80%融合的CEF,37℃、5%CO2条件下培养2~3 h,用QIAGEN公司的转染试剂Effectene Transfection Reagent将重组质粒转染至CEF中,继续培养72 h,在荧光显微镜下观察绿色荧光后,收取病变细胞并超声波破碎,将其接种于单层CEF中培养72 h,在荧光显微镜下挑取蚀斑,经超声波破碎,再次接种于单层CEF中,重复上述操作,待形成的细胞病变处无非绿色荧光病变细胞时,挑取噬斑进行扩增、鉴定。
1.4 重组FPV的整合与转录
将纯化的重组FPV以5MOI接种CEF,在37℃、5%CO2条件下培养72 h后收集细胞,提取感染细胞的总基因组和RNA,将RNA反转录成cDNA,以基因组和cDNA为模板,扩增SIV env、FPV-P4b(上游引物为5'-GGACGCGTATTGATTCACACCGTATTA CAGAGG-3',下游引物为5'-CGCCCGGGTTCTCC TAATAAGTTACACCGTTTG-3')、FPV-TK(上游引物为5'-GGACGCGTCAGCAGGTGCTAAACAACAA-3',下游引物为5'-GGCTGCAGCGGTAGCTTAACG CCGAATA-3')基因。反应条件:94℃变性30 s;60℃退火30 s,72℃延伸130 s,30个循环;72℃延伸10 min。TK基因作为VAVC的一个常用插入位点,也用于FPV和其他禽痘病毒的重组位点[15-16],因此选取TK基因作为重组FPV是否筛纯的鉴定指标。P4b基因存在于所有FPV中,通常将其用于FPV的特异性鉴定[17]。
1.5 重组FPV表达产物的检测
将纯化的重组FPV以5MOI接种CEF,在37℃、5%CO2条件下培养72 h后收集细胞,用裂解缓冲液RIPA裂解细胞,离心取上清,加入5×SDS-PAGE缓冲液,沸水浴10 min,经SDS-PAGE后转移到Im⁃mun-Blot PVDF 膜上,以兔抗 gp120/160(Mac293)(购自Eneyme公司)和鼠抗GAPDH抗体(购自碧云天公司)为一抗,辣根过氧化酶标记的山羊抗兔IgG(购自中杉金桥公司)和辣根过氧化酶标记的山羊抗鼠IgG(购自中杉金桥公司)为二抗进行抗体结合反应,利用ECL方法进行蛋白表达分析,设立GAPDH为内参。
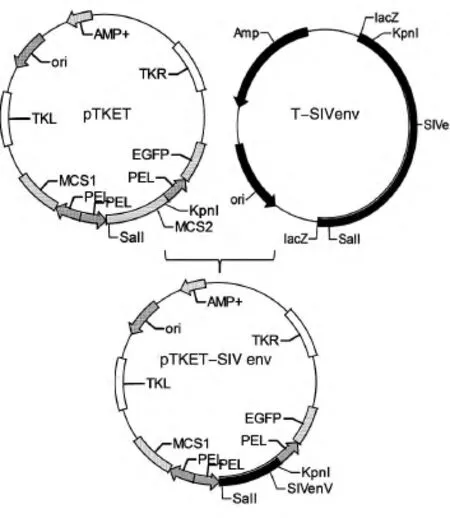
图1 重组鸡痘病毒穿梭质粒的构建
1.6 遗传稳定性分析
将筛选纯化的重组FPV在CEF中连续传代20次,分别选取传代次数为1、5、10、15、20的感染病毒的细胞,观察荧光并提取其基因组、总RNA和总蛋白,利用PCR、RT-PCR、Western印迹检测SIV env基因在重组FPV中的遗传稳定性。
1.7 重组FPV在哺乳动物细胞中的表达
将纯化的重组FPV以5 MOI接种BHK21细胞,在37℃、5%CO2条件下培养72 h后,在荧光显微镜下观察细胞能否表达荧光。
2 结果
2.1 重组质粒的构建及鉴定
按照前述方法扩增SIV env基因,可获得2.1 kb左右的目的片段,将其分别连接到pMD18-T载体中,经KpnⅠ和SalⅠ双酶切,可切出2.1 kb左右的目的片段,表明扩增成功。经测序证明为目的基因序列(图略)。
2.2 重组FPV穿梭质粒pTKET-SIV env酶切鉴定
重组FPV穿梭质粒pTKET-SIV env经KpnⅠ和SalⅠ酶切,可看到2.1 kb左右的目的片段及4.8 kb左右的载体片段,表明质粒构建成功(图2)。
2.3 重组FPV的整合与转录鉴定结果
提取重组FPV感染CEF的基因组和总RNA,进行PCR和RT-PCR,结果见图3,重组FPV基因组和cDNA均可扩增出SIV env片段(2160 bp)、P4b片段(578 bp),证明目的基因已整合到重组FPV中并能进行转录。由图3还可以看出,重组FPV基因组未扩增TK基因,而野生型毒株可以扩增出TK特异性条带,说明重组FPV已经获得纯化。
2.4 重组FPV表达产物的检测结果
将重组FPV感染CEF的裂解液行SDS-PAGE和转膜后,分别与兔抗gp120/160、鼠抗GAPDH抗体和辣根过氧化酶标记的山羊抗兔IgG、辣根过氧化酶标记的山羊抗鼠IgG反应,用ECL方法进行蛋白表达分析,以GAPDH为内参,结果见图4。重组病毒感染的细胞可检测出相对分子质量约120×103的SIV Env目的条带,而野生型FPV感染检测为阴性,用GAPDH抗体检测可见相对分子质量约40×103的目的条带,表明目的蛋白成功表达且具有抗原性。
2.5 遗传稳定性分析结果
将经挑斑纯化的重组FPV连续传代20次,分别取第1、5、10、15、20代病毒观察,可见每代均有荧光(图5);提取基因组和总RNA进行PCR和RT-PCR检测SIV env基因,结果表明各代重组FPV均能扩增出2160 bp的目的片段(图6);同时制备蛋白样品进行Western印迹,可见相对分子质量约120×103的特异性蛋白条带,而FPV检测为阴性(图7)。表明重组FPV传代20次内具有良好的遗传稳定性。
2.6 重组FPV在真核细胞中的表达情况
为了验证本研究构建的重组FPV能否在哺乳动物中表达外源蛋白,以5MOI病毒量感染BHK21细胞,72 h后观察,可以看到感染重组病毒的细胞有大量荧光表达,而感染野生毒株的对照细胞则无(图8),表明重组FPV能在哺乳动物细胞中表达。
3 讨论

图2 重组穿梭质粒的酶切鉴定
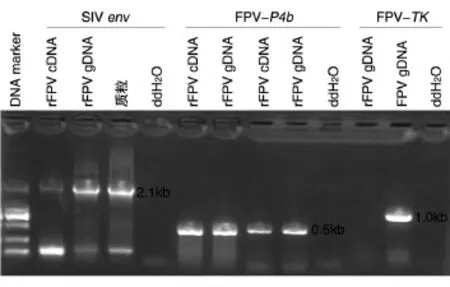
图3 重组FPV的PCR产物电泳图谱
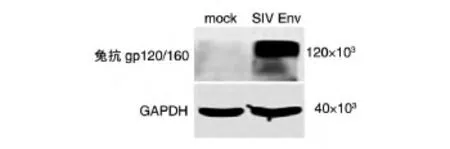
图4 重组FPV表达产物的Western印迹鉴定
艾滋病在1981年突然出现,并在极短的时间内迅速蔓延,至今已造成约6000万人感染,而且新感染者人数正以每年260万持续增长[18]。艾滋病已成为世界上最具破坏性的传染病之一,虽然各国都在尽力研究抗艾滋病药物,企图阻止病毒在不同感染阶段时的复制,但由于HIV基因在治疗期间的突变,使得药物往往无法达到理想的治疗效果。因此,研制安全和有效的疫苗,是控制、消除艾滋病流行的主要措施,近年来研究者已逐步开始关注以病毒为载体的HIV疫苗。
FPV载体是应用较为广泛的禽痘病毒。鉴于禽痘病毒具有严格的胞浆复制、忠实表达外源蛋白、自然条件下只感染禽类、流产性感染哺乳动物且不产生感染性子代病毒粒子等特点,且其具有很大的外源基因容量,构建相对容易,因此以FPV为载体的重组疫苗已经应用于哺乳动物和禽类的研究中[19-22]。
SIV与HIV具有很高的同源性。由于SIV的遗传结构和生物特性与HIV非常相似,同时SIV猕猴动物模型与HIV患者有许多相似之处[23],主要表现为身体消瘦、机会性感染及CD4+T淋巴细胞大量丢失,因此,SIV感染模型在目前最适于艾滋病发病机制及疫苗战略研究[24]。
图5 不同代次重组FPV的荧光分析
逆转录病毒的包膜糖蛋白在感染初期发挥着重要的作用,它涉及结合细胞膜和细胞表面受体使病毒融合进入细胞;在感染后期,Env在病毒装配的过程中也扮演重要角色,有证据表明包膜基质蛋白与Env在细胞内相互作用直接影响病毒粒子在极化上皮细胞的释放位置[25-26],位于胞内区的Env能够相互作用,同时还会影响Env的掺入和感染力。此外,去除细胞质域能够增加被感染细胞表面Env的表达量和掺入病毒样颗粒以及Env融合活性[27],同时Env还具备良好的免疫原性,能够有效刺激SIV特异性IFN-γ分泌细胞的产生和诱导较高水平的Env特异性反应[28],能够产生高浓度的特异性抗体[29],能够有效诱导产生CD4+T淋巴细胞增殖效应[30]。因此,Env作为有效抗原被广泛应用于疫苗研发。
本实验以SIV env为抗原基因,构建能稳定表达Env蛋白的重组FPV,并采用挑取噬斑的方法进行筛选,同时以EGFP基因为报告基因,使重组FPV在感染CEF后能特异性表达绿色荧光蛋白,由此大大提高重组病毒的检出率,又可避免用BrdU加压筛选导致基因突变的不利影响。用PCR、RT-PCT、Western印迹对重组FPV进行了鉴定和遗传稳定性分析,表明我们构建的重组FPV能同时表达SIV Gag和SIV Env,具备更广泛的免疫原性,且重组FPV能在BHK21细胞中大量表达,为其在哺乳动物中的应用及HIV疫苗研究提供了可资借鉴的数据。
图6 不同代次重组FPV的PCR产物电泳图谱
图7 不同代次重组FPV表达产物的Western印迹

图8 重组FPV在BHK21细胞中的表达
[1]Gallo R C.The end or the beginning of the drive to an HIV-preventive vaccine:a view from over20 years[J].Lancet,2005,366(9500):1894-1898.
[2]Saunders K O,Rudicell R S,Nabel G J.The design and evaluation of HIV-1 vaccines[J].Aids,2012,26(10):1293-1302.
[3]Burton D R,Ahmed R,Barouch D H,et al.A blueprint for HIV vaccine discovery[J].Cell Host Microbe,2012,12(4):396-407.
[4]Watson J C,Hadler S C,Dykewicz C A,et al.Measles,mumps,and rubella--vaccine use and strategies for elimina⁃tion of measles,rubella,and congenital rubella syndrome and control of mumps:recommendations of the Advisory Commit⁃tee on Immunization Practices(ACIP)[J].MMWR Recommend Rep,1998,47(RR-8):1-57.
[5]von Gegerfelt A S,Liska V,Li P L,et al.Rev-independent simian immunodeficiencyvirusstrainsare nonpathogenicin neonatal macaques[J].J Virol,2002,76(1):96-104.
[6]von Gegerfelt A S,Alicea C,Valentin A,et al.Long lasting control and lack of pathogenicity of the attenuated Rev-inde⁃pendent SIV in rhesus macaques[J].AIDS Res Human Retro⁃viruses,2006,22(6):516-528.
[7]Baba T W,Liska V,Khimani A H,et al.Live attenuated,multiply deleted simian immunodeficiency virus causes AIDS in infant and adult macaques[J].Nat Med,1999,5(2):194-203.
[8]Johnston R E,Johnson P R,Connell M J,et al.Vaccination of macaques with SIV immunogens delivered by Venezuelan equine encephalitis virus replicon particle vectors followed by a mucosal challenge with SIVsmE660[J].Vaccine,2005,23(42):4969-4979.
[9]Demberg T,Florese R H,Heath M J,et al.A replicationcompetent adenovirus-human immunodeficiency virus(Ad-HIV)tat and Ad-HIV env priming/Tat and envelope protein boost⁃ing regimen elicits enhanced protective efficacy against simian/human immunodeficiency virus SHIV89.6P challenge in rhe⁃sus macaques[J].J Virol,2007,81(7):3414-3427.
[10]Hansen S G,Ford J C,Lewis M S,et al.Profound early con⁃trol of highly pathogenic SIV by an effector memory T-cell vaccine[J].Nature,2011,473(7348):523-527.
[11]Robert-Guroff M.Replicating and non-replicating viral vec⁃tors for vaccine development[J].Curr Opin Biotechnol,2007,18(6):546-556.
[12]Pitisuttithum P,Rerks-Ngarm S,Bussaratid V,et al.Safety and reactogenicity of canarypox ALVAC-HIV(vCP1521)and HIV-1 gp120 AIDSVAX B/E vaccination in an efficacy trial in Thailand[J].PloS One,2011;6(12):e27837.
[13]Benveniste R E,Morton W R,Clark E A,et al.Inoculation of baboons and macaques with simian immunodeficiency virus/Mne,a primate lentivirus closely related to human immunode⁃ficiency virus type 2[J].J Virol,1988,62(6):2091-2101.
[14]刘存霞,李昌,王茂鹏.新型鸡痘病毒穿梭载体的构建及其体外表达[J].中国兽医科学,2012,42(05):454-460.
[15]Amano H,Morikawa S,Shimizu H,et al.Identification of the canarypox virus thymidine kinase gene and insertion of for⁃eign genes[J].Virology,1999,256(2):280-290.
[16]Lee Huw,Lee Hwa.Application of the polymerase chain reac⁃tion for the diagnosis of fowl poxvirus infection[J].J Virol Methods,1997,63(1-2):113-119.
[17]Scheiflinger F,Falkner F G,Dorner F.Role of the fowlpox vi⁃rus thymidine kinase gene for the growth of FPV recombi⁃nants in cell culture[J].Arch Virol,1997,142(12):2421-2431.
[18]Flynn N M,Forthal D N,Harro C D,et al.Placebo-con⁃trolled phase 3 trial of a recombinant glycoprotein 120 vac⁃cine to prevent HIV-1 infection[J].J Infect Dis,2005,191(5):654-665.
[19]Skinner M A,Laidlaw S M,Eldaghayes I,et al.Fowlpox vi⁃rus as a recombinant vaccine vector for use in mammals and poultry[J].Expert Rev Vaccines,2005,4(1):63-76.
[20]Bertran K,Sá E Silva M,Pantin-Jackwood M J,et al.Protec⁃tion against H7N3 high pathogenicity avian influenza in chick⁃ens immunized with a recombinant fowlpox and an inactivat⁃ed avian influenza vaccines[J].Vaccine,2013,31(35):3572-3576.
[21]Qian C,Chen S,Ding P,et al.The immune response of a re⁃combinantfowlpoxviruscoexpressingtheHA geneofthe H5N1 highly pathogenic avian influenza virus and chicken in⁃terleukin 6 gene in ducks[J].Vaccine,2012,30(44):6279-6286.
[22]Odunsi K,Matsuzaki J,Karbach J,et al.Efficacy of vaccina⁃tion with recombinant vaccinia and fowlpox vectors expressing NY-ESO-1 antigen in ovarian cancer and melanoma patients[J].Proc Natl Acad Sci USA,2012,109(15):5797-5802.
[23]Liska V,Khimani A H,Hofmann-Lehmann R,et al.Viremia and AIDS in rhesus macaques after intramuscular inoculation ofplasmid DNA encodingfull-length SIVmac239[J].AIDS Res Human Retroviruses,1999,15(5):445-450.
[24]Kodama T,Burns D P,Silva D P,et al.Strain-specific neu⁃tralizing determinant in the transmembrane protein of simian immunodeficiency virus[J].J Virol,1991,65(4):2010-2018.
[25]Cannon P M,Matthews S,Clark N,et al.Structure-function studies of the human immunodeficiency virus type 1 matrix protein,p17[J].J Virol,1997,71(5):3474-3483.
[26]Vincent M J,Melsen L R,Martin A S,et al.Intracellular in⁃teraction of simian immunodeficiency virus Gag and Env pro⁃teins[J].J Virol,1999,73(10):8138-8144.
[27]Spies C P,Compans R W.Effects of cytoplasmic domain length on cell surface expression and syncytium-forming ca⁃pacity of the simian immunodeficiency virus envelope glycopro⁃tein[J].Virology,1994,203(1):8-19.
[28]Patterson L J,Daltabuit-Test M,Xiao P,et al.Rapid SIV Env-specific mucosal and serum antibody induction augments cellular immunity in protecting immunized,elite-controller ma⁃caques against high dose heterologous SIV challenge[J].Virolo⁃gy,2011,411(1):87-102.
[29]Kulkarni V,Rosati M,Bear J,et al.Comparison of intrader⁃mal and intramuscular delivery followed in vivo electropora⁃tion of SIV Env DNA in macaques[J].Hum Vaccin Immunoth⁃er,2013,9(10):2081-2094.
[30]Someya K,Xin K Q,Ami Y,et al.Chimeric adenovirus type 5/35 vector encoding SIV gag and HIV env genes affords pro⁃tective immunity against the simian/human immunodeficiency virus in monkeys[J].Virology,2007,367(2):390-397.

