间充质干细胞对造血干/祖细胞分化为巨核细胞的影响
曲洺逸,王静雪,王思涵 ,房芳,陈琳,张文成,贾雅丽,岳文,谢小燕,裴雪涛
1.军事医学科学院 野战输血研究所干细胞与再生医学研究室,北京 100850;2.军事医学科学院 华南干细胞与再生医学研究中心,广东 广州 510005;3.全军干细胞与再生医学重点实验室,北京 100850
大剂量化疗和造血干细胞移植术后以及大量失血等引起的血小板减少可能危及生命,目前,临床多采用输注他人捐献的血小板进行治疗。但血小板输注不仅存在扩散某些血液传播疾病的可能,同时由于血小板易于激活的自身特点,贮存条件要求苛刻,储存时间短,使得当前机采血小板供应持续紧张[1],因此人们将目光投向了在体外生产血小板替代物。我们和其他实验室的相关研究表明,体外诱导的巨核系祖细胞可以成为血小板的有效替代品,输注巨核系祖细胞不仅安全可行,还可以有效恢复血小板数量[2-4]。骨髓、脐带血和外周血来源的造血干细胞都可以产生有功能的血小板或巨核系细胞[5-7],由于脐带血具有来源丰富、采集方便的特点,已成为获取造血干细胞的主要来源。
巨核细胞的诱导分化一般通过模拟体内微环境实现,而骨髓是成年人体内主要的巨核分化场所,它主要是由造血干细胞和间充质干细胞,以及这2种干细胞的分化产物共同组成的[8]。其中间充质干细胞(mesenchymal stem cell,MSC)是造血微环境中重要的基质细胞,一方面它作为间充质组织的前体细胞,参与形成造血微环境,为造血干细胞提供结构支撑,发挥着支持造血的作用;另一方面,通过细胞本身及分泌的基质蛋白与造血干细胞的细胞间接触作用,以及向微环境释放造血相关细胞因子的旁分泌作用于造血干细胞两种方式,实现对造血功能的精细调控[9]。MSC是一群混杂的多能干细胞,可以从人的某些组织中分离出来,并在体外进行培养后应用于临床,在异体造血干细胞移植的过程中,MSC的应用有利于受者的造血重建,对于造血系统和免疫系统的恢复都显示出了很好的治疗作用[10-11]。但是,MSC对于造血干细胞向巨核系分化并最终生成血小板的作用仍然存在争议。一些人认为,大量基质细胞维持了造血微环境的稳定状态,在维持造血干细胞数量的同时阻止其分化,从而阻碍了巨核细胞及血小板的生成[12-13]。而另一些人的实验结果却显示了相反的结果。MSC表达TPO、IL-3、IL-6等巨核分化过程中的主要造血调控因子和生长因子,刺激巨核细胞生长和成熟,并且黏附在MSC旁的造血集落常高表达CD41等巨核表面标志。直接将MSC和造血干细胞共培养,或在诱导体系内加入MSC的条件培养基,都能够促进造血干细胞向巨核分化和最终形成血小板[14]。
为确定MSC对造血干/祖细胞分化为巨核细胞的影响,从而进一步优化造血干细胞向巨核细胞的诱导分化体系,我们对MSC和脐带血来源的单个核细胞进行了共培养。由于不同MSC分泌的造血因子不同[15],对造血干细胞各系分化的影响也不尽相同[16]。因此,我们分别尝试了人骨髓和脐带2种来源的MSC与脐带血中分离的单个核细胞的共培养,观察MSC对造血干细胞向巨核细胞分化产生的影响。并通过比较这2种MSC中造血因子相关基因的表达水平,对它们作用于巨核分化和增殖的效果做了进一步分析,并用Trans-well分隔MSC和造血干细胞,对MSC通过旁分泌作用促进巨核分化和增殖做了进一步的验证。
1 材料和方法
1.1 材料
筛选足月妊娠健康产妇,经受试者知情同意后,于产房无菌条件下采集脐带及脐带静脉血;人外周血淋巴细胞分离液来自天津灏阳生物制品科技有限公司;Xvivo15无血清培养基购自LONZA公司;α-MEM培养基购自GIBCO公司;胎牛血清购自Hy⁃clone公司;碱性成纤维细胞生长因子(bFGF)、重组人血小板生成素(TPO)、干细胞生长因子(SCF)、白细胞介素3(IL-3)、IL-6、IL-11购自Peprotech公司;CD41a-FITC、CD-61-APC和CD34-PE抗体购自eBioscience公司;CD29-PE、CD31-APC、CD45-PE、CD73-PE、CD90-PE、CD105-FITC和CD166-PE抗体购自BD公司;Von Kossa染色试剂盒购自Genmed Scientifics公司;瑞氏吉姆萨染色液购自珠海贝索生物技术有限公司。
1.2 脐血单个核细胞的分离
新鲜脐带血与6%羟乙基淀粉按4∶1混合后摇匀,室温静置30~50 min,待红细胞沉降至界限分明后收集上层清液,1800 r/min离心7 min,收集细胞,再用人淋巴细胞分离液分离出单个核细胞。
1.3 MSC的分离培养
脐带MSC和骨髓MSC分别采取机械分离法和全骨髓培养法分离获得。在α-MEM培养基中加入10%胎牛血清和1 U/mL bFGF配制成完全培养基用于培养细胞,每2 d换液。将4×104MSC接种于含500 μL完全培养基的24孔板中,24 h后,当培养孔中的贴壁细胞满度约80%时进行实验。
1.4 脐血单个核细胞的诱导分化
巨核细胞诱导培养基为含TPO 100 ng/mL、SCF 50 ng/mL、IL-3 20 ng/mL、IL-6 50 ng/mL、IL-11 20 ng/mL的Xvivo15无血清培养基。将5×105单个核细胞接种于含500 μL完全培养基的24孔板中,48 h半量换液。
1.5 细胞增殖情况及形态观察
在一定时间点,将孔内悬浮细胞轻柔吹打成单细胞悬液,并用台盼蓝染色,计数存活细胞。将适宜密度的细胞置于细胞涂片机上样孔中,2000 r/min离心2 min后进行吉姆萨染色,干燥后于显微镜下观察并拍照。
1.6 MSC的诱导分化
成脂诱导培养基为α-MEM培养基,含10%胎牛血清、1 μmol/L 地塞米松、10 mmol/L胰岛素、0.5 mmol/L IBMX、200 μmol/L吲哚美辛。每3~4 d换液,诱导14 d后油红O染色鉴定。成骨诱导培养基为α-MEM培养基,含10%胎牛血清、50 μmol/L维生素 C、0.1 μmol/L 地塞米松、10 mmol/L β-磷酸甘油,每3~4 d换液,诱导21 d,Von Kossa染色鉴定。
1.7 MSC和单个核细胞共培养
将4×104MSC接种于含500 μL完全培养基的24孔板中,24 h后,当培养孔中的贴壁细胞满度约80%时,用PBS冲洗3次,按照分组,将单个核细胞悬液直接加入MSC上或Trans-well上共培养。
1.8 细胞表面标志的检测
将消化后的MSC、处于诱导分化不同时间点的单个核细胞进行离心洗涤,之后将约5×105细胞重悬于100 μL PBS中,根据抗体使用说明添加相应抗体,充分混匀细胞与抗体,并将离心管置于旋转混合仪上进行流式抗体孵育,4℃避光标记40 min,之后重复洗涤细胞3次,用300 μL PBS重悬细胞,BD流式细胞仪检测表面标志的表达并分析。
1.9 实时定量PCR检测mRNA表达水平
用TRIzol提取脐带和骨髓MSC总RNA,各取0.8 μg总RNA进行反转录得到相应的cDNA,采用SYBR Green法实时定量PCR检测相关基因的表达,所用引物序列见表1。
1.10 统计学处理
数据以x±s表示,用t检验进行统计学分析。
2 结果
2.1 建立脐带血造血干/祖细胞向巨核细胞的诱导分化体系
在Xvivo15和细胞因子的混合培养体系中,随着诱导时间的延长,细胞数量增多,逐渐成熟。收集诱导不同天数的单个核细胞进行流式分析,在1 mL培养体系中,培养前单个核细胞中的CD41a和CD61双阳性细胞数为(0.253±0.0814)×106个;在巨核细胞诱导培养基中培养后,随着时间推移,培养细胞中得到的CD41a和CD61双阳性细胞数和阳性比例都明显增加,在3 d时得到的CD41a和CD61双阳性细胞为(1.348±0.224)×106个,6 d时为(2.825±0.267)×106个,扩增了14倍(图1A)。在诱导培养的第0~6 d,随着诱导时间的延长,CD41a、CD61的表达阳性率逐渐增加,6 d时达最高,CD41a+细胞比例可达70%左右,CD41a和CD61双阳性比例可达35%(图1C)。瑞氏吉姆萨染色后进行细胞形态学观察,可见不同阶段的巨核系祖细胞形态,诱导6 d后细胞体积明显增大,并出现了大量多核细胞,细胞核增大,形状不规则,多呈分叶状或多叶扭转状(图1B)。Q-PCR结果显示巨核相关转录因子GATA-1、GATA-2和巨核特异基因CD41、CD61的mRNA表达量与第0 d相比增加明显(图1D)。
2.2 脐带和骨髓MSC的分离、培养、扩增、诱导分化与表型分析
形态学观察,脐带和骨髓MSC形态相似,为形态相对均一的长梭形,细胞贴壁呈平行排列生长或旋涡状生长,细胞折光性较好,核仁明显,胞体较宽。细胞可培养20代以上,在体外均能分化为脂肪细胞和成骨细胞。2种MSC培养至第5代时进行成骨和成脂诱导。MSC在成脂诱导培养液中培养1周,可观察到细胞形态变圆,2周时细胞胞浆内出现脂肪小滴,随后脂滴逐渐增大、增多,3周时通过油红O染色,脂滴被染成红色;在成骨诱导培养液中培养2周后,细胞胞体变宽,呈多边形,4周后,经Von Kossa染色,黑色显示有钙盐沉积形成的结节,提示细胞向成骨细胞分化(图2A)。

表1 引物及序列
对第5代MSC进行流式细胞术检测,发现骨髓和脐带MSC均高表达CD29、CD90、CD166、CD105、CD73,不表达CD34、CD31、CD45(图2B)。这说明骨髓、脐带MSC虽然来源不同,但其表面标志表达一致:两者表达的表面标志具有非单一性,高表达干细胞标志CD90,间充质细胞标志CD105、CD73,以及细胞黏附分子CD29和CD166;不表达造血前体细胞标志CD34、白细胞抗原CD45,也不表达内皮细胞表面抗原CD31,同时也说明我们分离得到的骨髓和脐带MSC为非造血、非内皮类细胞。
2.3 MSC与造血干/祖细胞接触共培养对其向巨核细胞分化的影响
将从脐带血中分离的单个核细胞直接接种于骨髓或脐带MSC上,在巨核分化培养基中诱导3 d后在光镜下观察,发现2种细胞生长状态良好,且巨核细胞多黏附于MSC旁生长(图3A)。实时定量PCR检测发现,与骨髓或脐带MSC共培养6 d后,悬浮细胞中一些巨核相关基因mRNA水平有所增加,特别是CD41、CD61、c-mpl这些巨核系标志性基因的表达,共培养的2组都优于空白对照组,其中与骨髓来源的MSC共培养的巨核细胞基因表达有相对显著的变化(图3B)。相对地,流式细胞术分析悬浮细胞分化情况显示,对照无基质细胞的培养体系,与MSC直接共培养对于促进造血干细胞向巨核细胞分化的效果并不显著。
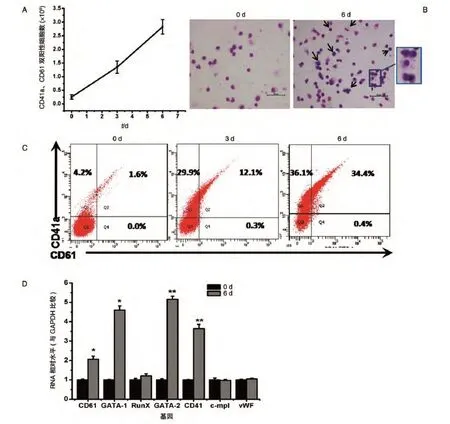
图1 脐带血单个核细胞经体外诱导获得巨核细胞的培养体系的建立
2.4 2种来源的MSC表达造血相关因子的检测
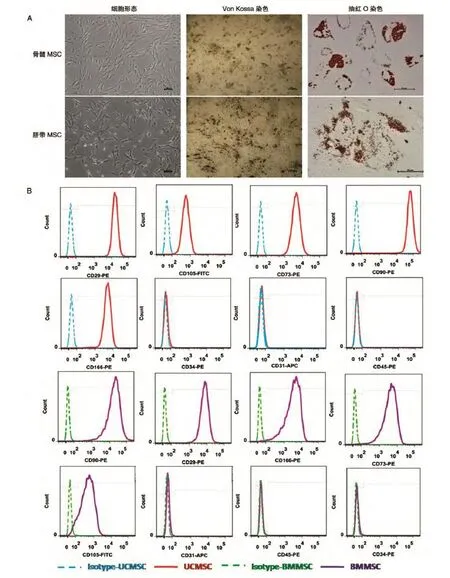
图2 骨髓和脐带来源的间充质干细胞多向分化能力和表面标志的鉴定
相关研究表明,MSC可以表达多种造血因子,包括SCF、Flt3配体、TPO、LIF、G-CSF、GM-CSF、IL-3、IL-6等[17]。针对MSC对巨核细胞增殖分化的支持作用,我们在RNA水平分别检测了脐带和骨髓2种来源的MSC分泌表达巨核诱导相关因子的水平,结果均能检测到TPO、IL-6、IL-7、LIF等促巨核系分化的造血因子的表达。其中TPO在2种间充质细胞中没有明显差异,而IL-6、IL-7、SCF和LIF在骨髓来源的MSC中的表达量更高,GM-CSF在脐带来源的MSC中的表达更高(图4A)。
在所检测的造血因子中,SCF表现出明显的膜结合型和游离型2种形式,其中膜结合型SCF是造血微环境的重要组分,对造血干细胞增殖和髓系分化都发挥关键作用[18]。我们用RT-PCR检测了SCF总量及各型的表达,经过对条带的灰度分析,发现骨髓MSCSCF的总量和游离型SCF均高于脐带MSC,但膜结合型SCF在脐带MSC中的表达更高(图4B)。虽然MSC能够分泌促进巨核分化的相关造血因子,但2种MSC同造血干细胞直接共培养却效果微弱,可能是某些如膜结合型SCF等基质细胞膜蛋白通过直接接触对巨核细胞成熟产生了抑制作用。
2.5 不同的共培养方式下MSC对造血干/祖细胞巨核分化的影响
我们设计了4种不同的共培养方式与非共培养组进行比较(图5A):单个核细胞与脐带MSC接触共培养(UC);单个核细胞与脐带MSC非接触共培养(UC+T);单个核细胞与骨髓MSC接触共培养(BM);单个核细胞与骨髓MSC非接触共培养(BM+T);单个核细胞单独培养作为空白对照组(Control)。空白对照组中不加入任何基质细胞,用巨核细胞诱导培养基悬浮培养。

图3 间充质干细胞与单个核细胞直接共培养对造血干细胞向巨核细胞分化的影响

图4 不同来源的间充质干细胞表达造血因子相关基因的RNA水平的检测
经过4 d的培养,巨核系特异性表面标志CD41a和CD61的表达在2种来源的MSC的接触培养组中与空白对照组相比并没有明显差异(P>0.05);非接触培养时促分化效果显著,其中骨髓非接触培养组中CD41a和CD61双阳性细胞比例为43.7%±1.73%,明显高于脐带非接触培养为36%±1.66%,空白对照组低于上述两组为27.3%±1.3%。可见骨髓和脐带来源的MSC的旁分泌作用有促进巨核分化的能力,但同造血干细胞直接接触的情况下,这种作用的效果就极不明显(图5B)。细胞增殖分析显示,悬浮细胞数在4个共培养组中都明显增加,增长倍数为1.5~2,接触和非接触培养对总有核细胞数的影响没有统计学差异,但在2种不同培养方式中,骨髓来源的MSC均优于脐带来源的MSC,流式细胞术检测表明各组造血前体细胞标志CD34的表达没有明显差异(图5C)。这说明,脐带和骨髓来源的MSC均能够在体外支持造血干/祖细胞的扩增并辅助巨核诱导体系促进巨核系细胞分化,其中本研究使用的脐带来源的MSC对于造血干/祖细胞及巨核祖细胞的支持能力弱于骨髓来源的,并且这种支持作用的差异不论与造血细胞接触与否都能体现,可能是由骨髓细胞分泌更适合巨核分化的生长因子所致。
3 讨论

图5 5种培养体系对造血干/祖细胞向巨核细胞分化以及分化过程中对细胞增殖的影响
目前临床上血小板供应紧张,如何在体外获得大量成熟的巨核细胞成为人们关注的焦点。然而巨核分化是一个复杂的过程,须经历造血干细胞向巨核系的分化、巨核祖细胞的扩增,再进行核内染色体的复制,形成多核的能产生血小板的血小板前体细胞[19]。这个过程受造血微环境及各种正负调控因子的影响。MSC虽然在造血微环境中数量不多,但对造血支持和调控起很大的作用,可以通过分泌TPO、SCF、TGF-β、LIF、G-CSF及白介素家族等细胞因子,依靠旁分泌作用,改变造血干细胞所处的微环境,使造血干细胞维持静止,或者产生促进自我更新或分化等作用[20],同时依靠可溶性分子SDF/CXCR4等趋化因子和整合素家族介导的细胞间接触作用,更精细地调控造血干细胞的增殖和分化[21]。但是,目前MSC在造血干细胞向巨核细胞分化过程中所起的作用存在争议[12-14]。一方面,MSC通过对造血干细胞干性维持,阻碍了造血干/祖细胞的分化和成熟;另一方面,MSC同时也参与构成造血干细胞向巨核细胞分化的微环境,通过提供巨核分化过程中的主要调控因子和生长因子,刺激造血干/祖细胞向巨核细胞的分化及血小板的生成。本研究中,我们对MSC的作用进行了深入分析。
从我们的实验结果来看,与单独利用细胞因子诱导培养相比,通过直接接触的共培养方式,悬浮细胞的数量得到了明显的增加,但CD41a、CD61双阳性细胞的比例并没有很明显的变化,实时定量PCR的结果显示,虽然巨核相关基因的表达有所增加,但效果微弱。这一结果与Zweegman等的报道一致,即MSC主要对造血干/祖细胞的扩增发挥作用,并不促进巨核细胞的分化。有报道显示MSC表面表达CX⁃CL-12、FGF-4等趋化因子和黏附分子,造血干细胞可通过这些表面分子贴附于MSC表面甚至穿过MSC之间的间隙,进入间充干细胞的下面,此时所处的微环境不同,造血干细胞的分化倾向性就会不同。因此,我们设计了4种不同的共培养方式进行对比。用Trans-well上的0.1 μm膜隔开2种干细胞,使之进行非接触培养,造血干细胞只能受MSC的旁分泌作用的影响;而直接共培养组除此之外,还接受细胞间接触作用的影响。在细胞增殖方面两者之间并没有明显差异,但在巨核分化中,非接触培养组明显优于接触组。该结论同时也证实了另一种观点,即MSC具有促巨核细胞分化的作用,而MSC对巨核细胞作用的效果取决于是否存在接触抑制作用。这是由于MSC表面的分子产生了维持干性,抑制巨核分化的作用,还是由于与造血干细胞直接接触共培养使MSC发生了变化,分泌的促巨核分化的相关因子减少,还有待于进一步研究确定。综上推测,MSC在非接触共培养的情况下更易促进巨核细胞的分化和成熟。该诱导培养体系不添加血清,只使用人源基质细胞,对未来体外大规模诱导巨核细胞将有指导意义。
同时,我们就脐带和骨髓这2种临床上最常用的MSC对巨核细胞分化和增殖的促进作用进行了初步对比。在非接触培养条件下,我们的研究结果提示骨髓来源的MSC对巨核细胞的分化促进作用明显优于脐带来源的,而本研究中使用的骨髓MSC能表达更高水平的IL-6、IL-7、LIF及分泌型SCF,推测这些细胞通过旁分泌作用更好地促进巨核细胞分化。Robinson等的研究同样提示,MSC的来源不同,发挥的维持造血干细胞自我更新、促进分化的能力也各不相同[22]。进一步确定不同来源的MSC在分泌表达细胞因子水平上的差异,对于选择优化基质细胞用于造血干/祖细胞的维持和诱导将有指导意义。根据检测到的2种MSC分泌因子的表达水平,也可对巨核培养体系中各因子间的配比进行一定的优化。这一结果将为体外获得更多更成熟的巨核细胞奠定基础。
[1]Matsunaga T,Tanaka I,Kobune M,et al.Ex vivo large-scale generation of human platelets from cord blood CD34+cells[J].Stem Cells,2006,24(12):2877-2887.
[2]Bertolini F,Battaglia M,Pedrazzoli P,et al.Megakaryocytic progenitors can be generated ex vivo and safely administered to autologous peripheral blood progenitor cell transplant recipi⁃ents[J].Blood,1997,89(8):2679-2688.
[3]Scheding S,Bergmannn M,Rathke G,et al.Additional trans⁃plantation ofex vivo generated megakaryocytic cells after high-dose chemotherapy[J].Haematologica,2004,89(5):630-631.
[4]Xi J,Zhu H,Liu D,et al.Infusion of megakaryocytic progeni⁃tor products generated from cord blood hematopoietic stem/pro⁃genitor cells:results of the phase 1 study[J].PLoS One,2013,8(2):e54941.
[5]Aghideh A N,Kheirandish M,Abolghasemi H,et al.Platelet growth factors suppress ex vivo expansion and enhance differ⁃entiation of umbilical cord blood CD133+stem cells to mega⁃karyocyte progenitor cells[J].Growth Factors,2010,28(6):409-416.
[6]De Bruyn C,Delforge A,Martiat P,et al.Ex vivo expansion ofmegakaryocyte progenitorcells:cord blood versusmobi⁃lized peripheral blood[J].Stem Cells Dev,2005,14(4):415-424.
[7]Kishore V,Eliason J F,Matthew H W.Covalently immobi⁃lized glycosaminoglycans enhance megakaryocyte progenitor ex⁃pansion and platelet release[J].J Biomed Mater Res A,2011,96(4):682-692.
[8]Shin J W,Swift J,Ivanovska I,et al.Mechanobiology of bone marrow stem cells:from myosin-II forces to compliance of matrix and nucleus in cell forms and fates[J].Differentia⁃tion,2013,86(3):77-86.
[9]Bernardo M E,Cometa A M,Locatelli F.Mesenchymal stro⁃mal cells:a novel and effective strategy for facilitating engraft⁃ment and accelerating hematopoietic recovery after transplanta⁃tion[J]?Bone Marrow Transplant,2012,47(3):323-329.
[10]Hao L,Sun H,Wang J,et al.Mesenchymal stromal cells for cell therapy:besides supporting hematopoiesis[J].Int J Hema⁃tol,2012,95(1):34-46.
[11]Wandt H,Schaefer-Eckart K,Wendelin K,et al.Therapeutic platelet transfusion versus routine prophylactic transfusion in patients with haematological malignancies:an open-label,mul⁃ticentre,randomised study[J].Lancet,2012,380(9850):1309-1316.
[12]Delehanty L L,Mogass M,Gonias S L,et al.Stromal inhibi⁃tion of megakaryocytic differentiation is associated with block⁃ade of sustained Rap1 activation[J].Blood,2003,101(5):1744-1751.
[13]Zweegman S,Veenhof M A,Debili N,et al.Megakaryocytic differentiation of human progenitor cells is negatively influ⁃enced by direct contact with stroma[J].Leukemia,1999,13(6):935-943.
[14]Cheng L,Qasba P,Vanguri P,et al.Human mesenchymal stem cells support megakaryocyte and pro-platelet formation from CD34(+)hematopoietic progenitor cells[J].J Cell Physiol,2000,184(1):58-69.
[15]Hwang J H,Shim S S,Seok O S,et al.Comparison of cyto⁃kine expression in mesenchymal stem cells from human pla⁃centa,cord blood,and bone marrow[J].J Korean Med Sci,2009,24(4):547-554.
[16]Luan X,Li G,Wang G,et al.Human placenta-derived mes⁃enchymal stem cells suppress T cell proliferation and support the culture expansion of cord blood CD34(+)cells:a compari⁃son with human bone marrow-derived mesenchymal stem cells[J].Tissue Cell,2013,45(1):32-38.
[17]Chaudhary L R,Spelsberg T C,Riggs B L.Production of var⁃ious cytokines by normal human osteoblast-like cells in re⁃sponse to interleukin-1 beta and tumor necrosis factor-alpha:lack of regulation by 17 beta-estradiol[J].Endocrinology,1992,130(5):2528-2534.
[18]Welker P,Grabbe J,Gibbs B,et al.Human mast cells pro⁃duce and differentially express both soluble and membranebound stem cell factor[J].Scand J Immunol,1999,49(5):495-500.
[19]Deutsch V R,Tomer A.Megakaryocyte development and plate⁃let production[J].Br J Haematol,2006,134(5):453-466.
[20]Celebi B,Mantovani D,Pineault N.Irradiated mesenchymal stem cells improve the ex vivo expansion of hematopoietic pro⁃genitors by partly mimicking the bone marrow endosteal envi⁃ronment[J].J Immunol Methods,2011,370(1-2):93-103.
[21]Jing D,Fonseca A V,Alakel N,et al.Hematopoietic stem cells in co-culture with mesenchymal stromal cells-modeling the niche compartments in vitro[J].Haematologica,2010,95(4):542-550.
[22]Robinson S N,Ng J,Niu T,et al.Superior ex vivo cord blood expansion following co-culture with bone marrow-de⁃rived mesenchymalstem cells[J].Bone Marrow Transplant,2006,37(4):359-366.

