PinX1的原核表达、纯化及其与hTERT的相互作用
廉攀峰,程龙,关鑫,邹大阳,梅玲,李俊杰,张菊会,王恩群,叶棋浓
1.军事医学科学院 生物工程研究所,北京 100850;2.安徽医科大学 附属安庆市立医院口腔科,安徽 安庆 246003
Pin2/TRF1结合蛋白X1(Pin2/TRF1-interacting protein X1,PinX1)是一种新型的Pin2/TRF结合蛋白,其编码基因位于染色体8p22-23区域。PinX1近来被鉴定为一个新型抑癌基因[1-2],其发挥作用的机制是以其TID结构域与人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)结合而抑制端粒酶活性,调控端粒长度并调节肿瘤的发生发展。有研究表明,PinX1在许多人类癌细胞中有高频率杂合性缺失(LOH),胃癌、大肠癌及白血病患者的PinX1表达水平明显下降,而在这些癌组织中端粒酶活性显著增强[3-5]。然而,PinX1基因在肿瘤细胞中对端粒酶活性的调控,以及在细胞癌变中的具体作用机制目前尚不十分清楚。
为进一步探讨PinX1对端粒酶活性的调节及其分子机制,进而研究PinX1基因在正常细胞和肿瘤细胞中的功能,我们构建了PinX1基因的原核表达载体,并进行了表达、鉴定和纯化,此外还验证了原核表达的PinX1蛋白与hTERT的相互作用。
1 材料与方法
1.1 材料
人胚肾细胞293T、大肠杆菌BL21、克隆载体pET-32a由本室保存;hTERT表达载体FLAG-hTERT由黄君健教授赠送;Pfu DNA聚合酶、限制性内切酶购自TaKaRa公司;质粒提取、胶回收试剂盒均为Promega公司产品;His抗体购自Sigma公司;引物由北京赛百盛基因技术有限公司合成;测序由北京博迈德生物技术有限公司完成。
1.2 PinX1基因片段的扩增
以乳腺文库为模板,根据GenBank中PinX1基因(NM_017884)序列设计扩增用上游引物(5'-CG GAATTCATGTCTATGCTGGCTGAACG-3')和下游引物(5'-CCCAAGCTTTTTGGAATCTTTCTTCTTCTTC T-3'),上下游引物分别携带EcoRⅠ和HindⅢ酶切位点。扩增条件:95℃预变性5 min,按95℃变性30 s、55℃退火30 s、72℃延伸1.5 min进行30个循环,72℃延伸7 min。
1.3 pHis-PinX1质粒的构建与测序
在37℃下,用EcoRⅠ和HindⅢ双酶切pET-32a载体4 h,经琼脂糖凝胶电泳后,回收载体大片段;将PCR产物回收后再用EcoRⅠ和HindⅢ双酶切,用T4DNA连接酶连接入pET-32a载体,转化大肠杆菌BL21感受态细胞,筛选阳性克隆,振荡培养并提取质粒,用EcoRⅠ和HindⅢ双酶切鉴定,将酶切鉴定正确的克隆送北京博迈德生物技术有限公司测序。
1.4 His-PinX1蛋白的诱导表达
将构建的表达PinX1的重组质粒和表达His的空载体pET-32a转化大肠杆菌BL21,转化子于37℃振荡过夜,再按2%的接种量转接到5 mL含氨苄西林的LB培养基中,37℃培养2~3 h,当D600nm值达到0.6~0.8后,加入IPTG至终浓度为0.1 mol/L,于37℃继续诱导培养4 h,4℃、3000 r/min离心10 min,收集菌体,加入2×SDS-PAGE缓冲液后电泳鉴定。
1.5 表达产物的鉴定

图1 目的基因的PCR扩增
采用Western印迹鉴定His-PinX1。样品经SDS-PAGE后转移到硝酸纤维素膜上,用5%的脱脂奶粉于室温封闭1 h,加入用5%脱脂奶粉稀释的辣根过氧化物酶(HRP)标记的His单克隆抗体,室温轻摇1 h,用TBST洗膜3次,每次7 min,用化学反光法显色5 min,压片显影。
1.6 His-PinX1蛋白的纯化
收集上述诱导菌,利用His-PinX1蛋白可结合His磁珠的特点,用His磁珠颗粒纯化PinX1融合蛋白。即按10∶1的比例加入细胞裂解液(50 mmol/L Tris-HClpH7.5,150 mmol/L NaCl,1 mmol/L EDTA,0.3 mmol/L DTT,1 g/L NP-40,蛋白酶抑制剂),超声波破碎,离心收集上清液,加入适量His磁珠颗粒,4℃旋转结合4 h,再收集His磁珠颗粒,充分洗脱未结合的蛋白质,即得到结合有His-PinX1蛋白的磁珠颗粒。
1.7 PinX1与hTERT的相互作用分析
将人胚肾细胞293T以70%密度,用不含双抗、含100 ml/L胎牛血清的DMEM培养基接种于直径6 cm的培养皿中,培养24 h后,按Vigofect说明书转染方法将带Flag标签的hTERT真核表达质粒转入293T细胞,4~6 h后换培养基,37℃、5%CO2常规培养24 h后收集细胞加入IP缓冲液500 μL,冰上裂解细胞30 min,超声波破碎细胞后4℃、12 000 r/min离心10 min,将纯化的His-PinX1融合蛋白加到细胞裂解液中,4℃旋转结合3~6 h后3000 r/min离心收集珠子,用缓冲液充分洗脱未结合蛋白,West⁃ern印迹检测2种蛋白质之间的直接相互作用。
2 结果
2.1 PinX1基因片段的PCR扩增
以乳腺文库为模板,PCR扩增PinX1基因序列,扩增产物约980 bp,与预期片段大小一致(图1)。
2.2 重组质粒的酶切鉴定
用EcoRⅠ和HindⅢ双酶切重组质粒pHis-PinX1,得到与预期片段大小相符的外源基因插入片段(图2),而对照pET-32a经同样双酶切后无插入片段,说明克隆成功。序列测定证明,His-PinX1编码区序列完全正确(数据略)。
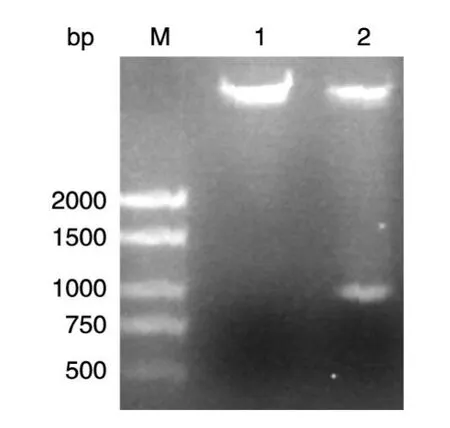
图2 EcoRⅠ和HindⅢ双酶切鉴定重组质粒
2.3 His-PinX1的诱导表达
将重组质粒和pET-32a分别转化大肠杆菌BL21,转化菌经IPTG诱导,SDS-PAGE检测结果表明,转化重组质粒的工程菌在相对分子质量约57×103处有特异性表达条带(图3);Western印迹鉴定表明,这些特异性表达带可与His抗体发生特异反应,说明His-PinX1重组菌成功表达了His-PinX1蛋白(图4)。
2.4 His-PinX1蛋白的纯化
含有重组质粒pHis-PinX1的转化菌经19℃诱导表达,并经His磁珠亲和纯化后,获得了高纯度目的蛋白(图5)。
2.5 PinX1与hTERT相互作用分析
为进一步证实纯化的His-PinX1可与hTERT蛋白在体外直接相互作用[1],将带有His-PinX1的纯化珠子与过量表达Flag-hTERT的293T细胞裂解液于4℃结合后进行Western印迹,结果显示与His空珠子孵育的样品利用Flag-HRP抗体检测无特异条带,而与His-PinX1珠子孵育的样品能检测到特异的hTERT蛋白条带(图6),说明PinX1蛋白与hTERT蛋白能够特异地相互作用。
3 讨论
端粒酶是一种特殊的逆转录酶,由RNA模板和发挥催化作用的酶组成,可调节端粒长度。近年来对端粒酶进行了大量研究,表明端粒酶活性与恶性肿瘤密切相关,且端粒酶表达水平与肿瘤的预后有关[6-9]。端粒、端粒酶对肿瘤细胞的发生发展起着重要作用。研究表明,PinX1可直接结合于端粒酶的RNA组分,阻断端粒酶RNA,从而使其丧失活性,破坏其模板功能,导致端粒酶活性的下降和端粒的缩短,从而发挥抑癌基因的作用[10-13]。

图3 SDS-PAGE检测His-PinX1的表达
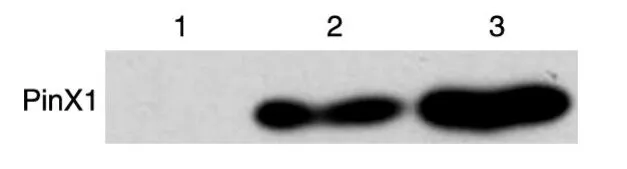
图4 Western印迹鉴定His-PinX1的表达
我们以人乳腺文库DNA为模板,克隆得到PinX1基因,构建了原核表达载体pHis-PinX1,SDSPAGE和Western印迹检测证明我们构建的His-PinX1表达成功。在人肾胚细胞293T中转染并纯化得到hTERT蛋白后,检测证实PinX1与hTERT存在相互作用。下一步实验将深入探讨PinX1与hTERT的相互作用定位,以及PinX1抑制端粒酶活性的分子机制,为探讨PinX1基因在调节肿瘤发生发展中的意义奠定基础。
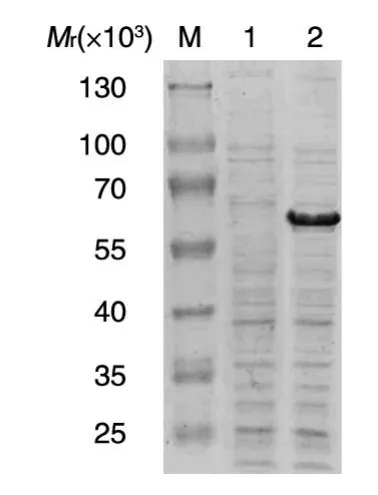
图5 His-PinX1蛋白的纯化
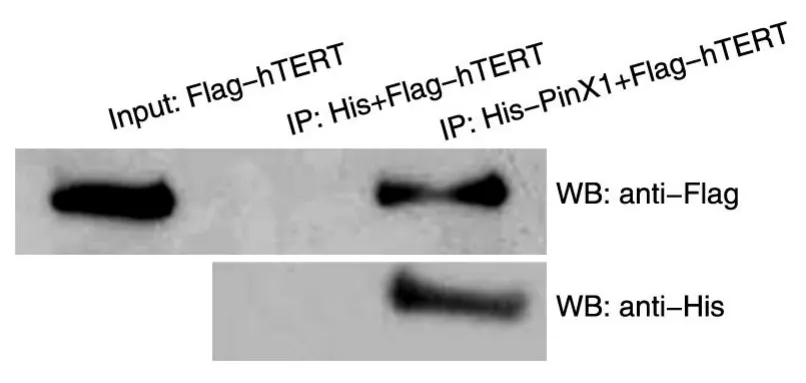
图6 Western印迹检测PinX1蛋白与hTERT蛋白的相互作用
[1]Zhou X Z,Lu K P.The Pin2/TRFI-interacting protein PinX1 is a potent telomerase inhibitor[J].Cell,2001,107:347-359.
[2]Park W S,Lee J H,Park J Y,et al.Genetic analysis of the liver putative tumor suppressor gene in hepatocellular carcino⁃mas[J].Cancer Lett,2002,178:199-207.
[3]王洪斌,王伟强,汪兴伟,等.重组PinX1真核表达载体的构建及其对胃癌MKN28细胞增殖的抑制作用[J].第三军医大学学报,2009,12(31):1209-1212.
[4]Hawkins G A,Chang B L,Zheng S L,et a1.Mutational anal⁃ysis of PinX1 in hereditary prostate cancer[J].Prostate,2004,60(4):298-302.
[5]Zhang B,Bai Y X,Ma H H,et al.Silencing Pinxl compro⁃mises telomere length maintenance as well as tumor igenicity in telomerase-positive human cancercells[J].CancerRes,2009,69(1):75-83.
[6]Lin J,Blackburn E H.Nucleolar protein PinX1 regulates telomerase by sequestering its protein catalytic subunit in an inactive complex lacking telomerase RNA[J].Genes Dev,2004,18(4):387-396.
[7]Feldser D M,Greider C W.Short telomeres limit tumor pro⁃gression in vivo by inducing senescence[J].Cancer Cell,2007,11(5):461-469.
[8]Chang Q,Pang J C,Li J,et al.Molecular analysis of PinX1 in medulloblastornas[J].Int J Cancer,2004,109:309-314.
[9]Nathanson K L,Wooster R,Weber B L.Breast cancer genet⁃ics:what we know and what we need[J].Nat Med,2001,7(5):552-556.
[10]Hartman A R,Ford J M.BRCA1 and p53:compensatory roles in DNA repair[J].J Mol Med,2003,81(11):700-707.
[11]Kondo T,Oue N,Mitani Y,et al.Loss of heterozygosity and histone hypoacetylation of the PinX1 gene are associated with reduced expression in gastric carcinoma[J].Oncngene,2005,24:157-164.
[12]Qian D,Zhang B,He L R,et al.The telomere/telomerase binding factor PinX1 is a new target to improve the radiother⁃apy effectofoesophagealsquamous cellcarcinomas[J].J Pathol,2013,229(5):765-774.
[13]Cheung D H,Kung H F,Huang J J,et al.PinX1 is in⁃volved in telomerase recruitmentand regulates telomerase function by mediating its localization[J].FEBS Lett,2012,586(19):3166-3171.

