大肠杆菌L-色氨酸合成的代谢流分析
申彤,徐庆阳,张成林,谢希贤
1.天津科技大学 生物工程学院,工业发酵微生物教育部重点实验室,天津 300457;2.新疆大学 生命科学与技术学院,新疆 乌鲁木齐 830046
L-色氨酸是人体必需的氨基酸,广泛应用于医药、食品和饲料工业等领域,但因目前生产成本较高,限制了其应用规模。近年来,随着市场需求的加大,色氨酸的生产规模不断扩大,对生产菌株的要求也越来越高。应用重组DNA技术和相关的遗传学手段进行有精确目标的基因操作,这一代谢工程新思路已在色氨酸生产菌中得到广泛应用,大大提高了色氨酸的发酵产酸水平,其育种的高度定向性也大大改善了过去诱变育种的盲目性[1]。代谢流分析(metabolic flux analysis,MFA)是对代谢途径流量进行测定分析的方法[2]。近年来,人们通过代谢工程方法改变细胞内部的代谢流分布,使其生成更多的目的产物。代谢流分析成为代谢工程中用以指导遗传操作的理论基础,是代谢网络分析的基本方法[3]。
为了使大肠杆菌中心代谢流能更多地进入色氨酸合成的代谢途径,我们用基因重组技术构建了转酮酶基因(tktA)和磷酸烯醇式丙酮酸合成酶基因(ppsA)过表达质粒pEML03[4],增加色氨酸前体物质4-磷酸赤藓糖(E4P)和磷酸烯醇式丙酮酸(PEP)的浓度,从而提高色氨酸产量。利用Red重组技术敲除贮碳因子基因(csrA),增加色氨酸前体物质PEP的供应量,并在原菌株和敲除csrA基因的菌株中分别转入pEML03,再对上述菌株进行30 L分批发酵试验,考察基因重组对色氨酸发酵过程的影响。通过测定在拟稳态下主要代谢物浓度的变化速率,得到了原菌株和重组菌株L-色氨酸合成的代谢流量分布图,通过对主要路径和关键节点的代谢流分析,阐述了基因操作对L-色氨酸合成代谢流的影响。
1 材料与方法
1.1 材料
L-色氨酸生产菌TRTH0709(E.coliK12 ΔcsmΔtrpRΔtna/pSV-709)、TRTH1013(TRTH0709含有tktA和ppsA共表达质粒pEML03)、TRTH1105(TRTH0709ΔcsrA)、TRTH1107(TRTH1105含有质粒pEML03)由天津科技大学代谢工程研究室保藏。种子培养基和发酵培养基见参考文献[5]。酵母粉、蛋白胨(OXOID公司);Na2SO4、CuSO4·7H2O等其他培养基试剂(天津市北方天医化学试剂厂);色氨酸、丙氨酸、缬氨酸、天冬氨酸等(Sigma公司);2,4-二硝基氟苯(天津德宇生物技术公司);5 L、30 L发酵罐(上海保兴生物设备工程有限公司);氨基酸专用色谱柱(C18,5 μm,250 mm× 4.6 mm,No.20200031)。
1.2 摇瓶及发酵罐培养
[5]。
1.3 分析方法
菌体生物量、菌体比生长速率μ、葡萄糖浓度、L-色氨酸含量测定见参考文献[5];氨基酸的检测见参考文献[6]。
2 结果与讨论
2.1 L-色氨酸发酵过程曲线
发酵过程中每隔2 h取样测定菌体的生物量、葡萄糖消耗量及L-色氨酸的生成量。整个发酵过程中以上参数的变化情况曲线见图1,可以看出TRTH1013在生长早期,生长速度略低于出发菌,但在中后期能维持较高生长速度,最高生物量与TRTH0709相比仅低1.8%,最终色氨酸的产量达到40.2 g/L,增长幅度为11.9%。TRTH1105在对数期与原菌株生长速度几乎一致,到达稳定期后菌体增速大于原菌株,最高菌体量达到49.0 g/L,比原菌株提高2.9%,色氨酸产量为37.7 g/L,与原始菌株相比提高了5%。TRTH1107的最大生物量为48.5%,比原菌株提高1.9%,色氨酸最终积累量为41.2 g/L,比原菌株提高了15.1%。
从图1还可看出,发酵进入26 h后,菌体数量基本不再增长,色氨酸在26~28 h期间处于高速增长期,同期耗糖速度也较快。将这段时间假设为拟稳态,细胞生长速度为零,胞内代谢物浓度变化为零。
2.2 重组菌株与出发菌株的代谢流分析比较
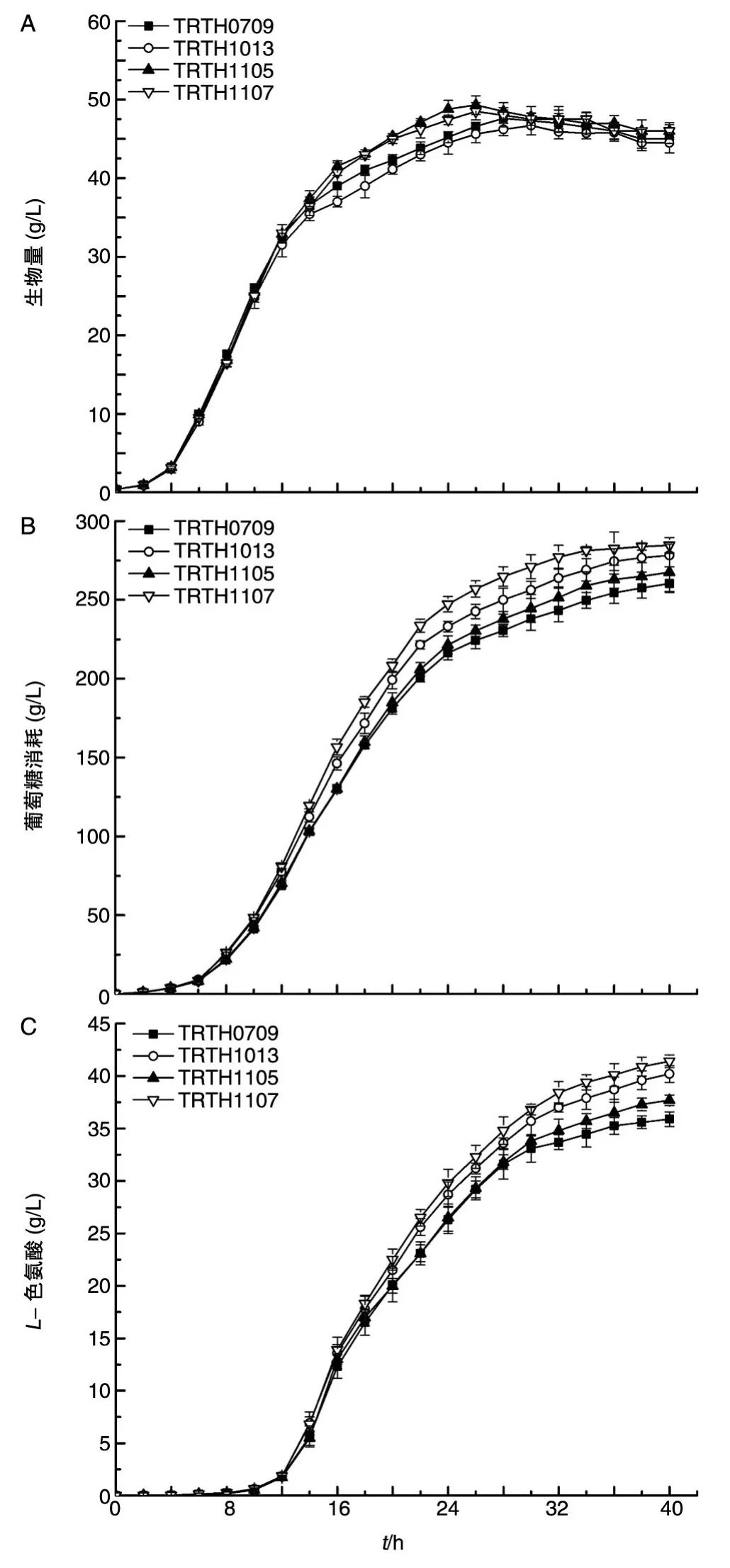
图1 出发菌株和重组菌株的分批发酵试验
据文献报道[7-10],大肠杆菌的代谢网络包括糖酵解(EMP)、三羧酸(TCA)循环、磷酸戊糖(HMP)途径、磷酸烯醇式丙酮酸羧化酶(PPC)催化的回补途径、磷酸转移酶系统(PTS)及乙酸、乳酸等代谢副产物的积累。因发酵控制采用零残糖流加工艺,在进入稳定期后,几乎无溢流代谢物乙酸、乳酸的积累,因此不考虑乙酸、乳酸的生成途径。本研究所用菌种为苯丙氨酸和酪氨酸缺陷型,因此代谢途径中不考虑苯丙氨酸和酪氨酸合成支路。结合上述分析,建立代谢网络。分别测定并计算拟稳态时期26~28 h的葡萄糖消耗速率、色氨酸生成速率及发酵液中能够检测到的丙氨酸、缬氨酸、蛋氨酸和组氨酸的浓度变化速率(表1),分别转换成摩尔流量后,以葡萄糖的代谢流为100进行标准化处理,用MATLAB软件计算代谢流分布。初步计算表明各供试菌株在色氨酸发酵中后期由中心代谢途径r8提供的NADPH已完全能够满足氨基酸合成的需要,G6P到Ru5P的反应是不可逆反应,r10的计算结果均为负值,不符合代谢的生化热力学。在这种情况下r10的反应被关闭[11-12],因此设定r10为零,在代谢流计算时也不考虑NADPH节点处的反应平衡式。在此前提下,建立的方程组包括20个方程、26个未知数,自由度为6,根据已知参数用MATLAB软件计算,实际代谢流分布如图2所示。
代谢流分析结果表明,过表达tktA和ppsA(TRTH1103),使EMP(r3)途径代谢流减少1.6%,HMP(r11)途径增加9.6%,TCA循环(r8,r9)减少了7.0%,最终使色氨酸生成途径代谢流增加了13.3%。敲除csrA基因(TRTH1105),EMP途径代谢流几乎未变,HMP途径增加1.3%,TCA循环增加了1.4%,最终使色氨酸生成途径代谢流增加了2.1%。在csrA基因敲除菌中转入tktA和ppsA过表达质粒(TRTH1107),使EMP途径代谢流减少4.0%,HMP途径增加13.6%,TCA循环减少了8.0%,最终使色氨酸生成途径代谢流增加了15.7%。从以上分析数据可以看出,ppsA和tktA分别对PEP和E4P的生成起关键作用,2种基因的共同表达能显著影响中心代谢流,使其转向色氨酸的生成途径。敲除csrA基因,会对直接或间接参与PEP代谢的若干酶产生影响,导致细胞内PEP水平提高[13]。以往研究指出[14],仅凭借PEP胞内浓度的增加对色氨酸产量不会有太大影响,需要同时使色氨酸合成的另一个重要的限制性底物E4P的浓度与PEP相平衡,才能进一步提高色氨酸合成。而tktA和ppsA过表达质粒的转入令PEP和E4P的浓度同时增加,PEP除了与E4P一起进入色氨酸合成途径外,还会分流转化为PYR,进入TCA循环或通过PEP羧化酶催化合成草酰乙酸,并且主要参与PTS葡萄糖的运输。与PEP相比,E4P没有竞争途径分流。所以,2个前体物质中PEP可能存在供应不足的问题,csrA基因的敲除会进一步补充PEP的供应量。从TRTH1107的代谢流分析可以看出,2种遗传标记的叠加使色氨酸代谢流进一步增加,达到了15.7%。
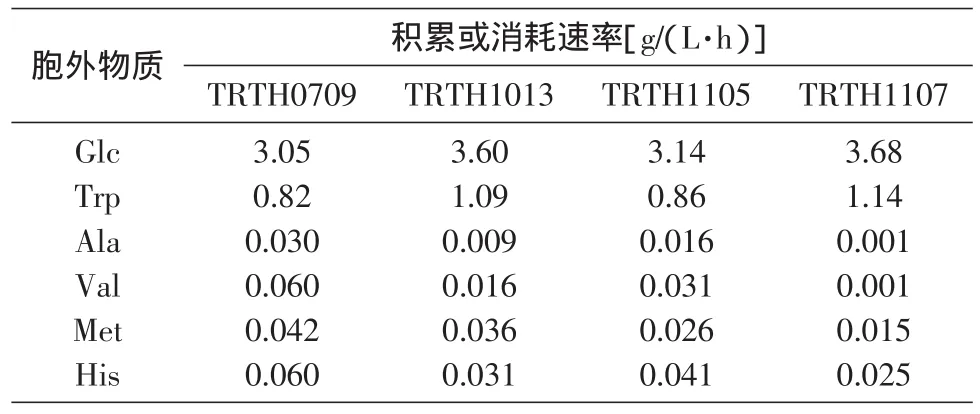
表1 代谢产物变化速率(26~28 h)(P<0.05)

图2 出发菌株和重组菌株色氨酸合成的代谢流分布
从连接中心代谢途径和色氨酸生成途径的关键节点PEP处的流量分配可以看出,PEP生成OAA的流量,tktA和ppsA过表达菌减少了20%,csrA基因的敲除菌减少了33%,二者标记叠加后减少了47%;由PYR生成PEP的量,3株重组菌分别增加了58%、6.5%和70%。同样说明tktA和ppsA过表达显著加强了PYR逆转生成PEP的流量,单纯敲除csrA基因对流量的影响较小,但在tktA过表达的情况下可以明显加大由PYR生成PEP的流量。以上2项流量分配的变化,有力地促进了PEP进入色氨酸合成途径的代谢流量。另外,从副产物氨基酸的流量变化的逐渐降低,也可证实tktA、ppsA的过表达和csrA的敲除对出发菌株的色氨酸基因改造是成功的。
3 结论
综合以上代谢流的分析结果可以看出,针对大肠杆菌中心代谢途径的基因操作,tktA和ppsA的过表达、csrA的敲除,以及二者的叠加,均能有效改变中心代谢途径的流量,并增加L-色氨酸生成的代谢流。但tktA和ppsA过表达的影响更为显著,虽然csrA的敲除对各代谢途径影响不大,但可以适当补充因分流而造成的PEP的不足,在质粒pEML03存在的情况下能显著增加L-色氨酸生成的代谢流。从各副产物的流量分析也可以看出仍有继续使其降低的必要。另外,葡萄糖转运系统(PTS)消耗了大量PEP,因此对ATP的需求较大使TCA循环的代谢流比例较大,碳代谢流主要消耗在TCA循环,使色氨酸生成途径的碳代谢流偏低,寻求不消耗PEP的转运系统代替PTS,能够较好地解决这个问题。
参考文献
[1]Masato I. Towards bacterial strains overproducing L-trypto⁃phan and other aromatics by metabolic engineering[J].Appl Microbiol Biotechnol,2006,69:615-626.
[2]Bonarius H P,Schmid G,Tramper J.Flux analysis of under⁃determined metabolic networks:the quest for the missing con⁃straints[J].Trends Biotechnol,1997,15:308-314.
[3]van Gulik W M,Heijnen J J.A metabolic network stoichiome⁃try analysis of microbial growth and product formation[J].Bio⁃technol Bioeng,1995,48:681-698.
[4]Shen T,Liu Q,Xie X X,et al.Improved production of trypto⁃phan in genetically engineered Escherichia coliwith TktA and PpsA overexpression[J].J Biomed Biotechnol,2012,2012:605219.
[5]程立坤,黄静,秦永锋,等.代谢副产物乙酸对L-色氨酸发酵的影响[J].微生物学通报,2010,37(2):166-173.
[6]Chen N,Huang J,Feng Z,et al.Optimization of fermentation conditions for the biosynthesis of L-threonine by Escherichia coli[J].Appl Biochem Biotechnol,2009,158,595-604.
[7]Fischer E,Sauer U.Metabolic flux profiling of Escherichia co⁃li mutants in central carbon metabolism using GC-MS[J].Eur J Biochem,2006,270:880-901.
[8]Almaas E,Kovacs B,Vicsek T,et al.Global organization of metabolic fluxes in the bacterium Escherichia coli[J].Nature,2004,427:839-843.
[9]张蓓.代谢工程[M].天津:天津大学出版社,2003.
[10]Walsh K,Koshland D E.Branch point control by the phos⁃phorylation state of isocitrate dehydrogenase[J].J Biol Chem,1985,260:8430-8437.
[11]Gottschalk G.Bacterial metabolism[M].2nd ed.New York:Springer-Verlag,1986.
[12]Zhao J,Shimizu K.Metabolic flux analysis of Escherichia co⁃li K12 grown on 13C-labeled acetate and glucose using GCMS and powerfulflux calculation method[J].J Biotechnol,2003,10:101-117.
[13]Sabnis N A,Yang H,Romeo T.Pleiotropic regulation of cen⁃tralcarbohydrate metabolism in Escherichia coli via the gene csrA[J].J Biol Chem,1995,270:29096-29104.
[14]Patnaik R,Liao J C.Engineering of Escherichia coli central metabolism for aromatic metabolite production with near theo⁃retical yield[J].Appl Environ Microbiol,1994,60:3903-3908.

