肝硬化小鼠肠道菌群结构及血清炎性因子的变化
魏晓,杨展,崔茜,邹大阳,闫夏贝,王思淼,黄留玉,袁静
军事医学科学院 疾病预防控制所,北京 100071
肝硬化的病理学标志是瘢痕组织替代了正常的肝脏软组织,门脉高压,阻止血流通过肝脏,导致胃肠道淤血、组织水肿、胃肠蠕动减慢、肠道通透性增加,同时,肝功能损害导致对药物、氨基酸等的清除功能下降,并且胆汁和胆酸分泌减少[1],直接影响到肠道微生物结构的变化,肠道菌群的紊乱变化也有可能导致血液炎性因子发生变化。
我们通过CCl4灌胃法构建了昆明小鼠肝硬化的动物模型,并结合荧光定量PCR及酶联免疫分析(ELISA)实验,对肝硬化小鼠肠道菌群结构及血液炎性因子的变化进行了研究和分析。
1 材料与方法
1.1 肝硬化小鼠动物模型的建立
清洁级昆明小鼠60只,6周龄,雌雄各半,体质量为30~35 g,购自军事医学科学院实验动物中心,正常饲喂,统一饮水。将小鼠分为对照组和造模组,各30只,每组雌雄各半。对照组小鼠无菌灌胃花生油溶液,造模组小鼠无菌灌胃体积分数为40%的CCl4花生油溶液,首次灌胃剂量为5 mL/kg,之后每周灌胃2次,每次剂量均为3 mL/kg,持续16周。
1.2 肝脏组织病理检测
造模后的0、4、8、12、16周,分别随机处死1只造模小鼠,处死前对小鼠禁食禁水24 h。解剖肝脏,观察组织病变情况。如病理检测结果显示出现典型的肝小叶结节,说明造模成功。
1.3 小鼠肠道目的菌群的荧光定量PCR检测
60只小鼠分别在给药前及造模成功后采集新鲜的粪便样品,置于灭菌的Eppendorf管中,-80℃保存。用试剂盒(QIAamp DNA Stool Mini Kit)提取粪便样品中的全基因组DNA。肠道目的菌群的特异性引物由上海生工生物工程公司合成(表1)。
采用MJ Opticon-2定量PCR仪(Bio-Rad公司)及其配套分析软件(MJ Opticon Monitor分析软件,V3.1)测定小鼠肠道目的菌群的变化。定量试剂采用SYBR@Premix EX Taq试剂盒(TaKaRa生物工程公司)。荧光定量PCR(RT-PCR)反应体系为20 μL,包括2×SYBR Premix EX Taq 10 μL、引物0.5 μL、模板DNA 1 μL、灭菌去离子水8.5 μL。RTPCR反应程序为94℃预变性1 min,然后以94℃变性40 s、退火30 s(不同目的菌群退火温度详见表1)、72℃延伸45 s循环35次,最后72℃延伸10 min。循环结束,通过分析RT-PCR反应的融解曲线来决定产物的特异性,从60到95℃,每升温0.2℃且持续10 s后,自动采集反应管中反应液的荧光信号。
1.4 小鼠血液炎性指标的监测
造模后0、4、8、12、16周,对小鼠尾部采血,每只小鼠采血1 mL,置于灭菌的Eppendorf管中,3000 r/min离心20 min,取上清,-80℃保存。分别采用小鼠内毒素、IL-1、IL-6、TNF-α ELISA试剂盒(上海恒远生物科技有限公司)检测血清内毒素及炎性因子(IL-1、IL-6、TNF-α)水平的变化。
1.5 统计学分析
用SPSS软件,采用Wilcoxon非参数检验对小鼠肠道菌属丰度的变化进行统计学分析,采用Stu⁃dent t检验对小鼠血清内毒素及细胞因子的水平差异进行统计学分析。
2 结果
2.1 小鼠外观
造模组小鼠在造模过程中活动量较少,精神状态较差,对外界反应较迟钝,毛发无光泽,体重增长缓慢,第8周开始排黑便。正常对照组小鼠体态活泼,毛发有光泽,食欲正常,大便正常。
2.2 肝脏组织病理学
造模组和对照组小鼠均无意外死亡。CCl4给药后0、4、8、12、16周分别随机处死1只小鼠,共5只,观察肝脏病理进展(图1),至CCl4给药后16周,造模组小鼠全部诱导出肝硬化。
2.3 肝硬化小鼠肠道菌群结构的变化
小鼠粪便中目的菌属的含量以每克湿便含16S rRNA基因拷贝数表示,将每克湿便所含的16S rRNA基因拷贝数进行对数转换,用于统计学分析。采用荧光定量PCR法检测肝硬化小鼠肠道菌群结构的变化。结果显示,造模前60只小鼠肠道特定菌属的丰度无显著差异;在造模第16周,对照组小鼠肠道中特定菌属丰度无显著变化,而造模组小鼠拟杆菌属(P<0.01)和梭菌属(P<0.05)细菌显著减少,韦荣球菌属(P<0.05)、肠杆菌属(P<0.01)和肠球菌属(P<0.01)细菌显著增加(图2)。

表1 肠道目的菌群RT-PCR反应所需引物及退火温度

2.4 肝硬化小鼠血清炎性因子的变化
随着肝硬化进程的加重,小鼠血液中内毒素(ET)及炎性因子(IL-1、IL-6、TNF-α)的水平显著提高(表2)。在造模第8周,肝细胞水肿坏死严重,并伴有炎性细胞的浸润,肝脏代谢能力受损严重,此时,血液内毒素及炎性因子的水平显著增高。
3 讨论
肝硬化可由一种或多种病因长期作用而造成弥漫性肝脏损害,肝细胞变性、坏死、再生,纤维组织增生,最终导致肝小叶结构破坏,假小叶形成。可伴随有腹水、黄疸、肝昏迷等。
要深入研究肝硬化的发病机制及预后,必须建立较为理想的肝纤维化动物模型。目前常用的肝硬化造模方法有CCl4法、二甲基亚硝胺(DMN)法、D2-半乳糖胺法、胆管阻塞法、免疫法、营养不良法、乙醇法等。传统的CCl4造模方法包括灌胃、皮下注射和腹腔注射,本研究采用的灌胃注射是一种具有较高成功率及较低意外致死率的方法。造模时间依给药途径和剂量而不同,通常为12~16周。CCl4诱导小鼠肝脏纤维化是一种比较典型的肝硬化模型,在形态学及病理生理学方面与人的肝纤维化相似度最高,如均具有肝细胞坏死后的再生、中央静脉壁和汇管区的血管壁周围有明显纤维增生、形成纤维化等,而且造模简单,已被广泛应用。
拟杆菌属为肠道中严格厌氧革兰阳性细菌,是肠道菌膜屏障的一部分。肝硬化小鼠肠道中拟杆菌属细菌显著减少,从而为条件致病菌的侵袭和定殖提供了机会。肝硬化小鼠肠道中显著增加的韦荣球菌属、肠杆菌属和肠球菌属均为革兰阴性细菌,可以产生内毒素。由于正常肝脏Kupffer细胞的清除功能,内毒素在血液中的含量极其微弱,小于0.1 EU/mL,不会形成内毒素血症;而对于肝硬化小鼠来说,由于肝脏清除功能降低,肝硬化引起的门脉高压进一步导致肠壁水肿,通透性增加,这些因素共同作用,导致内毒素入血增加。一方面,内毒素可以诱导一些细胞因子(TNF、IL-1和IL-6)的分泌,已有文献表明,这些细胞因子会引起细胞外基质的合成和降解异常,从而促进肝纤维化的进程[7]。Li等[8]研究发现,肝硬化患者肠道中肠杆菌科的水平与血内毒素水平呈正相关。另一方面,肠道中韦荣球菌属、肠杆菌属和肠球菌属过度繁殖,其产生的过量内毒素会抑制肠上皮细胞的蛋白质合成,因此肠壁屏障受损,进一步威胁肠道微环境,导致肠道菌群失调,从而形成恶性循环。以上结论可用图3概括。由此可见,肠道菌群对肝硬化的预后有很大的影响,未来有希望通过改善肠道菌群结构来促进肝硬化患者的预后,改善其生活质量。

图2 肝硬化小鼠肠道目的菌群RT-PCR检测结果
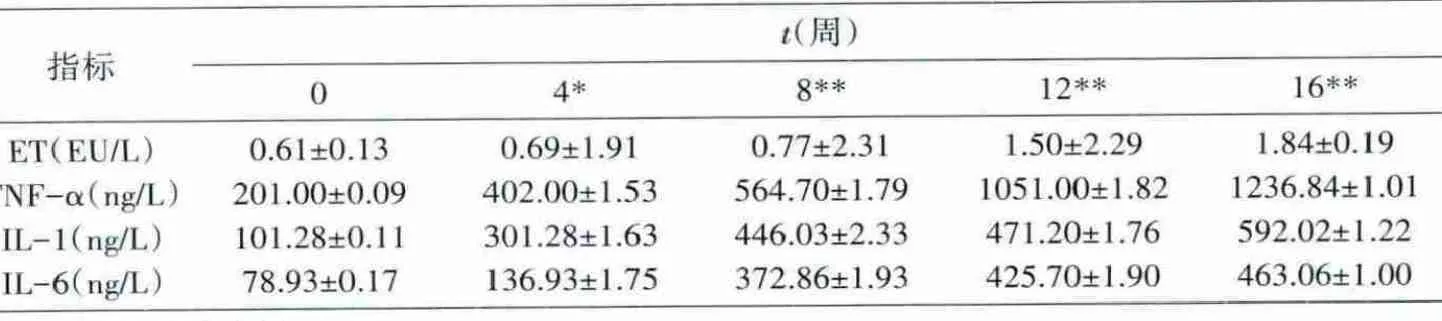
表2 肝硬化进程中小鼠血液内毒素及炎性因子水平的变化(x±s)

[1]SchreiberS,RosenstielP,AlbrechtM,etal.Geneticof Crohn disease,an archetypal inflammatory barrier disease[J].Nat Rev Genet,2005,6(5):376-388.
[2]Layton A,McKay L,Williams D,et al.Development of bacte⁃roides 16S rRNA gene TaqMan-based real-time PCR assays for estimation of total,human,and bovine fecal pollution in water[J].Appl Environ Microbiol,2006,72(6):4214-4224.
[3]Rinttilä T,Kassinen A,Malinen E,et al.Development of an extensive set of 16S rDNA-targeted primers for quantification of pathogenic and indigenous bacteria in faecal samples by re⁃al-time PCR[J].J Appl Microbiol,2004,97(6):1166-1177.
[4]Bartosch S,Fite A,Macfarlane G T,et al.Characterization of bacterial communities in feces from healthy elderly volunteers and hospitalized elderly patients by using real-time PCR and effects of antibiotic treatment on the fecal microbiota[J].Appl Environ Microbiol,2004,70(6):3575-3581.
[5]Jarzembowski T,Daca A,Bryl E,et al.Increased pheromone cCF10 expression in Enterococcus faecalis biofilm formed by isolates from renal transplant patients[J].Curr Microbiol,2012,65(6):656-659.
[6]Song Y,Liu C,Finegold S M.Real-time PCR quantitation of clostridia in feces of autistic children[J].Appl Environ Micro⁃biol,2004,70(11):6459-6465.
[7]Wu C,Li M,Chen C,et al.Endotoxin-induced liver injury and plasma tumor necrosis factor-α,interleukin-6 level chang⁃es in rabbits[J].Chin Med J,1995,108(7):548-550.
[8]Li L,Wu Z,Ma W,et al.Changes in intestinal microflora in patients with chronic severe hepatitis[J].Chin Med J,2001,114(8):869-872.

