核磷蛋白NPM1的RNA干扰慢病毒载体的构建及鉴定
王亚楠,金蕊,张宪,马世良,黄君健
1.沈阳农业大学 生物科学技术学院,辽宁 沈阳 110866;2.军事医学科学院 生物工程研究所,北京 100850
RNA干扰技术发现以来,它在人类疾病治疗方面得到迅速发展,为某些疾病的治疗提供了新的策略。RNA干扰可以使特定的基因沉默,利用RNA干扰治疗疾病的优势在于它可以特异而高效地敲除引起疾病的基因的表达。RNA干扰常用的是小干扰RNA(siRNA)和短发夹RNA(shRNA)。siRNA可以暂时降低基因的表达,但随着细胞的分裂,siRNA的浓度就会降低,需要经常性的转染,很难适应细胞试验中需要长期培养细胞的需要;而shRNA可以插入RNA干扰载体中,只要shRNA能够转录即可对目标基因造成长期、稳定的敲除作用[1-2]。因此,shRNA干扰越来越受到重视。慢病毒载体可以将外源基因整合到宿主染色体上,同时其极高的转染效率在临床研究上效果非常明显,已得到广泛应用。在本研究中,我们针对人核磷蛋白(nucleophosmin,NPM)NPM1基因,用pll3.7质粒载体构建了有效的shRNA干扰慢病毒载体,为研究NPM1在肿瘤发生、发展中的作用及肿瘤的治疗提供一个有力的工具。
NPM1是NPM家族(包括NPM1、NPM2、NPM3等3种亚基)中重要的一员,又名B23、numatrin或NO38。人NPM1基因定位于染色体5q35,全长约23 kb,含12个外显子。NPM1是一种核仁磷酸化蛋白质,主要分布在核仁区域[3],参与核糖体的生物合成,控制中心体复制,具有分子伴侣作用[4-5]。NPM1基因作为调控中心体复制起始的关键基因,在调节细胞生长、分化和转移等方面具有重要作用[6-7]。研究发现,在卵巢癌、前列腺癌、结肠癌、膀胱癌等不同肿瘤中,NPM1都呈过表达水平[8],其还与细胞分裂次数和增殖值率密切相关。这些都表明,NPM的过表达引发肿瘤的发生[9],特别是与造血干细胞疾病如白血病和淋巴瘤密切相关[10]。因此,有效地抑制肿瘤细胞中NPM1的表达,有希望成为靶向治疗肿瘤的新途径。
1 材料和方法
1.1 材料
293T细胞,HT1080细胞,大肠杆菌DH5α,质粒pll3.7(图1),包装载体RRE、REV、VSVG均由本实验室保存;质粒提取试剂盒购自Exygen公司;胶回收试剂盒购自北京天根生物公司;限制性内切酶HpaⅠ、XhoⅠ、EcoRⅠ,T4DNA连接酶购自NEB公司;RT-PCR相关试剂、LipofectAMINE 2000购自Invit⁃rogen公司;NPM1抗体购自Epitomics公司;辣根过氧化物酶标记的抗兔二抗购自Sigma公司;Western印迹显色试剂盒购自北京康为世纪生物科技有限公司;核酸电泳系统、蛋白质电泳系统、半干转膜仪均购自Bio-Rad公司;其他试剂均为国产分析纯产品。
1.2 靶向NPM1的shRNA设计
根据shRNA设计原则,参考GenBank公布的人NPM1(NM_002520),用Invitrogen公司在线设计软件设计shRNA序列(shRNA对照、shRNA1、shRNA2、shRNA3),进行Blast同源性分析,保证序列的惟一性。为方便克隆,在其5′和3′端分别引入HpaⅠ和XhoⅠ酶切位点(为方便鉴定,设计时将酶切位点消掉),反义片段后接终止信号TTTTTT以终止转录。序列由英骏公司合成,见表1。
1.3 NPM1干扰载体的构建
将合成的寡核苷酸链退火形成双链DNA(95℃5 min,72℃ 10 min,自然降至室温),同时将shRNA载体pll3.7用HpaⅠ/XhoⅠ双酶切,酶切产物纯化后,把退火形成的DNA双链与酶切回收的线性化载体片段于16℃连接过夜,并转化大肠杆菌DH5α感受态细胞,之后将其涂布在氨苄西林抗性的LB平板上,37℃培养过夜,每个平板挑4个菌落,扩增,提质粒,用EcoRⅠ/HpaⅠ酶切鉴定,将已插入shRNA片段的载体送北京博迈德公司测序。
1.4 293T细胞的培养及质粒转染
将293T细胞置于含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养液中,于37℃、5%CO2培养箱内培养,每隔2~3 d将细胞传代培养;将细胞铺6孔板,当细胞融合度为70%~80%时瞬转质粒,转染程序按照LipofectAMINE 2000说明书进行,培养48~72 h后收集细胞。
1.5 Western印迹检测shRNA的抑制效果

图1 pll3.7 RNA干扰载体质粒图谱

表1 针对人NPM1基因设计的4对shRNA序列
收集细胞,用RAPI裂解液裂解细胞,提取蛋白质,进行SDS-PAGE,将蛋白条带转移到硝酸纤维素膜上,用含5%脱脂奶粉的TBST溶液封闭1 h,用抗NPM1的一抗孵育2 h,用TBST清洗3次,每次5 min,用辣根过氧化物酶标记的抗兔二抗孵育1 h,用TBST清洗3次,每次5 min,按照Western印迹显色试剂盒说明书显色1~2 min,暗室压片显影。
1.6 慢病毒的包装与感染
10 cm皿的细胞,当细胞密度达70%~80%时,将慢病毒包装载体RRE、REV、VSVG与干扰质粒依次按4.2、2.1、3.1、4 μg混合,加入氯化钠注射用水750 μL,混匀;40 μL转染试剂同样加入氯化钠注射用水750 μL,混匀;将前两者混匀,静置15 min,加入细胞中,72 h后收上清,用孔径0.45 μm的滤膜过滤,所获即为包装好的病毒,将其感染HT1080细胞,其余的病毒用小管分装,-80℃冻存,反复感染细胞,直到感染效率达90%以上。
1.7 在HT1080细胞中验证shRNA的干扰效果
收集感染病毒后的HT1080细胞,取1/3,提取细胞总RNA,按照Invitrogen公司的TRIzol试剂提取总RNA 说明书提取 RNA,并将其稀释到 500 μg/μL。按照Invitrogen公司M-MLV逆转录酶使用说明书合成cDNA,取上述产物2 μL,按一般方法进行PCR扩增,以β-actin为内参基因。β-actin上游引物为5'-CTCCATCCTGGCCTCGCTGT-3',下游引物为5'-G CTGTCACCTTCACCGTTCC-3';NPM1 上游引物 为5'-CGGGATCCGAAGATTCGATGGACATGGAC-3',下游引物为5'-ATATGCGGCCGCTAAAGAGACTTC CTCCACTGC-3'。
利用余下的感染后的HT1080细胞,提取其总蛋白,Western印迹鉴定抑制效果。
2 结果
2.1 NPM1 shRNA序列设计
根据人NPM1序列设计了4对shRNA序列(表1),经Blast分析人基因数据库序列,shRNA对照、shRNA2、shRNA3未发现同源序列,说明序列特异性好;shRNA1与CLEC2D蛋白的基因具有同源序列,但因NPM1基因序列与CLEC2D基因序列相似度达93%,姑且使用shRNA1序列。
2.2 NPM1 shRNA干扰载体的鉴定
经EcoRⅠ/HpaⅠ酶切,pll3.7空载体可切下1500 bp的片段,而pll-shRNA control、pll-shRNA1、pll-shRNA2、pll-shRNA3质粒不能切得1500 bp的片段(图2),表明后4个载体中已插入外源片段。测序结果表明,插入的外源片段序列正确(序列略)。
2.3 pll-shRNA对NPM1蛋白表达的沉默效果
Western印迹结果经PS5软件分析,设计的3条shRNA对NPM都有不同程度的抑制效果,抑制效果分别为20%、78%、36%,即pll-shRNA2的抑制效果最好,抑制率达78%,提示pll-shRNA2具有较好的沉默NPM1基因的效果(图3)。
2.4 利用HT1080细胞验证pll-shRNA2的抑制效果
经过多次感染病毒,pll-shRNA2慢病毒感染效率达90%以上(图4)。RT-PCR和Western印迹结果表明,感染pll-shRNA2病毒的HT1080细胞中几乎没有NPM1的mRNA和NPM蛋白的存在(图5),在mRNA和蛋白质水平上都表明构建的载体具有很好的抑制效果。

图2 质粒EcoRⅠ/HpaⅠ双酶切鉴定的琼脂糖电泳
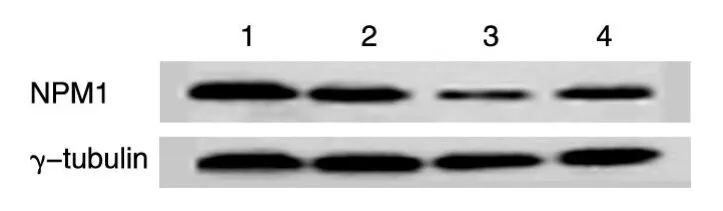
图3 pll-shRNA转染293T细胞后NPM1蛋白的表达
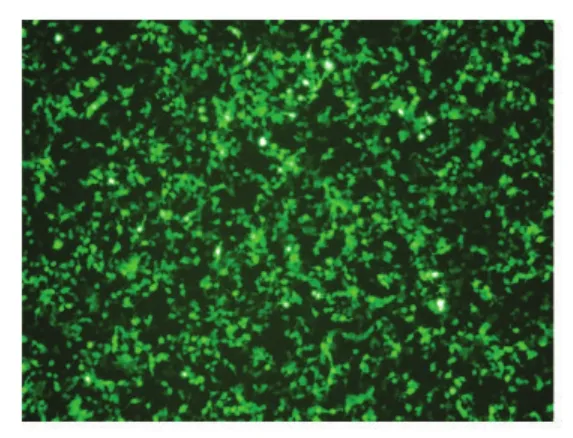
图4 pll-shRNA2病毒对HT1080细胞的感染效率

图5 pll-shRNA2病毒对HT1080细胞中NPM1的抑制效果
3 讨论
临床常用的传统的肿瘤治疗方案放疗和化疗对人体有很大的毒副作用,而RNA干扰可以抑制特定肿瘤的特异分子,实现特定组织或器官的靶向治疗,降低对正常组织器官的伤害,已在临床上得到了应用。如通过抑制前列腺癌细胞表面肿瘤标志分子PMSA的表达,实现了对前列腺癌的治疗[11];用特定的shRNA敲除患胰腺癌小鼠体内糖原合酶3(GST-3b)基因,抑制了肿瘤生长和血管形成[12]。
研究表明,NPM1促进细胞的转移、在肿瘤细胞,特别是造血干细胞系统肿瘤,如白血病、淋巴瘤等中过表达[10]。因此,有效抑制NPM1的表达,有希望成为治疗造血干细胞系统肿瘤的一个新方法。
我们根据shRNA的设计原则设计了shRNA及空对照,转染293T细胞后,得到抑制效果最好的pllshRNA2载体,测序正确后其病毒多次感染HT1080细胞,分别在mRNA水平和蛋白水平得到了验证,抑制效率几乎达100%,达到了实验的目的。该NPM1载体的构建,为NPM1在肿瘤发生发展中的作用研究提供了有力工具,为抗肿瘤的治疗提供了依据。
利用RNA干扰技术治疗疾病在一定程度上得到了肯定,但其临床应用还存在很大的挑战:如运载RNA的载体作为一个外源物体,可能对细胞的正常生长造成一些干扰反应[13];RNA干扰还可能造成一些非目标基因的抑制[14];合适的shRNA载体的选择和启动子的选择,对干扰效果也是至关重要的。相信随着众多学者的努力,RNA干扰技术最终会在治疗疾病方面发挥重要作用。
[1]Brummelkamp T R,Bernards R,Agami R.A system for sta⁃ble expression of short interfering RNA in mammalian cells[J].Science,2002,296(5567):550-553.
[2]Paddison P J,Caudy A A,Bernstein E,et al.Short hairpin RNAs(shRNAs)induce sequence-specific silencing in mamma⁃lian cells[J].Genes Dev,2002,16:948-958.
[3]Kang Y J,Olson M O,Jones C,et al.Nucleolar phosphopro⁃teins of normal rat liver and Novikoff hepatoma ascites cells[J].Cancer Res,1975,35:1470-1475.
[4]Falini B,Mecucci C,Tiacci E,et al.Cytoplasmic nucleophos⁃min in acute myelogenous leukemia with a normal karyotype[J].N Eng1 J Med,2005,352(3):254-266.
[5]Mitsuru O.The structure and functions of NPM1/nucleophsmin/B23,a multifunctional nucleolar acidic protein[J].J Biochem,2008,143(4):441-448.
[6]Chan W Y,Liu Q R,Borjigin J,et al.Characterization of the cDNA encoding human nucleophosmin and studies of its role in normal and abnormal growth[J].Biochemistry,1989,28(3):1033-1039.
[7]Grisendi S,Mecucci C,Falini B,et al.Nucleophosmin and cancer[J].Nat Rev Cancer,2006,6:493-505.
[8]Yung B Y.Oncogenic role of nucleophosmin/B23[J].Chang Gung Med J,2007,30:285-293.
[9]Colombo E,Alcalay M,Pelicci P G.Nucleophosmin and its complex network:a possible therapeutic targetin hematological diseases[J].,Oncogene,2011,30:2595-2609.
[10]Falini B,Mecucci C,Tiacci E,et al.Cytoplasmic nucleophos⁃min in acute myelogenous leukemia with a normal karyotype[J].N Engl J Med,2005,352:254-266.
[11]McNamara J O,Andrechek E R,Wang Y,et al.Cell typespecific delivery of siRNAs with aptamer-siRNA chimeras[J].Nat Biotechnol,2006,24:1005-1015.
[12]Zhou W,Wang L,Gou S,et al.shRNA silencing glycogen synthase kinase-3 beta inhibits tumor growth and angiogene⁃sis in pancreatic cancer[J].Cancer Lett,2012,316:178-186.
[13]Bridge A J,Pebernard S,Ducraux A,et al.Induction of an interferon response by RNAi vectors in mammalian cells[J].Nat Genet,2003,34(3):263-264.
[14]Jackson A L,Bartz S R,Schelter J,et al.Expression profil⁃ing reveals off-target gene regulation by RNAi[J].Nat Biotech⁃nol,2003,21(6):635-638.

