人Six1基因真核表达载体的构建及其生物学功能研究
李淑月,徐小洁,韩聚强,王涛,符静,李玲,冀全博,王宣,杨国锋,叶棋浓
1.军事医学科学院 生物工程研究所,北京 100850;2.河北医科大学,河北 石家庄 050017;3.北京军区总医院,北京 100700
Six1(sineoculis homeobox homolog 1)是一种与乳腺癌有关的同源结构域转录因子[1],其编码基因位于人染色体14q23上。Six1是由一个高度保守的同源异型结构域(homeodomain,HD,61个氨基酸残基)和Six结构域(Six domain,SD,110~115个氨基酸残基)组成的复合结构,该结构与DNA结合的特异性决定了其靶基因的特异性,为脑、耳、眼、肌肉和肾等多种器官发育所必需[2-4]。当Six1调控异常时,不但使胚胎发育和组织器官出现异常形态结构、胚胎死亡,而且在肿瘤发生和转移中发挥关键作用[5]。同时,Six1在44%的早期和90%的转移性乳腺癌中过表达[7]。研究表明,Six1可以通过升高血管内皮生长因子C(vascular endothelial growth factor C,VEGFC)的水平来促进肿瘤淋巴管的形成及淋巴转移[1]。我们拟构建Six1的真核表达载体,并验证其升高VEGF-C水平的功能,为进一步探讨Six1与肿瘤的关系奠定基础。
1 材料和方法
1.1 材料
人胚肾293T细胞、乳腺癌ZR75-1细胞由本室传代培养;pXJ-40-myc载体为本实验室保存;Vigo⁃Fect为威格拉斯生物技术有限公司产品;限制性内切酶、DNA连接酶、PCR试剂均购自TaKaRa公司;质粒提取、胶回收、PCR回收试剂盒购自Promega公司;DMEM及小牛血清均购自Gibco公司;引物合成由北京赛百盛生物技术公司完成;测序由北京奥科生物技术有限责任公司完成。
1.2 myc-Six1重组质粒的构建与测序
以本实验室保存的乳腺文库为模板,根据Six1的编码序列合成上游引物5'-CGGGATCCATGTCG ATGCTGCCGTCGTTTGGC-3'和下游引物5'-CCC AAGCTTTTAAGCCCGGGAGAGAATAGTTTG-3',采用PCR扩增人Six1的编码序列(扩增程序:95℃预变性5 min,以95℃变性30 s、60℃退火30 s、72℃延伸1 min进行31个循环,72℃延长7 min),用胶回收试剂盒回收PCR产物。
用BamHⅠ和HindⅢ双酶切pXJ-40-myc载体,经10 g/L琼脂糖凝胶电泳后,胶回收载体大片段;将PCR片段回收后再用BamHⅠ和HindⅢ酶切,形成带有粘端的双链,用T4DNA连接酶连接入pXJ-40-myc载体,转化大肠杆菌DH5α,挑选克隆,摇菌并提质粒,用BamHⅠ和HindⅢ双酶切鉴定,将鉴定正确的克隆送北京奥科生物公司测序。
1.3 哺乳动物细胞转染和Western印迹检测
用含双抗、100 mL/L胎牛血清的DMEM培养基将293T细胞接种于6 cm皿中,接种量以转染时细胞密度达到80%为宜,培养24 h后进行转染,转染前1 h换液。转染方法参考文献[8]。将4 μL Vigo⁃Fect与200 μL NaCl混合,再将总量为10 μg的重组质粒与200 μL NaCl混合,然后将上述2种溶液轻轻混合,室温放置15 min,加入6 cm皿中,并以同样方法转染空pXJ-40-myc载体作为对照,37℃、50 mL/L CO2常规培养,4~6 h换液。质粒转染293T细胞24 h后收集细胞蛋白,加入2×SDS加样缓冲液,煮沸10 min,高速离心2 min,取上清液进行SDSPAGE后电转移至硝酸纤维素膜上;用5%脱脂奶粉于4℃封闭过夜,加入用5%脱脂奶粉以1∶5000稀释的用HRP标记的抗myc标签鼠单克隆抗体,室温轻摇1 h,TBST洗膜3次,每次5 min;用化学发光法显色5 min,压片显影。转染重组质粒和空载体后,用上述方法行Western印迹至5%脱脂奶粉,于4℃封闭过夜后,加入用5%脱脂奶粉以1∶5000稀释的用HRP标记的抗myc标签鼠单克隆抗体,室温轻摇1 h,TBST洗膜3次,每次5 min;用化学发光法显色5 min,压片显影。
1.4 总RNA的提取
用上述转染方法将重组质粒和空载体转染ZR75-1细胞,24 h后弃培养基,用1×PBS洗涤,用1 mL TRIzol溶液吹下细胞,加0.2 mL氯仿提取蛋白混匀,室温放置10 min,4℃、12 000 r/min离心10 min,小心取上清液0.4 mL,加等量异丙醇混匀,-20℃冷冻10 min,4℃、12 000 r/min离心10 min,弃上清,用1 mL 75%乙醇(DEPC水稀释)洗1次,4℃、12 000 r/min离心5 min后弃上清,用无水乙醇洗1次,4℃、12 000 r/min离心5 min后弃上清,自然干燥约30 min,加入20 μL DEPC水溶解沉淀,即为提取的总RNA。
1.5 qRT-PCR检测
按文献方法进行如下实验[9]。取2 μg总RNA,与1 μL 50 μmol/L的随机引物混匀,补水至15.9 μL,70℃解链5 min,自然冷却至室温,加入反转录酶、dNTP、RNA酶抑制剂及反转录缓冲液,剩余补水至终体积25 μL,42℃反应1 h,95℃灭活5 min,得到反转录的cDNA第一链,将其按1∶20稀释,取9.2 μL模板与10 μL SYBR Green Mix(2×)、上下游引物各0.4 μL混匀,进行qRT-PCR,所得数据按2-ΔΔCt公式计算出基因表达的相对量。
2 结果
2.1 myc-Six1重组质粒的构建与鉴定
以实验室保存的乳癌文库为模板,PCR扩增人Six1的编码序列,获得约870 bp的DNA片段,与预期片段大小一致(图1)。将PCR产物用BamHⅠ和HindⅢ双酶切后,与经同样酶切的pXJ-40-myc载体连接,转化大肠杆菌DH5α,挑选克隆,进行菌液PCR鉴定,若获得与目的条带750 bp大小接近(图2)的克隆,则初步认为是带有人Six1基因的阳性重组克隆。将所得阳性克隆提质粒,经酶切鉴定,可切出2条长度分别约为5 000和750 bp的条带,而相应的空载体酶切只见大片段,符合预期结果(图3)。DNA序列测序结果表明,插入片段的DNA序列与人Six1基因的编码序列完全一致(数据略)。
2.2 Western印迹检测myc-Six1在293T细胞中的表达
将构建的myc-Six1重组质粒和空载体分别转染293T细胞系,24 h后提取蛋白进行SDS-PAGE,Western印迹检测myc-Six1蛋白的表达。结果显示,转染重组质粒后,用myc-HRP抗体能在相对分子质量约31×103处检测到明显的特异性条带,空载体无条带(图4),说明myc-Six1重组蛋白在293T细胞中能够正确表达。
2.3 myc-Six1在mRNA水平升高VEGF-C
根据文献报道,Six1可通过升高VEGF-C水平来促进乳腺癌淋巴管的形成及淋巴转移[1]。为证明构建的myc-Six1可以上调VEGF-C的表达,我们将myc-Six1和空载体分别转染乳腺癌ZR75-1细胞,收集细胞提取总RNA,行qRT-PCR,引物采用文献报道的序列[6]。结果显示,转染myc-Six1后,ZR75-1细胞中VEGF-C的mRNA水平较转染空载体后明显升高(图5)。
3 讨论
乳腺癌是严重威胁女性健康的主要恶性肿瘤,占女性恶性肿瘤死亡率的首位。乳腺癌常早期发生淋巴结转移,淋巴结转移的有无及淋巴结受累的程度,是决定乳腺癌分期和临床治疗方案选择的关键,也是临床评估乳腺癌患者病情及预后的重要指标。因此,研究乳腺癌淋巴结转移机制具有重要意义。研究表明,VEGF-C与乳腺癌淋巴管生成和淋巴结转移密切相关。
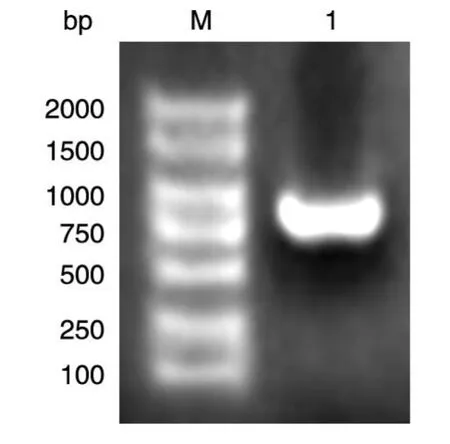
图1 PCR扩增人Six1的编码序列

图2 重组质粒myc-Six1的菌液PCR结果电泳图谱
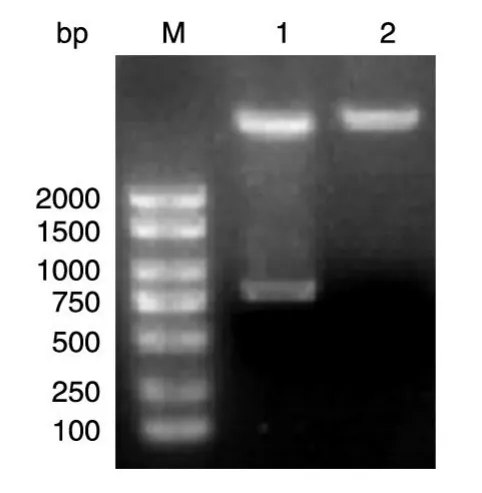
图3 重组质粒myc-Six1的BamHⅠ/HindⅢ双酶切电泳图谱

图4 Western印迹检测myc-Six1的表达
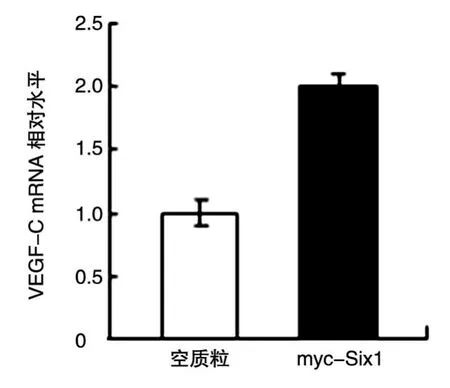
图5 qRT-PCR检测Six1对VEGF-C的影响
VEGF-C是VEGF家族的新成员,其基因定位于染色体4q34,主要由肿瘤细胞产生,是较特异的淋巴管生成因子[10],可以促进淋巴管内皮细胞增生,从而使淋巴管增生或扩张,增大肿瘤淋巴道转移的机会[11],并增强脉管的通透性,改变淋巴管内皮黏附特性或表面趋化因子的表达,从而促进肿瘤转移[12]。VEGF-C还可诱导新生淋巴管与己存在淋巴管愈合,使肿瘤细胞从新生淋巴管进入淋巴结,发生淋巴结转移,并通过淋巴系统向全身其他器官扩散[13]。
Six1属于同源异型结构域Six家族,在许多恶性肿瘤如乳腺癌[14]、横纹肌肉瘤[15]、肾母细胞瘤[5]等中表达增高。Six1对恶性肿瘤的增殖和转移起到了促进作用[16],并且能够引起促淋巴生成因子VEGF-C的转录,这对淋巴管生成及淋巴转移也是必需的[1]。
本实验构建的myc-Six1在真核细胞中获得了表达,同时通过qRT-PCR证明了Six1能够在mRNA水平升高VEGF-C。这为进一步研究Six1基因的功能,以及Six1与VEGF-C及乳腺癌转移的关系奠定了基础。
[1]Wang C A,Jedlicka P,Patrick A N,et al.SIX1 induces lym⁃phangiogenesis and metastasis via upregulation of VEGF-C in mouse models of breast cancer[J].Clin Invest,2012,122(5):1895-1906.
[2]Ozaki H,Nakamura K,Funahashi J,et al.Sixl controls pat⁃terning of the mouse otic vesicle[J].Development,2004,131(3):551-562.
[3]Zou D,Silvius D,Fritzsch B,et al.Sixl are essential for ear⁃ly steps of sensory neurogenesis in mammalian cranial plac⁃odes[J].Development,2004,131(22):5561-5572.
[4]Konishi Y,Ikeda K,Iwakura Y,et al.Sixl and Six4 pro⁃mote survival of sensory neurons during early trigeminal gan⁃gliogenesis[J].Brain Res,2006,1116(1):93-102.
[5]LiC M,GuoM,Borczuk A,etal.Geneexpressionin Wilms'tumormimicsthe earliestcommitted stage in the metanephric mesenchymalepithelial transition[J].Am J Pathol,2002,160(6):2181-2190.
[6]Zhu C,Qi X,Chen Y,et al.PI3K/Akt and MAPK/ERK1/2 signaling pathways are involved in IGF-1-induced VEGF-C upregulation in breast cancer[J].J Cancer Res Clin Oncol,2011,137(11):1587-1594.
[7]Ford H L,Kabingu E N,Bump E A,et al.Abrogation of the G2 cell cycle checkpoint associated with overexpression of HSIX1:a possible mechanism ofbreastcarcinogenesis[J].Proc Natl Acad Sci USA,1998,95(21):12608-12613.
[8]Xu X,Fan Z,Kang L,et al.Hepatitis B virus X protein re⁃presses miRNA-148a to enhance tumorigenesis[J].Clin Invest,2013,123(2):630-645.
[9]Han J,Xu X,Qin H,et al.The molecular mechanism and potential role of heat shock-induced p53 protein accumulation[J].Mol Cell Biochem,2013,378(1-2):161-169.
[10]蔡绍朋,岳喜成,李德群,等.TIP30与VEGF-C在乳腺癌中的表达及意义[J].肿瘤学杂志,2012,18(6):408-412.
[11]van der Auwera I,van Laere S J,van den Eynden G G,et al.Increased angiogenesis and lymphangiogenesis in inflamma⁃tory versus noninflammatory breast cancer by real-time re⁃verse transcriptase-PCR gene expression quantification[J].Clin Cancer Res,2004,10(23):7965-7971.
[12]Nathanson S D.Insights into the mechanisms of lymph node metastasis[J].Cancer,2003,98(2):413-423.
[13]王虎霞,盛薇,王光辉,等.乳腺癌VEGF-C mRNA的表达与淋巴结转移的关系[J].西安交通大学学报,2009,30(4):470-473.
[14]Reichenberger K J,Coletta R D,Schulte A P,et al.Gene amplification is a mechanism of Six1 overexpression in breast cancer[J].Cancer Res,2005,65(7):2668-2675.
[15]Yu Y L,Khan J,Khanna C,et al.Expression profiling identi⁃fies the cytoskeletal organizer ezrin and the developmental ho⁃meoprotein Six1 as key metastatic regulators[J].NatMed,2004,10(2):175-181.
[16]谢柏臻,陈安民,郭风劲,等.RNAi下调Six1基因对人骨肉瘤细胞增殖和转移能力的影响[J].中国癌症杂志,2008,18(8):561-565.

