杜氏盐藻过氧化物酶1酵母双杂交诱饵质粒的构建*
王 静,龚方华,张彦婷,王瑞莉,薛乐勋 ,关方霞#
1)郑州大学生命科学学院 郑州 450001 2)郑州大学第一附属医院细胞生物学研究室 郑州 450052
过氧化物酶广泛存在于真核生物中,作为一种抗氧化剂,可以催化H2O2以及脂质氢过氧化物还原,避免细胞受损[1]。过氧化物酶1(peroxiredoxin 1,Prdx1)是过氧化物酶家族中分布最为广泛的成员之一,广泛分布于胞质、胞核中,参与细胞内多种生理过程,例如Prdx1对H2O2介导的信号转导具有调节作用[2]。Prdx1 还存在于鞭毛中[3],但是其在鞭毛中的功能未知。杜氏盐藻是一种单细胞真核藻类,可以在极端高盐的环境下生长,具有等长双鞭毛,因而非常适合作为研究鞭毛内信号通路的模式生物[4]。该实验首先构建杜氏盐藻过氧化物酶1(Dunaliella salina Prdx1,DsPrdx1)酵母双杂交诱饵质粒pGBKT7-Prdx1,并分别转化酵母菌株Y187和AH109,检测其对酵母菌株有无毒性和自激活作用,为筛选DsPrdx1相互作用蛋白、研究其在鞭毛中的功能打下基础。
1 材料与方法
1.1 材料 杜氏盐藻藻株为UTEX-LB-1644,购自美国得克萨斯州大学,大肠杆菌DH5α和杜氏盐藻cDNA酵母文库由作者所在的实验室保存,酵母菌株Y187和 AH109、载体 pGBKT7购自 Clontech公司,载体pGEM-T购自Promega公司。酵母培养基购自上海 Genomics公司,X-α-gal购自Sigma公司,EcoRⅠ、BamHⅠ、T4 DNA连接酶均购自大连TaKa-Ra公司,质粒提取试剂盒、凝胶回收试剂盒购自AXYGEN公司,PCR特异性引物由Sangon公司合成,紫外分光光度计购自Thermo公司,PCR仪购自Biometra公司,电泳仪购自北京六一实验仪器厂,凝胶成像仪购自Synoptics公司。
1.2 DsPrdx1开放阅读框(ORF)的扩增 设计上、下游分别含有EcoRⅠ与BamHⅠ位点的特异性引物[Prdx-ORF上游引物:5'-CCGGAATTCATGCCTG TACCCACGATT-3'(EcoRⅠ),Prdx-ORF 下游引物:5'-CGCGGATCCTTATGACAGGGTGTTGAAGT-3'(BamHⅠ)],以杜氏盐藻cDNA为模板,PCR扩增DsPrdx1(GenBank序列号 KC999111)的 ORF。100 μL PCR反应体系中含 LA Taq酶0.5 μL,上、下游引物(100 μmol/L)各 1 μL,dNTPs(10 nmol/L)8 μL,10 × LA Buffer 10 μL,模板 cDNA 1 μL,加 ddH2O 至100 μL。反应程序:94℃预变性3 min;94℃变性30 s,60℃退火30 s,72℃延伸70 s,30个循环;72℃延伸10 min,4℃终止反应。PCR反应结束后,10 g/L的琼脂糖凝胶电泳检测扩增产物。
1.3 PCR产物克隆和鉴定 PCR产物胶回收后与克隆载体pGEM-T相连,转化到大肠杆菌DH5α中,将菌液均匀涂布于LB固体培养基上进行蓝白斑筛选。挑取白色单克隆于LB液体培养基中,37℃振荡培养6 h后提取质粒进行酶切鉴定,酶切鉴定正确后测序以分析序列的正确性。
1.4 诱饵质粒pGBKT7-Prdx1的构建 将鉴定正确的pGEM-T-Prdx1质粒与pGBKT7载体用EcoRⅠ和BamHⅠ分别双酶切,将回收纯化的酶切后片段连接并转化大肠杆菌DH5α,扩大培养并提取质粒pGBKT7-Prdx1,测序。
1.5 诱饵质粒的转化
1.5.1 制备酵母感受态细胞 挑取酵母菌Y187和AH109的单克隆,接种于5 mL YPDA液体培养基中,30℃恒温摇床振荡培养16~20 h(230~250 r/min)至光密度值(OD600nm)为 0.15 ~0.30 后,接种于50 mL YPDA液体培养基中,30℃、250 r/min振荡培养至OD600nm为0.40~0.50(约3 h)。室温下将酵母菌菌液以2700 r/min离心5 min。弃上清,加50 mL去离子水重悬沉淀,再次离心弃上清。用3 mL TE/LiAc溶液重悬,将重悬的酵母细胞分装于1.5 mL 的离心管中,12000 r/min离心30 s,弃上清,加600 μL TE/LiAc重悬细胞,所得细胞悬浮液即为酵母感受态细胞。
1.5.2 诱饵质粒转化酵母菌 在1.5 mL的离心管中加入 50 μL酵母感受态细胞、0.5 μL诱饵质粒、500 μL PEG/LiAc溶液与5 μL 鲱鱼精 DNA,涡旋混匀。将离心管置于30℃水浴锅中孵育30 min。向离心管中加入 20 μL DMSO,混匀,42℃孵育 20 min,每5 min混匀1次。将混合液2700 r/min离心5 min,弃上清,用1 mL YPDA液体培养基重悬沉淀,30℃孵育90 s,离心弃上清,用9 g/L的NaCl溶液轻轻重悬沉淀。将菌液均匀涂布于SD/-Trp固体培养基上,30℃倒置培养3~5 d,直至长出单菌落。
1.6 自激活检测 将转有诱饵质粒和空载体质粒的Y187和AH109酵母菌分别划线于SD/-Trp、SD/-Trp/X-α-gal、SD/-Trp/-His/X-α-gal 以及 SD/-Trp/-Ade/X-α-gal固体培养基上。如果酵母菌株在SD/-Trp/-His/X-α-gal培养基上生长,则在酵母双杂交筛选过程中需要加入组氨酸抑制剂3-AT以抑制组氨酸泄露。如果菌株在SD/-Trp/-Ade/X-α-gal培养基上生长,则诱饵蛋白对报告基因有自激活作用,不适合用酵母双杂交的方法筛选相互作用蛋白。
1.7 毒性检验 将含有诱饵质粒的 Y187和AH109酵母菌菌株分别划线于SD/-Trp固体培养基上,30℃倒置培养,挑取大小相近的克隆分别接种于SD/-Trp液体培养基中,30℃,250 r/min振荡培养20 h,测 OD600nm。若含有诱饵质粒的菌株OD600nm低于0.80,则说明诱饵蛋白的存在阻碍了酵母菌株的生长,该蛋白不适合用酵母双杂交的方法筛选相互作用蛋白。
2 结果
2.1 DsPrdx1基因的克隆及鉴定 PCR扩增所得片段长度约为600 bp(图1)。提取质粒pGEM-TPrdx1经双酶切后电泳显示为两条带,一条约为3000 bp,为线性pGEM-T载体;另一条约为600 bp,为插入片段DsPrdx1(图2),测序后发现DsPrdx1无碱基突变和移码突变,可用于构建酵母双杂交诱饵质粒。
2.2 诱饵质粒的构建及双酶切鉴定 将pGBKT7-Prdx1转化到大肠杆菌DH5α中并提取质粒进行双酶切鉴定,电泳后显示为两条带,一条约为7300 bp,为线性pGBKT7载体;另一条约为600 bp,为插入的DsPrdx1 cDNA片段(图3),对诱饵质粒进行测序表明DsPrdx1没有发生突变,诱饵质粒构建成功。
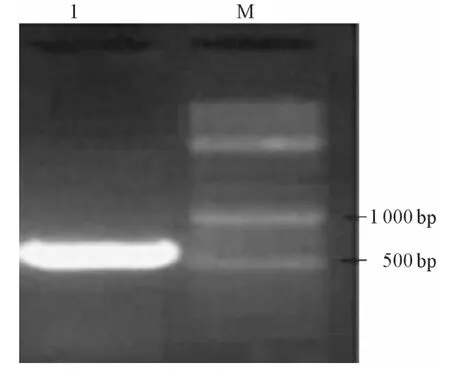
图1 DsPrdx1 PCR扩增产物
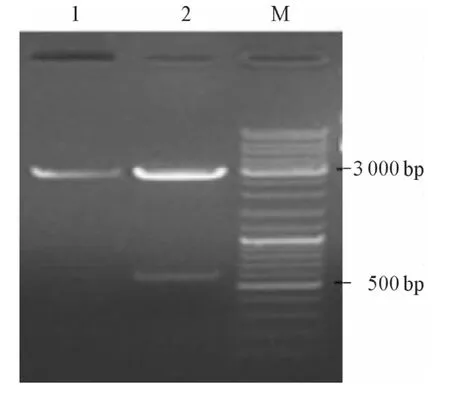
图2 pGEMT-T-Prdx1双酶切结果
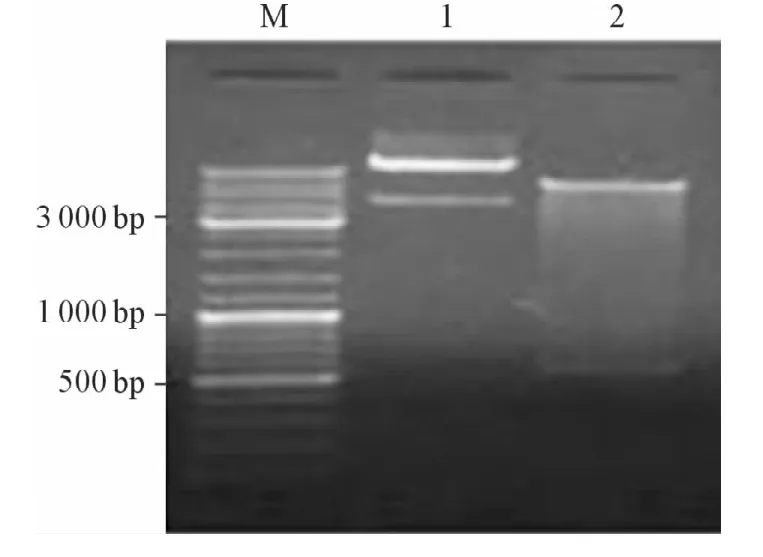
图3 诱饵质粒双酶切结果
2.3 诱饵质粒pGBKT7-Prdx1的转化 转化pGBKT7-Prdx1的酵母细胞 Y187和 AH109的菌落PCR鉴定结果见图4。
2.4 诱饵质粒的自激活作用检测 见表1。
2.5 诱饵蛋白的毒性检测 将转化有诱饵质粒的Y187和AH109酵母菌接种于SD/-Trp液体培养基,30℃恒温摇床振荡培养20 h后测得OD600nm分别为1.199 和1.233,均大于0.80,表明诱饵蛋白对酵母菌Y187和AH109无毒性。

图4 诱饵质粒转化酵母菌菌落PCR鉴定
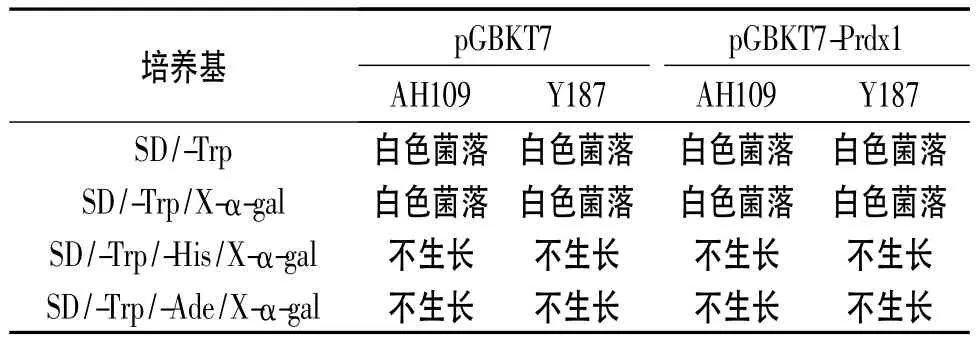
表1 诱饵载体的自激活作用检测
3 讨论
ROS(reactive oxygen species)过量积累会对细胞产生损伤[5]。Prdx1作为生物体内广泛存在的一种抗过氧化物酶,可以有效清除生物体内产生的过量ROS;此外,Prdx1还具有信号传导、分子伴侣等功能,并且参与了多种氧化相关的病理与生理过程[6-7]。有研究[3]表明 Prdx1存在于精细胞的尾部即鞭毛区域,但其在鞭毛中的功能尚不清楚。真核生物的鞭毛是一种细胞表面突起的亚细胞结构,主要由细胞微管组成[8],在细胞信号转导、个体发育等过程中具有重要作用。鞭毛的组装与去组装过程伴随细胞周期的进行呈周期性动态,但是其生长调控机制尚不明确。杜氏盐藻是一种单细胞真核藻类,具有等长双鞭毛,因而非常适合作为研究鞭毛内信号通路的模式生物。因此,用DsPrdx1作为诱饵钓取其相互作用蛋白的方法为进一步研究Prdx1在鞭毛中的功能提供了可能。
酵母双杂交技术是一种直接在真核活细胞内检测蛋白相互作用的方法[9]。酵母双杂交系统不仅可以研究已知蛋白之间的相互作用,还可以发现与已知蛋白相互作用的未知蛋白。该实验构建了融合有DsPrdx1基因片段的诱饵质粒pGBKT7-Prdx1,并将诱饵质粒分别转入酵母菌Y187和AH109中,通过毒性检验证明了诱饵蛋白对酵母菌的生长没有毒害作用。另外,假阳性的存在是酵母双杂交的最大缺点,其主要原因是诱饵蛋白对报告基因的激活作用。该实验观察了诱饵质粒的自激活作用,结果表明诱饵蛋白对酵母菌AH109与Y187均无自激活作用,可以用于酵母双杂交系统。该实验结果为今后筛选DsPrdx1的相互作用蛋白奠定了基础。
[1]Rhee SG,Chae HZ,Kim K.Peroxiredoxins:a historical overview and speculative preview of novel mechanisms and emerging concepts in cell signaling[J].Free Radic Biol Med,2005,38(12):1543
[2]Neumann CA,Cao J,Manevich Y.Peroxiredoxin 1 and its role in cell signaling[J].Cell Cycle,2009,8(24):4072
[3]O'flaherty C,de Souza AR.Hydrogen peroxide modifies human sperm peroxiredoxins in a dose-dependent manner[J].Biol Reprod,2011,84(2):238
[4]Singla V,Reiter JF.The primary cilium as the cell's anten-na:signaling at a sensory organelle[J].Science,2006,313(5787):629
[5]Lee KW,Lee DJ,Lee JY,et al.Peroxiredoxin Ⅱ restrains DNA damage-induced death in cancer cells by positively regulating JNK-dependent DNA repair[J].J Biol Chem,2011,286(10):8394
[6]Neumann CA,Fang Q.Are peroxiredoxins tumor suppressors? [J].Curr Opin Pharmacol,2007,7(4):375
[7]Jarvis RM,Hughes SM,Ledgerwood EC.Peroxiredoxin 1 functions as a signal peroxidase to receive,transduce,and transmit peroxide signals in mammalian cells[J].Free Radic Biol Med,2012,53(7):1522
[8]潘俊敏.衣藻、纤毛与“纤毛相关疾病”[J].中国科学:C辑:生命科学,2008,38(5):399
[9]Fields S,Song O.A novel genetic system to detect proteinprotein interactions[J].Nature,1989,340(6230):245

