重组人血管内皮抑素联合顺铂体外干预人胃癌细胞生长的研究
邓建良,谈华阳,王维民,周 炎,许春妮,张国强
(江苏大学附属宜兴市人民医院医院肿瘤科,江苏宜兴,214200)
胃癌是人类最常见的恶性肿瘤之一,在中国,胃癌的发生率和病死率均居恶性肿瘤前列。目前,临床上手术切除是治疗早期胃癌的最有效手段,但研究[1]发现,术后肿瘤复发率高达50%~70%,且患者生存获益也低于预期,5年生存率仅为20%~50%,进展期胃癌患者预后不佳,平均生存期6~8个月,通过化疗平均可以延长3~6个月。目前,铂类药是治疗胃癌的常用药物。顺铂作为第3代铂类化合物,已被证实在对抗多种恶性肿瘤化疗中具有良好的疗效,含顺铂的方案治疗胃癌总体有效率为38%~54%[2]。重组人血管内皮抑素注射液(恩度)是中国学者自主研发的一类生物新药,也是全球首个成功用于临床的血管内皮抑素类药物。其能与血管内皮细胞上的多个位点进行特异性的结合,阻断其分子信号通路,通过抑制内皮细胞增殖和诱导期凋亡来抑制新生血管生成,从而抑制肿瘤组织生长。本研究拟通过恩度联合顺铂作用于人胃癌细胞株SGC7901和BGC823,以初步探讨其对人胃癌细胞增殖与凋亡的机制,现报告如下。
1 材料与方法
1.1 试剂与仪器
试剂:顺铂(德州德药制药有限公司产品,批号:120306);重组人血管内皮抑制素注射液(山东先声麦得津生物制药有限公司,国药准字:S20050088);鼠抗人Bcl-2、Ki-67单克隆抗体(美国Santa Cruz公司);RPMI细胞培养基1640、胰蛋白酶和胎牛血清(美国Gibco lifetechologies公司);二甲基亚砜 DMSO和四甲基偶氮唑盐(MTT,美国Sigma公司);Annexin V-FITC细胞凋亡检测试剂盒(美国biovision公司);丙烯酰胺和N,N,-甲叉双丙烯酰胺(上海生工生物工程公司);人胃癌细胞株SGC7901和BGC823(中国科学院上海生命科学研究院)。仪器:550型酶标仪(美国Bio-Rad公司);DY 602V稳流稳压电泳仪(江苏南达生物技术开发公司);TS-1型脱色摇床(江苏海门市麒麟医用仪器厂);CO2培养箱(德国Heraeus公司);FACS Vantage SE型流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 细胞培养:将人胃癌细胞株BGC823和人胃癌细胞株SGC7901培养在RPMI1640细胞培养基中,置于37℃、5%CO2培养箱内恒温培养,每3 d或细胞铺满瓶底后,用0.25%胰蛋白酶消化。
1.2.2 细胞增殖抑制率测定:MTT法测定单药组(仅适用顺铂)和联合组(恩度联合顺铂)对人胃癌细胞BGC823和人胃癌细胞SGC7901增殖的影响,具体步骤如下:取处于对数生长期的人胃癌细胞,用0.25%胰蛋白酶消化,用培养基将细胞吹打为单细胞悬液,调整悬液浓度为5×104个细胞/mL,并将其加至96孔板中。实验设阴性对照组(设3孔平行),阳性对照组(设3孔平行)和实验组,其中实验组又分为单药组和联合组,且每种药物浓度梯度均设3孔平行,将96孔板置于37℃、5%CO2培养箱中恒温培养24 h。单药组分别将 1 mg/L、10 mg/L、100 mg/L的顺铂加入到96孔板内;联合组在单药组基础上再加入100 mg/L的恩度注射液。37℃恒温培养24 h后,每孔加入5 mg/mL的MTT后,再置于5%CO2培养箱中37℃恒温培养4 h,2 000 r/min离心5 min,弃去上清,每孔再加入 200 μ L的 DMSO,轻轻混匀 10 min,在570 nm下检测光密度值(OD)值。通过OD值分别计算单药组和联合组对人胃癌BGC823细胞和人胃癌SGC7901细胞的增殖抑制率。公式如下:细胞增殖抑制率=(1-实验组 OD值均数/对照组OD值均数)×100%。
1.2.3 流式细胞仪检测细胞凋亡率:实验设细胞对照组、单药组(单用顺铂)和联合组(恩度联合顺铂),单药组选取上述实验中单用顺铂增殖抑制率(fa)为0.5时的药物浓度作为处理浓度,联合组则选取上述实验恩度和顺铂联合应用时增殖抑制率为0.5时的药物浓度作为处理浓度。取处于对数生长期的人胃癌细胞,用0.25%胰蛋白酶消化,用培养基将细胞吹打为单细胞悬液,调整悬液浓度为2×105个细胞/mL,并将其接种于50 mL培养瓶中,置于37℃、5%CO2培养箱中恒温培养24 h,2 000 r/min离心5 min,弃去上清,分别单用顺铂和采用恩度联合顺铂进行处理,37℃恒温培养24 h,0.25%胰蛋白酶消化后收集细胞,检测在上述药物浓度下的细胞凋亡率。
1.2.4 蛋白Bcl-2和Ki-67表达的检测:Western blot检测Bcl-2、Ki-67的蛋白表达。采用 BCA蛋白浓度检测试剂盒测定所收集样品中的蛋白浓度。进行SDS-聚丙烯酰胺凝胶电泳,用5%的β-巯基乙醇处理样品,沸水浴5 min,使待测样品充分变性后,每份样品点样 50 μ g蛋白,100 V恒压电泳100 min。将检测蛋白转膜至聚偏二氟乙烯(PVDF)膜上,将转膜槽置于冰浴中,60 V下电泳2 h。转膜后用5%脱脂牛奶在室温下将膜封闭100 min,用TBS缓冲液洗膜3次,10 min/次。再将膜与一抗置于4℃下孵育过夜。取出并洗膜,用5%脱脂牛奶稀释二抗,将膜与相应的二抗置于室温下,孵育100 min后,取出并洗膜。取等量的ECL发光剂A、B,将其混匀后滴在膜上,弃去残余发光剂,将膜置于X光片夹中下,先将X片进行显影后再进行定影,将胶片进行扫描。
2 结 果
2.1 单药组和联合组对BGC823和SGC7901细胞的抑制作用
单药组和联合组对人胃癌BGC823细胞株和人胃癌SGC7901细胞株的抑制作用在一定范围内均随药物浓度的增加而增强;在3个浓度梯度上,联合组的抑制作用均强于单药组。见表1。
2.2 单药组和联合组半数抑制浓度比较
单药组对BGC823细胞的IC50为20.77mg/L,联合组IC50为9.66 mg/L;单药组对SGC7901细胞的IC50为30.30mg/L,联合组IC50为11.55 mg/L。单药组对 BGC823细胞和SGC7901细胞的IC50均低于联合组。
表1 2组对BGC823细胞和SGC7901细胞的制率比较(n=3, ±s)
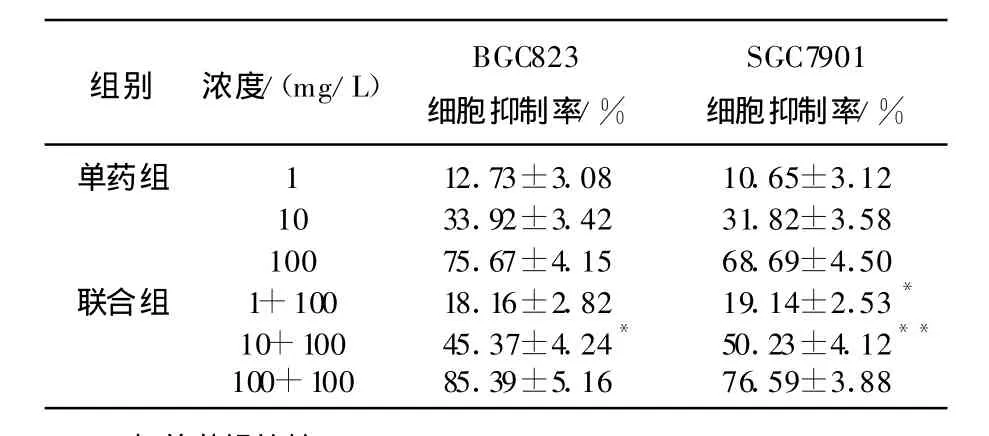
表1 2组对BGC823细胞和SGC7901细胞的制率比较(n=3, ±s)
与单药组比较,*P<0.05,**P<0.01。
组别 浓度/(mg/L)BGC823细胞抑制率/%SGC7901细胞抑制率/%单药组 1 12.73±3.08 10.65±3.12 10 33.92±3.42 31.82±3.58 100 75.67±4.15 68.69±4.50联合组 1+100 18.16±2.82 19.14±2.53*10+100 45.37±4.24* 50.23±4.12**100+100 85.39±5.16 76.59±3.88
2.3 各组对BGC823和SGC7901细胞凋亡的影响
BGC823细胞对照组、单药组及联合组的凋亡率分别为(2.02±0.35)%、(15.57±2.12)%、(19.88±3.32)%;SGC7901细胞对照组、单药组及联合组的凋亡率分别为(1.88±0.29)%、(13.33±3.05)%、(18.26±3.58)%。联合组对诱导BGC823和SGC7901细胞的凋亡率有高于单药组的趋势,且显著高于对照组,差异有统计学意义(P<0.01)。见图1、2。

图1 诱导BGC823细胞的凋亡情况
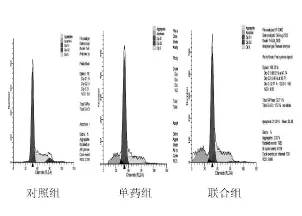
图2 诱导SGC7901细胞的凋亡情况
2.4 蛋白印迹法结果
蛋白印迹结果显示,单药组与联合组分别对BGC823细胞和SGC7901细胞的Bcl-2和 Ki-67蛋白表达有所下调,且联合组下调程度显著大于单药组(P<0.05),见图3、4。
3 讨 论
顺铂瘤谱较广,对胃癌、肠癌、头颈部癌、食管癌等均有效,且患者对不良反应的耐受性明显提高[3-6]。尽管采用含顺铂的化疗方案治疗后疗效有了一定提高,但肿瘤患者的生存获益仍没有明显改善,对于晚期胃癌患者的治疗尤其如此,所以亟须探索新的治疗理念及治疗方法。目前,在临床工作中,抗血管生成治疗已逐渐成为研究的热点,国内外已采用多种作用于不同位点的血管生成抑制剂类新药用于晚期肿瘤的治疗。
随着分子生物学和转化医学研究的不断发展,关于胃癌的发病机制、分子信号通路和治疗靶点的研究也有了进一步发现。目前,临床上已取得一些突破,如运用西妥昔单抗[7]、贝伐单抗[8]和曲妥珠单抗[9]等具有明确靶点的单克隆抗体类生物药联合传统化疗治疗进展期胃癌。恩度是一种多靶点的血管生成抑制剂,研究[10]表明,其能特异性地作用于血管内皮细胞表面的受体,通过抑制内皮细胞的增殖和迁移,诱导内皮细胞的凋亡来发挥抑制新生血管生成的作用。此外,恩度还能通过下调血管内皮生长因子(VEGF)的表达及抑制基质金属蛋白酶的活性来抑制新生血管的生成,并可间接诱导肿瘤休眠或退缩[11]。临床上,恩度联合化疗已用于多种晚期实体肿瘤的治疗,且其与化疗联合治疗胃癌已取得了良好的疗效[12-14]。
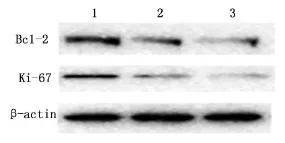
图3 BGC823细胞Bcl-2蛋白的表达

图4 SGC7901细胞Bcl-2蛋白的表达
恩度联合化疗药物用于胃癌治疗的基础研究较少。基于增强化疗疗效与减轻化疗相关的不良反应,作者设计了此项恩度联合顺铂干预胃癌细胞生长的体外实验,并以检测Bcl-2及Ki-67蛋白作为细胞增殖与凋亡的指标。通过检测Ki-67、Bcl-2蛋白表达发现,顺铂联合恩度作用于SGC7901及BGC823细胞时,其下调 Bcl-2、Ki-67表达的作用显著优于单用顺铂。本研究结果提示,恩度可增敏顺铂,抑制胃癌细胞 BGC823及SGC7901细胞的增殖,促进其凋亡,作用机制是增强诱导细胞发生凋亡和抑制细胞增殖,这为恩度治疗胃癌提供可靠的实验依据。
[1]Parkin D M,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74.
[2]Blum M A,Takashi T,Suzuki A,et al.Management of localized gastric cancer[J].J Surg Oncol,2013,107(3):265.
[3]Andry G,Hamoir M,Locati LD,et al.Management of salivary gland tumors[J].Expert Rev Anticancer T her,2012,12(9):1161.
[4]Cervantes A,Roda D,Tarazona N,et al.Current questions for the treatment of advanced gastric cancer[J].Cancer Treat Rev,2013,39(1):60.
[5]Lenz H J.Pharmacogenomics and colorectal cancer[J].Adv Exp Med Biol,2006,587:211.
[6]Herskovic A,Russell W,Liptay M,et al.Esophageal carcinoma advances in treatmentResultsfor locally advanced disease:review[J].Ann Oncol,2012,23(5):1095.
[7]Lordick F,Kang Y K,Chung H C,et al.Capecitabine and cisplatin with or without cetuximab for patients with previously untreated advancedgastric cancer(EXPAND):a randomised,open-label phase 3 trial[J].Lancet Oncol,2013,14(6):490.
[8]Norguet E,Dahan L,Seitz J F.Targetting esophageal and gastric cancers with monoclonal antibodies[J].Curr Top Med Chem,2012,12(15):1678.
[9]Janjigian Y Y,Viola-Villegas N,Holland J P,et al.Monitoring afatinib treatment in HER2-positive gastric cancer with 18F-FDG and 89Zr-trastuzumab PET[J].J Nucl Med,2013,54(6):936.
[10]Field-Ridley A,Heljasvaara R,Pihlajaniemi T,et al.Endostatin,an inhibitor of angiogenesis,decreases after bidirectional superior cavopulmonaryanastamosis[J].Pediatr Cardiol,2013,34(2):291.
[11]Masiak W,Szponar A,Chodorowska G,et al.Evaluation of endostatin and EGF serum levels in patients with gastric cancer[J].Pol Przegl Chir,2011,83(1):42.
[12]Feng P,Zhang Z L,Zhang Z H,et al.Effect of endostar combined with cisplatin on expression of VEGF and Sema3A of Lewis lung cancerrats[J].Asian Pac J Trop Med,2013,6(1):57.
[13]Jin F,Ji H,Jia C,et al.Synergistic antitumor effects of endostar in combination with oxaliplatin via inhibition of HIF and CXCR4 in the colorectal cell line SW1116[J].PloS one,2012,7(10):e47161.
[14]Rong B,Yang S,Li W,et al.Systematic review and metaanalysis of Endostar(rh-endostatin)combined with chemotherapy versus chemotherapy alone for treating advanced non-small cell lung cancer[J].World J Surg Oncol,2012,10:170.

