多发性骨髓瘤患者骨髓间充值干细胞向OB分化中的Runx2表达及体外造血机制
王亚平
(黔东南州人民医院骨二科,贵州 凯里 556000)
多发性骨髓瘤(MM)是以成骨细胞(OB)活性减弱与破骨细胞(OC)增强为主要病变机制的一种疾病。OB的发育障碍可能是导致MM发病的重要原因,骨髓间充质干细胞(MSCs)是骨髓微环境中的重要组成部分,具有调控与支持造血干细胞的增殖与分化〔2〕,Runx2是MSCs向OB分化过程中的关键表达因子〔1〕,但关于Runx2表达对MM患者OB发育的影响与MM患者MSCs变化及变化程度的研究不多,本文就MM向OB分化的临床实验进行观察分析。
1 材料与方法
1.1材料 磷酸盐缓冲液(PBS)粉剂,L-DMEM 培养液(10%新生胎牛血清+100 U/ml 青霉素+100 U/L 链霉素的低糖 DMEM),淋巴细胞分离液,0.25% 胰蛋白酶,L-DMEM 条件培养液(地塞米松10-8mol/L +维生素C 0.05 g/L+β-甘油磷酸钠10-2mol/L),1%琼脂糖凝胶,Trizol液,长期培养基(12.5% FCS+12.5%马血清+2 mmol/L谷氨酰胺+10-6mol/L氢化可的松的培养基)、甲基纤维素,培养体系(30%马血清+1 g/L BSA+2 mmol/L谷氨酰胺,1×10-4/L β2巯基乙醇+1%甲基纤维素+重组细胞因子),以上材料分别由GIBCO、Hyclone、Sigma、Gibco等不同公司提供。7900 DNA荧光定量PCR仪由上海基康公司提供,流式细胞仪由美国Guava 提供。
1.2检测方法
1.2.1MSCs分离与培养 随机选取5例MM患者,入选患者经血液生化检验、影像学、病理学与骨髓细胞学等检查均符合MM的诊断标准〔3〕,男4例,女1例,年龄56~67〔平均(62.58±3.62)〕岁,采集入选患者的骨髓标本作为观察组;随机选取4例缺铁性贫血患者为对照组,其中男2例,女2例,年龄58~67〔平均(63.34±2.97)〕岁。全部患者采集骨髓液5 ml,加肝素防凝固,加PBS粉剂混匀后离心,加等体积的PBS粉剂混匀,将其加入至等体积的淋巴分离液中,2 500 r/min,收集单核细胞层,L-DMEM 培养液洗涤细胞,1 000 r/min离心5 min,调节密度约106/ml放置培养瓶在5%CO2、37℃培养,按时换液,每日在显微镜下观察细胞的生长状况。2 w后,使用0.25%胰蛋白酶消化后按照1/3进行传代。
1.2.2MSCs向OB分化中的增殖与形成能力检测 当MSCs传至第3代时,取0.25% 胰蛋白酶2 ml消化,形成单细胞悬液,用L-DMEM 条件培养液使细胞浓度调节至4.5×104/ml,调整好孔板,上下对照,接种7板,按照流式细胞仪的说明进行检测操作,测出平均光密度值,记录数据用以评价MSCs向OB分化中的增殖能力;传至3代的MSCs重新悬浮液,放置孔板,常规在5%CO2、37℃的环境下进行培养,换液。在14、28 d中取盖玻片进行细胞碱性磷酸酶(ALP)、Von-cosa染色,在显微镜下取10个100倍视野进行图像分析,算出IOD sum / Area sum 值,光镜下计数钙结节数,比较两组钙结节形成的能力。
1.2.3RT-PCR方法 MSCs向OB分化中的Runx2表达,取两组第3代MSCs,放置孔板,换液,待细胞汇合80%,吸净培养液,加入L-DMEM 条件培养液进行诱导,对照组在诱导的12、24、36、72 h收集细胞,观察组在诱导72 h收集细胞106细胞放置于EP管中,逆转录细胞及提取细胞总RNA,用7900 DNA荧光定量PCR仪进行扩增,Runx2引物序列:上游:5′-CTGGAGTGATGTGGTTT3′,下游:5′-CCTGTTGTGTTGTTTGG-3′;扩增成功后取1%琼脂糖凝胶进行40 min的电泳并染色,凝胶成像取片并计算平均光密度值。
1.2.4MSCs造血因子表达 使用Trizol液进行总RNA的提取, 用7900 DNA荧光定量PCR仪对白细胞介素(IL)-3、IL-6、粒细胞集落刺激因子(GM-CSF)、单核细胞集落刺激因子(M-CSF)。干细胞生长因子(SCF)与血小板生长因子(TPO)进行扩增。以还原型辅酶Ⅱ(GAPDH)作为对照组, PCR产物予以电泳并染色,观察结果。
1.2.5MSCs体外造血的能力检测 MSCs经红外线照射后,放置与长期培养基中接种,收集正常体检者的骨髓单核细胞,预先在培养体系中培养4 h用于消除贴壁细胞,在5%CO2、37℃环境下进行培养,每7天进行换液,1个月后将全部细胞在甲基纤维素体系中进行接种并检测其集落形成能力,集落试验在孔板上进行,106细胞/孔,在5%CO2、37℃中培养,2 w后在显微镜下计集落数,50以上细胞作为一个集落。
1.3观察指标 ①用流式细胞仪进行OB增殖能力的测定,以“平均光密度值”表示,测定IOD sum/Area sum 值,光镜下计数钙结节数用以评价OB的形成能力。②Runx2表达强度应用平均光密度值定量表示;应用电泳图分析造血因子的表达情况。③比较在长期培养基中培养1个月后的MM患者与正常体检者的细胞集落形成状况,评价MM患者体外造血能力。
2 结 果
2.1患者MSCs向OB分化中的增殖与形成能力 流式细胞术检测OB增殖能力显示:在L-DMEM 条件培养液的诱导下,两组患者第3~4天的细胞增殖处于对数生长期,第5天细胞增殖能力下降,并处于平台期。第7天,观察组的平均光密度值(1.186±0.641)显著低于对照组(1.531±0.912)(P<0.05);观察组IOD sum/Area sum值(0.198±0.047)与平均钙结节数(11.30±6.31)均显著低于对照组〔(0.347±0.034)、(16.09±5.36)〕(P<0.05)。
2.2MM患者MSCs向OB分化中的Runx2表达 MM患者在MSCs诱导后Runx2表达(0.956±0.076)显著高于MSCs诱导前(0.614±0.068)(P<0.05),观察组患者的平均光密度(0.496±0.158)显著低于对照组(0.821±0.162)(P<0.05)。
2.3患者MSCs造血因子表达 RT-PCR方法显示:可检测IL-6、M-CSF与SCF在MSCs中的表达,未检测到TPO与GM-CSF的表达。见图1。
2.4患者MSCs体外造血的能力 在长期培养基中培养1个月后可检测到细胞集落的形成,MM患者MSCs具有促进红细胞系集落(CFU-E)、粒细胞系集落(CFU-GM)与粒细胞巨噬细胞系集落(CFU-GEMM)增殖的能力,在MM患者培养体系中各种细胞系集落的产率与正常体检者培养体系中各种细胞系集落的产量之间差异无统计学意义(P>0.05)。见表1。
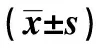
表1 MM患者与正常体检者细胞系集落的产量之间的比较
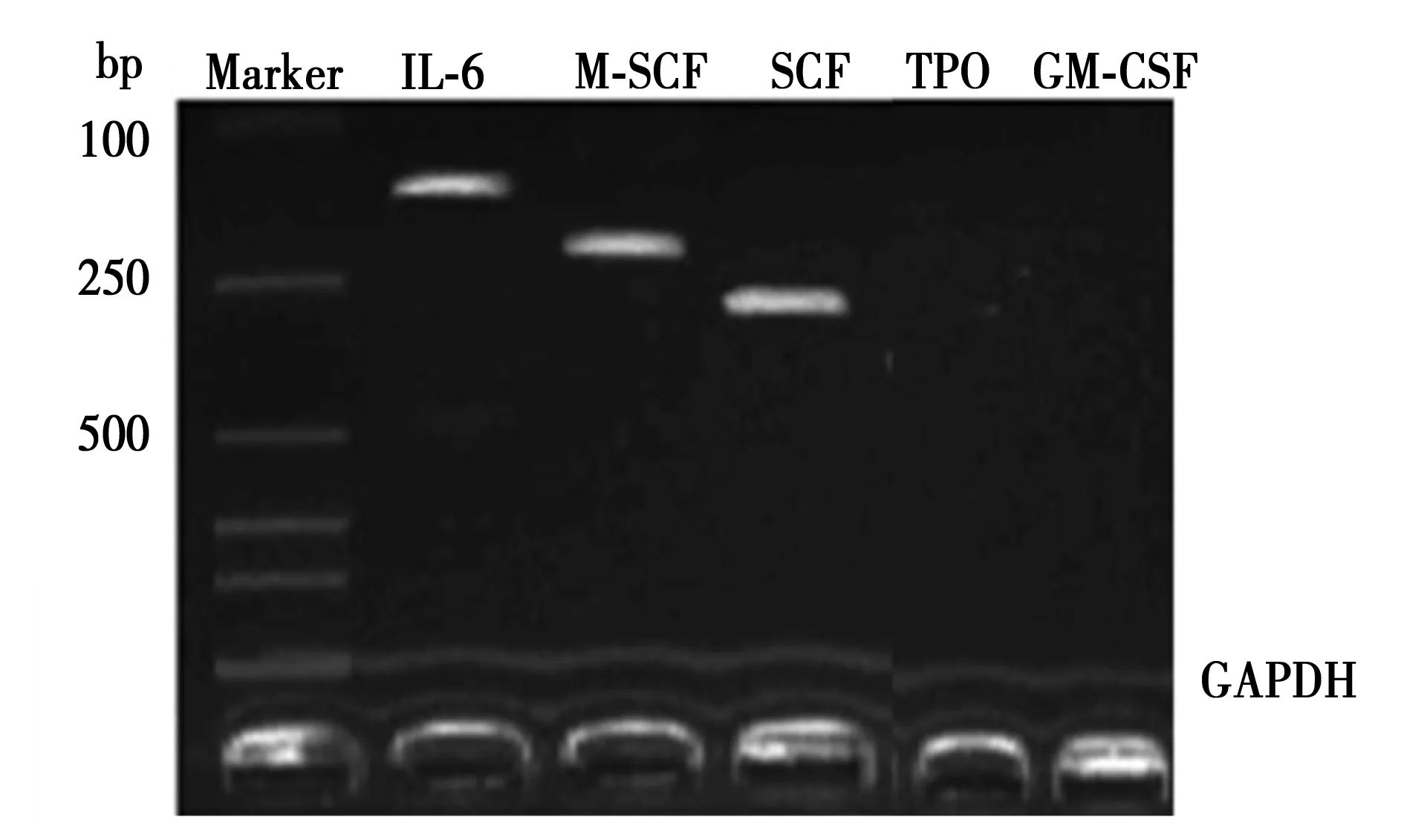
图1 MM患者MSCs造血因子表达
3 讨 论
MM是以骨髓内恶性克隆的细胞增殖与免疫球蛋白的产生为特点,好发于老年的血液恶性疾病〔4〕,主要临床病理表现为:①骨髓微环境产生破骨细胞刺激因子(IL-6、IL-3等)刺激OC增多,促进骨髓瘤细胞的增多、浸润及破坏骨组织,导致MM骨髓微环境下OB的活性减弱与OC活性增强〔5〕;②OB的分化障碍导致了MM的形成,研究〔6〕表明,MM患者的OB增殖与形成能力显著降低,OC活性增强与OB活性减弱联合导致MM的发病。关于OB发育障碍的机制尚不清楚,研究〔7〕认为Runx2表达是OB的特异性转录因子,是OB分化的标志。目前临床常使用的化疗效果不佳,自体造血干细胞移植与大剂量化疗联合的临床疗效更佳〔8〕,其中异基因造血干细胞移植是可治愈MM的唯一方法,但是移植前治疗与化疗均会破坏MSCs,从而影响MM患者移植治疗的疗效与移植后的血液恢复〔9〕。MSCs可支持体内外造血的作用,联合MSCs的造血干细胞移植可显著提高MM的治疗效果。有研究〔10〕也表明:联合MSCs的造血干细胞移植可促进造血干细胞的移植与移植后造血功能的恢复。具有应用价值的自体MSCs在来源、患者经济负担与排斥方面均显著优于异体基因MSCs;而且自体MSCs具有异体基因MSCs所缺乏的修复损伤骨髓基质细胞的功能〔11〕。因此,研究MM患者OB分化程度、Runx2在OB分化中的影响与自体MSCs是否可以应用于临床将为MM骨髓造血干细胞的移植提供重要的理论与实践依据。
本研究结果揭示MM患者OB分化中的增殖与形成能力下降,有研究〔12〕表明,MM骨髓微环境中Runx2的表达显著低于正常人,与本研究结果一致,说明了Runx2的低表达有助于MM骨病的形成, MSCs诱导前Runx2呈弱表达而诱导后Runx2呈高表达的机制可能是MSCs具有潜在分化OB的功能与OB前期Runx2表达强,因此,Runx2主要作用于OB形成早期,而Runx2的表达减弱可能导致MM患者MSCs向OB分化中的增殖与形成能力的减弱。MM患者自体的MSCs可检测到造血因子的表达,IL-6在MM患者与正常MSCs中无差别,推测IL-6可能与MSCs支持体内外造血的作用有关,与靖彧等〔13〕的研究相符。MM患者与正常MSCs体外造血的能力无显著差别,表明了自体MSCs在MM骨髓造血干细胞的移植中具有临床应用价值。
综上,MM患者MSCs向OB分化中的增殖与形成能力减弱,可能与Runx2的表达减弱相关,MM患者与正常MSCs体外造血的能力无显著差别,预测MM患者自体MSCs联合骨髓造血干细胞移植在MM的诊治中具有临床应用价值。
4 参考文献
1马剑雄,马信龙,孙晓雷,等.体外培养成骨细胞对自体骨髓间充质干细胞定向成骨分化的影响〔J〕.生物医学工程与临床,2009;13(4):279-82,封2.
2陈 华,田学忠,魏均强,等.硫酸钙对人骨髓基质干细胞诱导成骨过程中BMP-2和VEGF表达的影响初步研究〔J〕.生物医学工程与临床,2010;14(5)5:374-7,封2.
3刘 琳,白 海,王存邦,等.黄芪多糖对多发性骨髓瘤患者骨髓间充质干细胞增殖与细胞因子表达的影响〔J〕.现代生物医学进展,2013;13(10):1873-7.
4Lacci KM,Dardik A.Platelet-rich plasma: support for its use in wound healing〔J〕.Yale J Biol Med,2010;83(1):1-9.
5Hatzistergos KE,Quevedo H,Oskouei BN,etal.Bone marrow mesenchymal stem cells stimulate cardiac stem cell proliferation and differentiation〔J〕.Circ Res,2010;107(7):913-22.
6Schäfer R,Schnaidt M,Klaffschenkel RA,etal.Expression of blood group genes by mesenchymal stem cells〔J〕.Br J Haematol,2011;153(4):520-8.
7Lian Q,Zhang Y,Zhang J,etal.Functional mesenchymal stem cells derived from human induced pluripotent stem cells attenuate limb ischemia in mice〔J〕.Circulation,2010;121(9): 1113-23.
8Allickson JG,Sanchez A,Yefimenko N,etal.Recent studies assessing the proliferative capability of a novel adult stem cell identified in menstrual blood〔J〕.Open Stem Cell J,2011;3(2011):4-10.
9Tsagias N,Koliakos I,Karagiannis V,etal.Isolation of mesenchymal stem cells using the total length of umbilical cord for transplantation purposes〔J〕.Transfus Med,2011;21(4):253-61.
10王月田,崔 颖,潘欣宇,等.重组hCDMP1腺病毒转染骨髓间充质干细胞对其向软骨分化的影响〔J〕.重庆医学,2012;41(16):1570-1,4,封2,封3.
11Tseng PC,Hou SM,Chen RJ,etal.Resveratrol promotes osteogenesis of human mesenchymal stem cells by up regulating Runx-2 gene expression via SIRT1/FOXO3A axis〔J〕.J Bone Miner Res,2011;26(10):2552-63.
12李小峰,杨 渊.骨髓间充质干细胞在骨科的应用〔J〕.广西医学,2010;32(7):857-9.
13靖 彧,于 力,郭广宏,等.蛋白质芯片技术检测异基因造血干细胞移植患者血浆IL-4和IL-6含量变化及其与aGVHD关系探讨〔J〕.中国实验血液学杂志,2008;16(2):360-3.

