点阵CO2激光对光老化大鼠皮肤抗氧化指标的影响
黄茂芳 邓景航 朱慧兰 杨慧兰 刘仲荣
(广州市皮肤病防治所,广东 广州 510090)
由于长期的日光照射,主要是紫外线辐射可导致皮肤光老化〔1〕。随着激光技术的发展,点阵激光可以应用于光老化的治疗。为探讨其治疗机制,本文就应用点阵CO2激光处理光老化Wistar大鼠皮肤,观察光老化大鼠在外观、组织学及抗氧化指标丙二醛(MDA)/超氧化物歧化酶(SOD)方面的变化,探讨其临床意义。
1 材料与方法
1.1实验动物 SPF级雄性Wistar大鼠37只,体重200~250 g,由中山大学实验动物中心提供[许可证号:SCXK(粤)2009-0011]。
1.2分组 27只Wistar大鼠制备光老化模型,15只造模成功。随机选取10只造模成功的大鼠为实验组,10只未经处理的Wistar大鼠随机成为对照组。两组分别做自身对照,分成实验1组(A1)、实验2组(A2)、对照1组(B1)、对照2组(B2)。两组大鼠精神状态良好,活泼,进食正常。
1.3实验试剂与仪器 MDA测定试剂盒、SOD测试盒(南京建成生物工程研究所),仪器:紫外线光疗仪 SS-03A型、紫外线幅照度监视计(上海希格玛高技术公司),紫外线光疗仪UV801KL(Waldman公司),超级酶标仪(Bio Rad,MXLEL 680),点阵CO2激光机(UltraPulse Encore TM Lumenis,美国)。
1.4实验方法 将实验组大鼠固定于自制的大鼠固定器中,遮盖其眼睛与头部,暴露背部裸露皮肤。造模方法与判断标准见文献〔2〕。实验动物备皮后,以低能量点阵CO2激光(能量:波长10 600 nm,光斑大小4×4 mm2,光点0.125 mm,能量125 mJ/cm2,连续脉冲数1),照射实验2组与对照2组背部;高能量CO2激光(能量参数同,连续脉冲数4,即能量600 mJ/cm2)照射实验1组与对照1组。各组分别于治疗后1 d、1、2、3、4 w后取材观察相关指标变化。
1.5观察指标 (1)大鼠一般情况,体重、进食、精神状态等。每天观察大鼠的进食、精神状态。(2)大鼠暴露部位皮肤肉眼观。观察内容:整个实验期间,每天观察动物背部皮肤有无红斑、水泡、糜烂、结痂等。观察皮肤粗糙程度、皮肤弹性状态、皱纹变化等。
1.6苏木素-伊红(HE)染色观察皮肤组织病理学切片 动物称重后以10%水合氯醛按0.3 ml/100 g计算麻醉药物量,腹腔注射麻醉后,实验组每只切取约0.5×0.5 cm2的皮肤组织各4块。
1.7皮肤组织氧化与抗氧化指标测定 按说明书,分别用相应的测定试剂盒脂质过氧化产物MDA、SOD的测定。
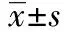
2 结 果
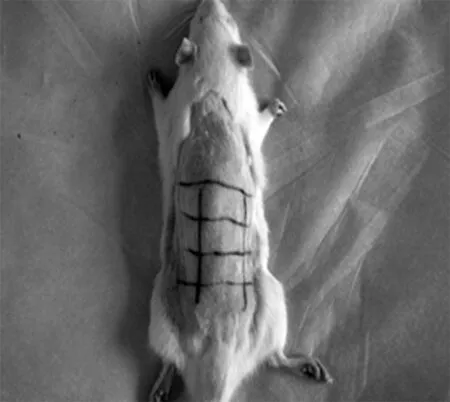
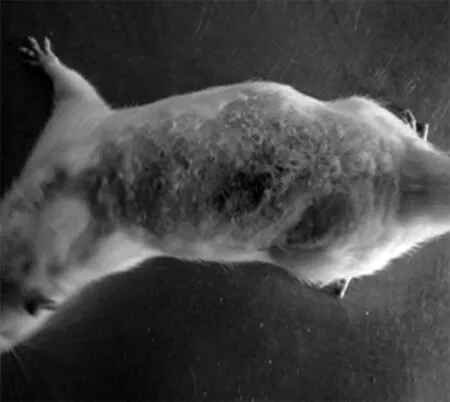
2.1大鼠暴露部位皮肤肉眼观 激光照射1 w后全部治疗组结痂脱落。实验组光老化的皮肤肉眼观发生了迅速变化,1 w后,原光老化的皮肤外观就明显减轻,但皮肤的弹性恢复仍较慢。见图1。
2.2HE染色组织学检查结果 随着激光治疗时间的延长,新生的胶原从真皮中层开始向两端深部扩散。其中实验组的光老化组织学表现逐渐改善,紊乱、僵硬的胶原纤维逐渐改善,而对照组新生胶原不断增加。见图2。
正常大鼠
光老化大鼠
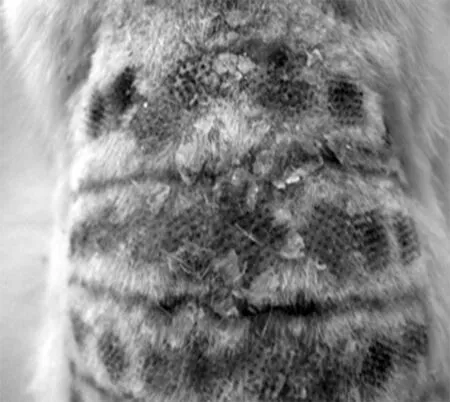
实验组治疗第1天
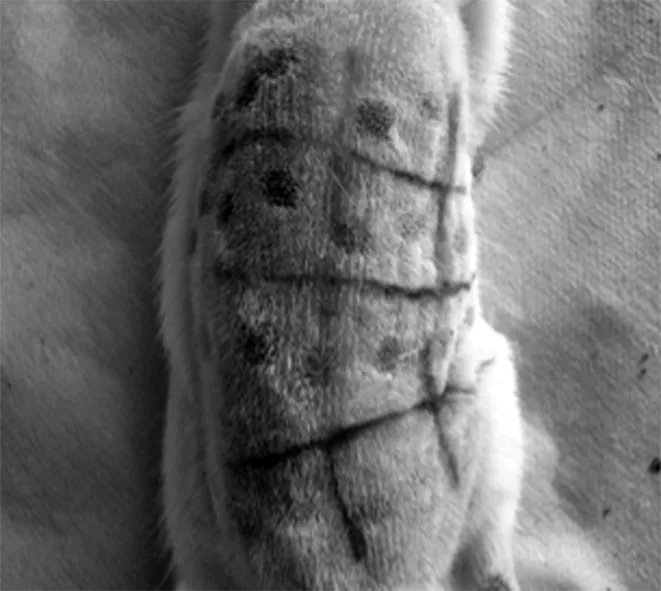
对照组治疗第1天

对照组治疗第4周
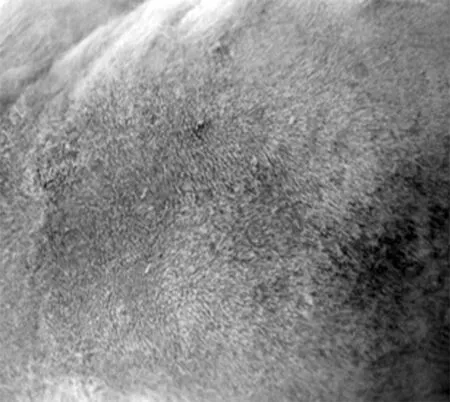
实验组治疗第4周
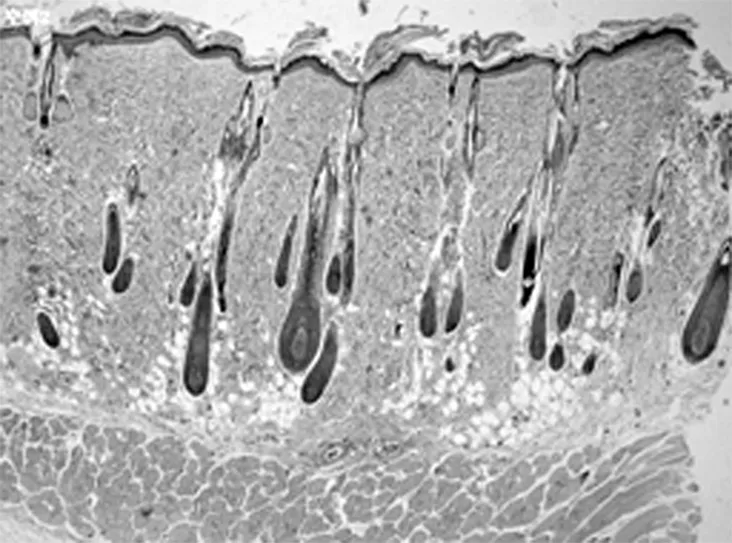
正常大鼠皮肤(×40)

光老化皮肤(×100)
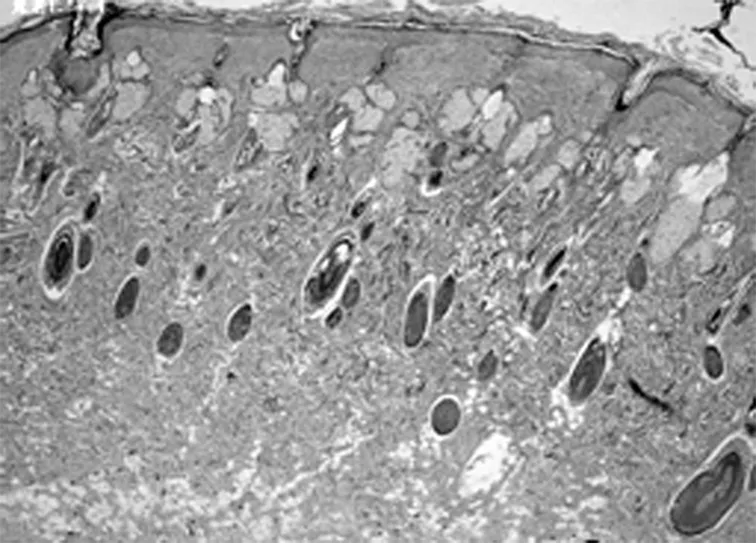
A1组第2周(×40)
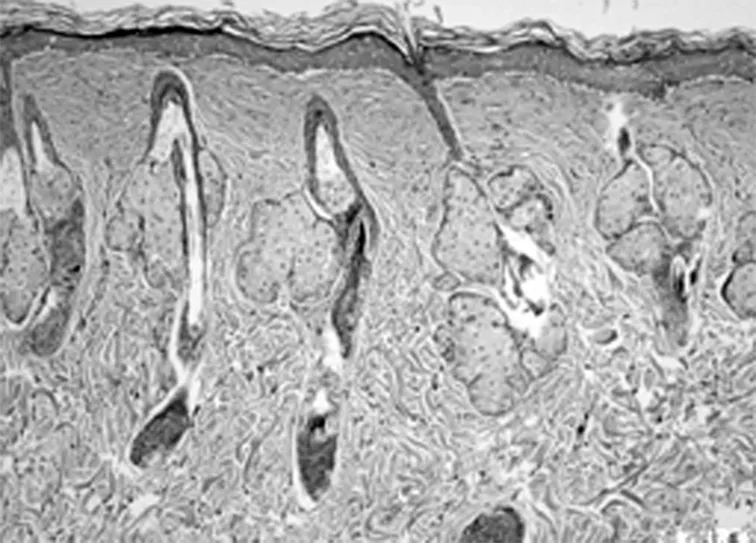
A1组第2周(×100)

B1组第2周(×40)
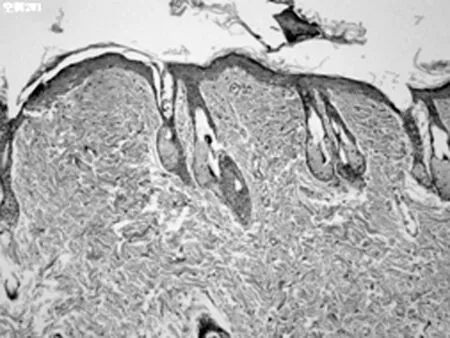
B1组第2周(×100)

A1组第4周(×100)
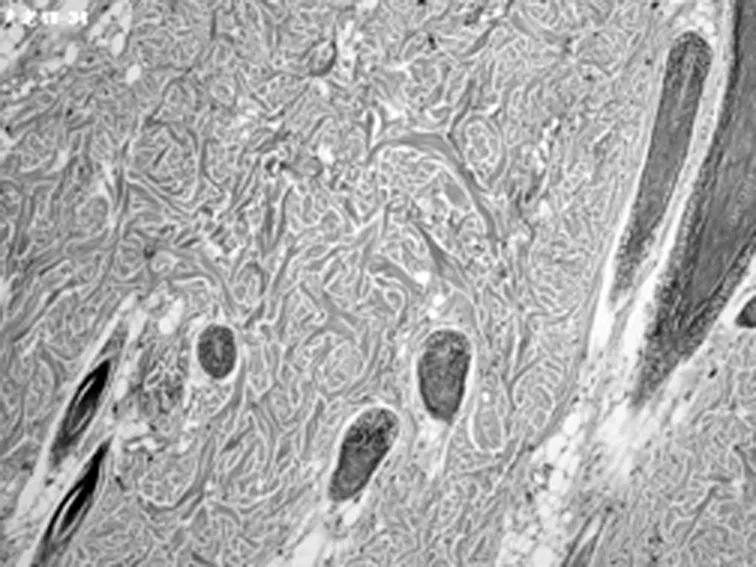
A1组第4周(×200)
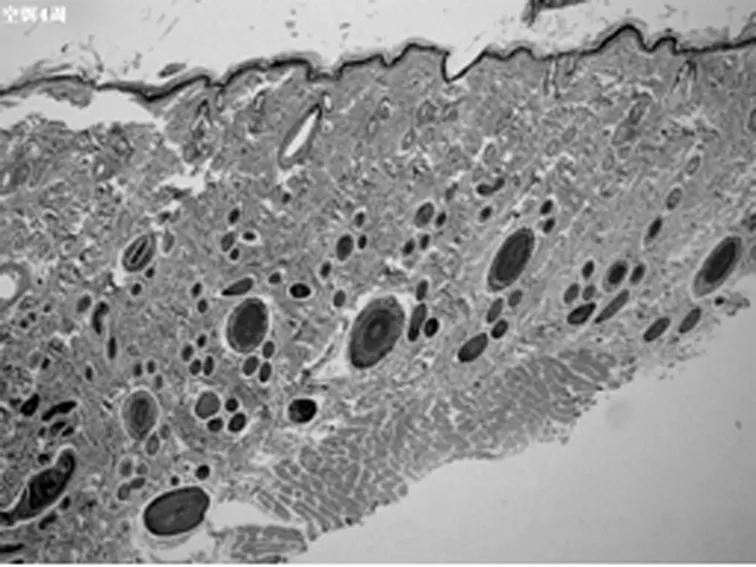
B1组第4周(×40)
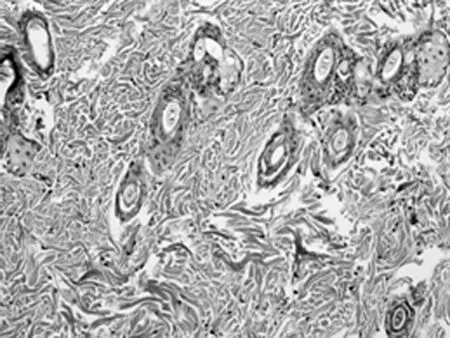
B1组第4周(×200)
2.3MDA检测结果 见表1。从时间与分组因素来考虑,各组均数存在统计学差异(P<0.001),且存在交互效应(F=274.602,P<0.001)。对A1组、A2组均数进行重复测量方差分析显示,Mauchly球型检验示:Mauchly W值为0.125,采用Greenhouse-Geisser校正;A1组与A2组均数存在统计学差异。用pairwise comparisons进行多重比较显示,各组均数之间的P<0.001。对B1组、B2组均数进行重复测量方差分析显示,Mauchly球型检验示:Mauchly W值为0.421,P=0.117,满足球型检验;B1组与B2组均数没有统计学差异。用pairwise comparisons进行多重比较显示,第1周B组均数与第2周B组均数没有统计学差异(P=0.773),第3周B1组均数与第4周B1组均数没有统计差异(P=0.624),其余组之间比较均显示P<0.05。
2.4各组SOD检测结果 见表2。从时间与分组因素来考虑,各组均数存在统计学差异(P<0.001),且存在交互效应(F=313.430,P<0.001)。
对A1组、A2组均数进行重复测量方差分析显示,Mauchly球型检验示:Mauchly W值为0.346,采用Greenhouse-Geisser校正;A1组与A2组均数存在统计学差异。用pairwise comparisons进行多重比较显示,第3周A组与第4周A组均数统计学意义(P=0.952),其余各组均数之间的P<0.001。
对B1组、B2组均数进行重复测量方差分析显示,Mauchly球型检验示:Mauchly W 值为0.454,P=0.166,满足球型检验;B1组与B2组均数不存在统计学差异。用pairwise comparisons进行多重比较显示,第1天B组均数与第3周B组均数统计学差异(P=0.133),第1周B组均数与第2周B组均数统计差异(P=0.607),第3周B组均数与第4周B组均数没有统计学意义(P=0.078),其余组之间比较均显示P<0.05。
第4周A1组与B1组均数没有统计学差异。A2组与B2组均数也统计学差异(P>0.05)。
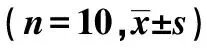
表1 实验期间治疗组MDA含量变化
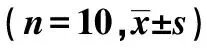
表2 实验期间治疗组SOD含量变化
3 讨 论
点阵激光可以治疗光老化,但目前的研究主要集中在治疗临床经验的总结,用点阵CO2激光治疗光老化Wistar大鼠,从微观组织结构、分子生物学等方面去探讨点阵激光的治疗机制。从外观上看,在点阵CO2激光治疗1次的情况下,无论是接受了高能量还是较低能量的大鼠皮肤,在短短的1 w时间内,痂皮脱落后都表现出明显的改善,包括皱纹、皲裂、色素沉着消失,皮肤弹性改善明显,说明点阵CO2激光治疗光老化的效果快速。点阵CO2激光治疗中导致皮肤出现点阵分布的凹陷性瘢痕,3 w后都全部消失,说明这种治疗方法副作用小。从激光的作用能量来看,高能量与低能量激光治疗的肉眼观的效果类似,只是高能量治疗后皮肤结痂多些,脱落时间稍长于低能量治疗组。
以皮肤组织学切片观察光老化的微观变化是比较客观的评价标准。以时间段来观察光老化组织学的改变,点阵CO2激光作用于皮肤后,短时间(1 d)内引起组织内炎症,主要是表皮和真皮乳头层的炎性细胞浸润,可见确实存在组织创伤(无菌性炎症)。但炎症1 w左右的时间就能消失。组织炎症后的修复重建同时开始,1 w的组织切片上就看到有成纤维细胞的增生,有多少不等的新生胶原纤维出现,以后逐渐增多。组织的修复不仅是新生胶原的出现,看到原先大量僵硬的、聚集成束的纤维逐渐软化、散开。一方面是胶原的增生,一方面是胶原的重排和重组,这可能是激光照射后组织吸收热量,与热诱导的热效应有关。并且,激光作用的部位比较集中。组织吸收能量后,出现局灶性的一过性表皮、真皮乳头层炎症反应,真皮层出现多个局灶性的裂隙,围绕着裂隙周围,结缔组织疏松,包括胶原间疏松、水肿,而且它们集中在真皮中层,同时可以见到一些间杂有光老化部位的改变却不明显。说明激光的能量作用很集中,接收到能量照射的部位,早期就出现组织学改变,而没有照射到微小激光束的部位自然改变不多;同时,微小点阵激光束作用到的能量焦点,主要在真皮中层。随时间的延长,新生的胶原逐渐向呈带状修复,可覆盖到原先未被激光束所照射的光老化区,进而引起皮肤全面的修复重建。点阵CO2激光治疗光老化的效果得到组织学上的证实。
活性氧簇(ROS)在皮肤光老化的发病机制中扮演重要的角色〔3〕,常用的氧化及抗氧化指标,如MDA、SOD等,以MDA/SOD的变化〔4〕来评价激光治疗效果。本研究中对照组虽然是正常皮肤,没有光老化的病理状态,但在作用的早期,激光引起皮肤组织局灶性的炎症、水肿,这些都是共同的创伤早期表现,可以引起暂时性的氧化应激状态,导致一过性的MDA升高,而适度的氧化应激状态可以诱导SOD的表达。随着修复重建的进行,正常皮肤组织中氧化应激状态的解除,MDA与SOD都出现下降,回归至正常水平。因此,皮肤过氧化指标MDA以及抗氧化指标SOD比较灵敏,能够反映早期治疗效果以及恢复水平,同时不同能量对皮肤组织中MDA/SOD影响有差异。本研究显示,点阵CO2激光有扭转过氧化状态的作用,因此能够治疗光老化。并且这个作用与能量有一定的相关性。分析其中可能的机制是:在一定能量密度下,激光穿透皮肤形成微治疗区(MTZ)〔5〕,就是在组织切片上看到的裂隙区,微治疗区周围的组织疏松,血氧的渗透,有利于清除光老化条件下组织间堆积的脂质过氧化物;有可能激光产生的生物效应激活了大量的细胞及炎症因子,促进SOD的分泌及MDA的清除。
综上,本实验从大体观、微观组织结构方面证实了点阵CO2激光治疗光老化的效果。氧化与抗氧化等生化指标可以作为反映早期治疗效果以及恢复水平的参考指标之一。
4 参考文献
1刘 玮.皮肤光老化〔J〕.临床皮肤科杂志,2003;32(7): 424-6.
2郭鲁义,李春雨,张 宁,等. 实用光老化动物模型建立方法的探讨〔J〕. 中国美容医学,2008;17(2):235-7.
3Berneburg M,Plettenberg H,Medve-Konig K,etal. Induction of the photoaging associated mitochondrial common deletion in vivo in normal human skin〔J〕. J Invest Dermatol,2004;122(5): 1277-83.
4Gilchrest BA. Skin aging and photoaging:an overview〔J〕. J Am Acad Dermatol,1989;21(32):610-3.
5Starnes AM,Jou PC,Molitoris JK,etal. Acute effects of fractional laser on photo-aged skin〔J〕. Dermatol Surg,2012;38(1):51-7.

