Gen对类风湿关节炎RA患者BM-MSCs中RANK/RANKL/OPG系统的影响
尚 辰,杨滨州,张 育,沈维干
(扬州大学临床医学院 风湿免疫科,江苏 扬州,225001)
类风湿关节炎(RA)是一种慢性、系统性的自身免疫性疾病,其特征是多关节的慢性炎症,进行性的骨与软骨破坏。该病在中国的患病率达0.32%~0.36%,是造成中国劳动力丧失和致残的主要疾病之一。据文献[1]报道,35% RA患者在10年内丧失工作能力。随着对RA发病机制研究的深入,一些新的治疗方法能很好地控制RA的炎症。但如何有效预防和干预RA患者关节破坏,促进骨修复,改善患者的生活质量,仍然是RA研究的热点。
来源于造血干细胞的破骨细胞过度分化和活化在RA骨破坏进程中起着至关重要的作用。近年来发现,核因子κB 受体活化因子配体(RANKL)/核因子κB受体活化因子(RANK)/骨保护素(OPG) 系统与破骨细胞分化及活化过程密切相关。间充质干细胞(MSCs)能够向炎症和损伤部位“归巢”,具有自我增殖、免疫调节和修复等功能[2],该特性和功能可能在RA骨破坏的修复中起到积极作用。
雌激素通过与雌激素受体结合而活化雌激素受体介导的信号通路来调控BM-MSCs的增殖和相关功能[3-4]。金雀异黄素(Gen)具有与雌激素相同的结构,药理学研究发现其除了弱雌激素作用外,还具有其他药理作用,如抗癌、抗炎、免疫调节及调节心血管系统等作用[5-6]。本研究前期已证实Gen能抑制RA大鼠关节的破坏[7],本文进一步观察Gen对RA患者BM-MSCs中RANK/RANKL/OPG系统的影响,并探讨其可能的机制。
1 材料与方法
1.1 实验对象
RA患者来源于扬州大学临床医学院风湿免疫科,符合1987年美国风湿病学会(ACR)的RA诊断标准,疾病处于高度活动期。健康对照组性别、年龄与RA组相匹配,无其他自身免疫性疾病,无心血管疾病、代谢性疾病、退行性疾病、血液病、肿瘤及遗传病等可能影响实验结果的疾病。
1.2 主要试剂、仪器及来源
Gen(上海融合医药科技发展有限公司),Ficoll淋巴细胞分离液(天津市灏洋生物科技有限公司),低糖DMEM培养液(Hyclone公司),胎牛血清(Gibco公司),鼠抗人CD34-PE单克隆抗体、鼠抗人CD45-PE-Cy5单克隆抗体、鼠抗人CD29-PE单克隆抗体、鼠抗人CD90-FITC单克隆抗体(Becton Dickinson公司),兔抗人RANKL多克隆抗体、兔抗人ER α多克隆抗体、兔抗人OPG多克隆抗体、兔抗人RANK多克隆抗体(Santa Cruz公司),山羊抗兔IgG-HRP(上海康成生物工程有限公司),山羊抗兔IgG-FITC(武汉博士德生物工程有限公司),雌激素受体拮抗剂ICI182710(Toc-ris公司),雌二醇(E2)(大连美仑生物技术有限公司),荧光显微镜(Olympus公司),电泳仪、垂直电泳槽、转印槽(Bio-rad公司),酶标仪(Bio-Tek公司),流式细胞仪(Becton Dickinson公司),化学发光凝胶成像系统(ALPHA公司)。
1.3 BM-MSCs的分离、培养
髂后上棘取骨髓 5 mL,置于含0.5 mL肝素钠(100 U/mL)的无菌小瓶,混匀,加入5 mL无血清DMEM培养液,制成细胞悬液。将细胞悬液置于等体积Ficoll分离液上,2 500 r/min离心30 min,吸取界面层,加入5倍体积的PBS,混匀,1 000 r/min离心8 min,PBS洗涤2次。DMEM培养液悬浮细胞,细胞计数后重悬于含10%FBS的DMEM培养液中,按1×105/mL的密度接种于25 cm2细胞培养瓶中,置于37 ℃、5% CO2培养箱内培养。48 h后半量更换培养液,以后每3 d换液1次。待细胞汇合接近80%时,用0.25%胰蛋白酶消化、传代,至第三代备用。用倒置相差显微镜观察细胞的形态及生长情况。
1.4 BM-MSCs的鉴定
取传代后的第3代BM-MSCs,培养至80%汇合时,胰蛋白酶消化细胞,用含10% FBS的培养液中和,1 500 r/min离心15 min,收集细胞,PBS洗涤3次,制成 1×105/mL细胞悬液。各取100 μL细胞悬液分别加入荧光标记的抗人CD34、CD45、CD25、CD90抗体标记,室温孵育30 min,另设空白对照管,流式细胞仪鉴定。
1.5 Western Blot检测RANK、RANKL、OPG的表达
根据预实验MTT结果,Gen在浓度为1 μmol/L时对BM-MSCs无细胞毒性作用,所以作者选用1 μmol/L作为实验终浓度。实验分为4组:空白对照组(Con组,未处理)、Gen处理组(Gen组,1 μmol/L)、雌二醇处理组(E2组,0.01 μmol/L)和Gen+雌激素受体拮抗剂组(Gen+ICI组,Gen 1 μmol/L、ICI182710 0.1 μmol/L)。取传代后第3代的正常人与RA患者的BM-MSCs,按分组加入药物处理96 h后,提取细胞总蛋白,进行蛋白定量,SDS-PAGE,转膜,一抗(RANKL、OPG工作浓度1∶200,RANK工作浓度1∶100,GAPDH工作浓度1∶4 000)4 ℃孵育过夜,二抗(1∶4 000)室温孵育2 h,ECL试剂盒显色,化学发光凝胶成像系统获得Western条带,以GAPDH 为参照,ImageJ2x软件对条带吸光度值进行分析。
1.6 免疫荧光法免疫荧检测雌激素受体α(ERα)细胞内分布情况
取传代后的RA患者第3代BM-MSCs,分为Con组、Gen组、E2组,每组按5×104/孔浓度接种于覆盖盖玻片的24孔培养板中,培养48 h后,取出盖玻片,PBS洗涤2次,4%多聚甲醛固定15 min,PBS洗涤3次,0.5% Triton处理15 min,PBS洗涤3次,3%牛血清白蛋白封闭1 h,加入兔抗人ER α抗体(1∶200),置于湿盒中4 ℃过夜后,PBS洗3次,加入山羊抗兔IgG-FITC (1∶50)室温孵育2 h,PBS洗涤3次,加入DAPI染色10 min,PBS洗涤3次,封片,于荧光显微镜下观察。
2 结 果
2.1 细胞形态观察以及细胞表型鉴定
倒置相差显微镜下观察结果显示,RA患者的BM-MSCs传代后的细胞形态与成纤维细胞形态相似,呈长梭形,排列规则 (见图1),符合人BM-MSCs的形态特征。流式细胞仪检测第3代BM-MSCs中CD90阳性细胞率为99.7%,CD29阳性细胞率为99.9%,CD34阳性细胞率为0.9%,CD45阳性细胞率为1.8%(见图2),符合BM-MSCs的基本特征标志,正常人的BM-MSCs的细胞形态及鉴定与RA患者的BM-MSCs特征是一致的。

图1 生长汇合的RA患者的BM-MSCs 100倍

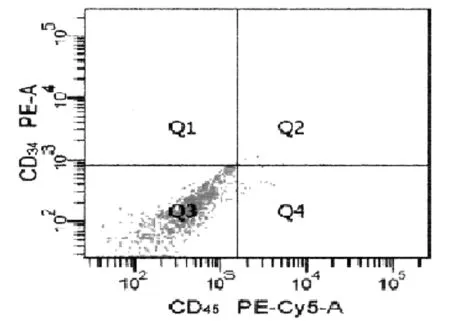
图2 流式细胞仪检测RA患者BM-MSCs表面抗原结果
2.2 Gen显著上调BM-MSCs中OPG的表达
用Western blot方法检测BM-MSCs中RANK、RANKL和OPG的蛋白表达水平,实验结果由图3和图4所示。与正常人BM-MSCs相比,RA患者BM-MSCs中的RANK的蛋白表达水平明显升高,OPG的蛋白表达水平明显降低,数据分析显示RANKL/OPG比值升高,提示BM-MSCs中RANK/RANKL/OPG表达改变可能在RA骨质破坏的病理进程起着重要作用。Gen可以显著上调正常人BM-MSCs中的OPG的蛋白表达(P<0.05),对RANK、RANKL的表达无明显影响(P>0.05),效果与E2类似;数据分析表明Gen可以降低RANKL/OPG比值; Gen联合雌激素受体拮抗剂处理正常人BM-MSCs后,与Gen组和E2组相比OPG蛋白表达降低(P<0.05),与Con组相比略有升高但差异无统计学意义(P>0.05)(图3)。Gen同样可显著上调RA患者BM-MSCs中的OPG蛋白表达(P<0.05),对RANK、RANKL表达也无明显影响(P>0.05),效果与E2类似;同时,数据分析也显示Gen可降低RANKL/OPG比值; Gen联合雌激素受体拮抗剂处理RA患者的BM-MSCs后,与Gen组和E2组相比OPG蛋白表达水平有所降低(P<0.05),但其表达水平仍高于Con组 (P<0.05)(图4)。
2.3 Gen可以促进RA患者BM-MSCs的ERα入核
Gen作用RA患者BM-MSCs 48 h后,免疫荧光检测ERα细胞内分布情况。结果显示: Gen与E2可显著促进ERα进入细胞核(图5),提示Gen可能通过与ERα结合,促进ERα进入细胞核。

A: RANK、RANKL、OPG、GAPDH的蛋白表达水平; B: 对应的RANK、RANKL、OPG相对于GAPDH灰度值比值; C: 各处理组RANKL/OPG比值。与Con组比较,△P<0.05。

A: RANK、RANKL、OPG、GAPDH的蛋白表达水平; B: 对应的RANK、RANKL、OPG相对于GAPDH灰度值比值; C: 各处理组RANKL/OPG比值。与Con组比较,△P<0.05; 与Gen组和E2组比较,*P<0.05。

图5 Gen促进RA患者BM-MSCs的ERα入核
3 讨 论
关节周围骨质疏松和全身骨质流失在RA患者中甚为常见。炎症因子破坏骨髓微环境对BM-MSCs造成损伤是RA导致病理性骨质疏松的重要原因[8]。BM-MSCs作为骨髓微环境中的重要细胞组分,表达多种具有造血细胞调控能力的细胞因子,通过直接或间接的方式调控造血细胞的分化与成熟。成骨细胞起源于BM-MSCs[9],破骨细胞起源于造血干细胞,骨髓微环境中RANKL/OPG可能决定了破骨细胞的分化和成熟[10-11]。RA骨质破坏可能是由于骨髓微环境中的成骨细胞分化受到抑制,破骨细胞过度分化成熟所致[8]。这些研究结果提示了BM-MSCs在RA的骨质破坏中起着重要作用。本研究选择正常人和RA患者的BM-MSCs为研究对象,通过分离培养得到正常人和RA患者的BM-MSCs,显微镜观察显示细胞呈成纤维样、漩涡状生长,符合BM-MSCs的形态特点,表面抗原CD29、CD90阳性率超过95%,CD34、CD4阳性率低于2%,符合BM-MSCs基本特征标志,可用于本实验研究。
RANKL/OPG/RANK系统在骨重建中起着重要作用,通过RANK/RANKL/OPG系统介导的破骨细胞造成的骨质破坏在RA的病理进程中发挥重要作用[12]。有研究[13]显示,RA患者血清、关节滑液中OPG水平降低,RANKL/OPG比值升高。而RANKL/OPG的平衡决定了破骨细胞活化和增殖的水平[10],因此RA患者RANKL/OPG比值升高可能介导了骨质破坏。本组研究发现,与正常人BM-MSCs相比,RA患者BM-MSCs中的RANK的蛋白表达水平明显升高,OPG的蛋白表达水平明显降低,数据分析显示其RANKL/OPG比值升高。本研究前期已发现Gen可抑制CIA大鼠的骨质破坏[7],考虑到BM-MSCs在RA的骨质破坏中起着重要作用,因此本文在体外细胞水平进一步探讨Gen是否通过对BM-MSCs中RANK/RANKL/OPG系统的调控而起到抑制RA骨质破坏的作用。研究结果表明,Gen可显著上调RA患者BM-MSCs的OPG蛋白表达,而对RANK、RANKL蛋白表达无明显影响,提示Gen可能通过调控RA患者的BM-MSCs中OPG的表达,降低RANKL/OPG的比值,从而抑制破骨细胞过度活化和分化,最终抑制RA患者关节骨质破坏。
Gen是一种植物雌激素,可能通过雌激素样作用在卵巢切除小鼠骨质疏松模型中影响骨质代谢[14]。本研究结果显示,Gen和E2对RANK/RANKL/OPG表达的影响类似;同时免疫荧光结果显示: Gen可显著促进RA患者的BM-MSCs中ERα入核,提示Gen可能通过促进ERα入核,活化ERα介导的相关信号通路,上调OPG的表达,进而影响RANKL/OPG的比值。为进一步验证Gen是否通过活化ERα介导的相关信号通路起作用,本文使用Gen联合雌激素受体拮抗剂ICI182710处理BM-MSCs,Western Blot结果显示与Gen组和E2组相比,其OPG蛋白表达水平降低,但与Con组相比,其OPG蛋白表达水平升高,Gen促进OPG蛋白表达的作用并没有被完全抑制。这些结果提示Gen除了通过活化ERα介导的相关信号通路影响RANKL/OPG的比值,可能还通过其他信号通路发挥调控作用。
[1]Allaire S,Wolfe F,Niu J,et al.Contemporary prevalence and incidence of work disability associated with rheumatoid arthritis in the US [J].Arthritis Rheumatism,2008,59(4): 474.
[2]Uccelli A,Moretta L,Pistoia V.Mesenchymal stem cells in health and disease [J].Nat Rev Immunol,2008,8(9): 726.
[3]Cha Y,Kwon S J,Seol W,et al.Estrogen receptor-alpha mediates the effects of estradiol on telomerase activity in human mesenchymal stem cells [J].Mol Cells,2008,26(5): 454.
[4]Erwin G S,Crisostomo P R,Wang Y,et al.Estradiol-treated mesenchymal stem cells improve myocardial recovery after ischemia[J].J Surg Res,2009,152(2): 319.
[5]Zhao R,Xiang N,Domann F E,et al.Effects of selenite and genistein on G2/M cell cycle arrest and apoptosis in human prostate cancer cells[J].Nutr cancer,2009,61(3): 397.
[6]Reiter E,Reiter E,Beck V,et al.Isoflavones are safe compounds for therapeutical applications-evaluation of in vitro data [J].Gynecol Endecrinol,2009,25(9): 554.
[7] 许金鑫,张育,张学增,等.金雀异黄素对CIA 大鼠炎症及细胞因子影响的研究[J].实用临床医药杂志,2010,14(19): 1.
[8] Kotake S,Nanke Y.Effect of TNFα on osteoblastogenesis from mesenchymal stem cells [J].Biochim Biophys Acta,2014,1840(3): 1209.
[9]Pittenger M F,Mackay A M,Beck S C,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411): 143.
[10]Ando K,Mori K,Rédini F,et al.RANKL /RANK/OPG: key therapeutic target in bone oncology[J].Curr Drug Discov Technol,2008,5(3): 263.
[11]Coetzee M,Kruger M C.Osteoprotegerin-receptor activator of nuclear factor-kappaB ligand ratio: a new approach to osteoporosis treatment[J].South Med J,2004,97(5): 506.
[12]Neumann E,Gay S,Müller-Ladner U.The RANK/RANKL/Osteoprotegerin System in Rheumatoid Arthritis: New Insights From Animal Models[J].Arthritis Rheum,2005,52(10): 2960.
[13]樊秋贵,郭钧,杨民.OPG RANKL RANK等因子在类风湿关节炎患者血清及滑膜液中的变化及意义[J].中华风湿病学杂志,2007,11(1): 38.
[14]Hertrampf T,Gruca M J,Seibel J,et al.The bone-protective effect of the phytoestrogen genistein is mediated via ER alpha-dependent mechanisms and strongly enhanced by physical activity[J].Bone,2007,40(6): 1529.

