复方卡托普利脉冲缓释微丸的制备及释放度考察
李武营,樊轻亚,游国叶
(1.河南大学 学报编辑部, 河南 开封 475000;2.信阳职业技术学院药学院,河南 信阳 464000)
卡托普利(Captopril,Cap,1)是第一代血管紧张素转换酶抑制剂,是治疗高血压及充血性心衰的首选药物之一,生物半衰期短,一日需要服药多次才能达到降压效果,易引起较大的峰谷浓度差,氢氯噻嗪(Hydrochlorothiazide,Hctz,2)是噻嗪类利尿剂。研究[1]表明,两种药物组方,降压作用增强,不良反应减少。
时辰药理学研究表明,高血压、心绞痛等心血管疾病,其发病均具有时辰节律性,多在凌晨3:00~6:00时之间发病,最佳服药时间在病情发作前1~2 h,这给及时治疗、减轻病痛带来了很大的不便,普通制剂已错过最佳治疗期。随着时间生物学和时辰药理学的发展,释药方式符合人体昼夜节律变化的口服脉冲释药系统受到药学工作者的广泛关注[2-5]。我们在高血压药物临床应用基础上,借鉴Searl公司的盐酸维拉帕米择时渗透泵片的设计(时控爆破系统, Time-controlled explosion system,TES)[6],结合微丸剂型优势[7],利用流化床技术制备1 d服药1次的复方脉冲缓释微丸,易于工业化生产,服药更安全,这种脉冲缓释制剂可以使患者在晚上睡前服用而凌晨起效,使得疾病得到很好的控制。其中①为脉冲缓释微丸,利用TES原理和流化床包衣设备,在空白丸芯上药,内层包衣材料选用水溶胀型高分子材料L-HPC, 外层包衣材料则选用惰性高分子Surelease作为控释膜材料。当胃肠液通过控释膜进入溶胀层后, 水溶胀型聚合物吸水膨胀, 产生一定的溶胀压, 当溶胀压和膨胀体积达到足够大时, 控释膜破裂,加上丸心含有的高效崩解剂,从而使药物释放从丸心释放,形成一种脉冲式释放。复方中②为缓释微丸,空白丸芯上药后,选用Eudragit NE30D作为缓释层包衣材料。将两种微丸按比例填装于胶囊中,①经过时滞为5 h时开始释放药物,再经过约8 h体外释药基本完全。②达峰慢,半衰期长,不需要时滞,体外释放13 h时药物也基本释放完全,能够发挥协同的作用。在复方卡托普利片剂量基础上选定本复方脉冲缓释微丸两种主药各自的规格,①为15 mg/粒,②为9 mg/粒,与普通制剂相比,服药次数减少,提高患者顺应性。
1 仪器及试剂
LC-10AVP高效液相色谱仪(日本岛津公司);kromasoil C18柱(250 mm×4.6 mm,5 μm)(大连依利特分析仪器有限公司);小型流化床包衣机(沈阳药科大学沈阳医联新药研究所);空白丸芯(上海华高药用辅料厂);乙基纤维素水分散体(Surelease E-7-19040,上海Colorcon公司,LN516474);聚乙烯比咯烷酮(PVP K30,上海化学试剂采购供应站,批号91-02-07);HPMC(上海Colorcon公司,批号SH109389);Eudragit NE30D(Rohm Gmbh公司,批号B070312033);色谱甲醇(山东禹王实业有限公司化工分公司,批号20100415162)。
2 试验方法及结果
2.1 复方脉冲缓释微丸的制备
2.1.1 脉冲微丸的制备 含药丸芯的制备:称取药物1适量用无水乙醇溶解,向药物溶液中加入体积分数为2%的HPMCE3水溶液,取一定量的空白蔗糖丸芯于流化床中,38 ℃预热5 min,调节雾化压力于0.08~0.1 kg/cm2、鼓风频率于25~30 Hz、包衣温度38~41 ℃、恒流泵流速0.6~0.9 mL/min,采用空白丸芯上药法,制备含药丸芯。结束后60 ℃干燥6 h,过24目筛网,即得含药丸芯,上药率为80%。
溶胀层:取含药丸芯适量,40 ℃预热5 min,将体积分数为2%的HPMC E3加入到L-HPC溶液中,使L-HPC质量浓度约为8%,调节雾化压力于0.08~0.1 kg/cm2、鼓风频率于22~30 Hz、包衣温度于38~41 ℃、恒流泵流速0.7~0.9 mL/min,包衣过程中不断搅拌,结束后,60 ℃干燥1 h,备用。
控释层:称上述微丸适量,预热,将Surelease水分散体用蒸馏水稀释为10%,调节雾化压力于0.06~0.1 kg/cm2、鼓风频率于22~28 Hz、包衣温度于35~38 ℃、恒流泵流速0.9~1.1 mL/min,包衣即得。
2.1.2 缓释微丸的制备 称取药物2用乙醇超声溶解,加体积分数为2%的PVP K30水溶液,高剪切匀化机匀化5 min,备用;取空白丸芯40 ℃下预热5 min,在优化的工艺参数下上药。过24目筛网,备用。上药率为75%。取一定量的含药丸,38 ℃预热10 min,将30%(w/w)的Eudragit NE30D水分散体用水稀释至10%进行流化包衣,调节雾化压力于0.1~0.2 kg/cm2、鼓风频率于22~30 Hz、包衣温度于26~28 ℃、恒流泵流速0.6~0.8 mL/min,包衣过程中低速搅拌。即得。
2.2 HPLC测定方法
2.2.1 色谱条件 色谱柱:kromasoil C18柱(250 mm×4.6 mm,5 μm,大连依利特);流动相:9%四氢呋喃甲醇溶液0.5 g/L磷酸水溶液(33∶67);流速:1.0 mL/min;进样量:20 μL;检测波长:220 nm。
2.2.2 标准曲线 精密称取药物1适量置于2个100 mL量瓶中,分别用0.1mol/LHcl溶液及pH6.8磷酸盐缓冲液定容,得药物1贮备液,分别用0.1 mol/LHcl溶液、pH6.8磷酸盐缓冲液逐步稀释,得到2~24 μg/mL的系列标准溶液。分别进样测定,以浓度(C)对峰面积(A)回归,可得在0.1 mol/LHcl溶液中标准曲线为A=8 123.5C-6 087.1,r=0.999 9;在pH6.8磷酸盐缓冲液中的标准曲线为CAPA=7 465C-3 905.3,r=0.999 5.
2.2.3 标准曲线 精密称取药物2适量置于2个100 mL量瓶中,分别用0.1 mol/LHcl溶液及pH6.8磷酸盐缓冲液定容,得药物2贮备液,分别用0.1 mol/LHcl溶液、pH6.8磷酸盐缓冲液逐步稀释,得到0.05~10 μg/mL的系列标准溶液。分别进样测定,以浓度(C)对峰面积(A)回归,可得在0.1mol/LHcl溶液中标准曲线为A=82 102C+26 348,r=0.999 8;在pH6.8磷酸盐缓冲液中的标准曲线为A=74 601C-16 141,r=0.999 5。
2.3 释放度测定
照中国药典2005年版溶出度测定法第一法装置(附录XC),取两药微丸,精密称定(约相当于一粒复方缓释胶囊)置于转篮中,转速为100 r/min,温度(37±0.5) ℃。先置0.1 mol/LHcl(750 ml)中释放2 h,更换介质,至试验结束。
2.4 药物1的释放度影响因素
2.4.1 溶胀层中崩解剂与粘合剂比例对药物释放的影响 预试验中,曾考察了不包溶胀层,直接包控释层,结果包衣增重需达到80%以上时才具有一定的缓释作用,且不符合设计要求。实验中,曾研究了单独使用L-HPC以及L-HPC和HPMC E3合用作为溶胀层包衣液,结果发现,单独使用时L-HPC,由于L-HPC分散性不好,使得包衣液不稳定,在包衣过程中,输液管道中的包衣液易发生沉降,效果也不好,混合使用时,粘度适中,包衣顺畅。故研究中对两者的比例进行了系列实验,保持溶胀层增重20%,控释层增重20%不变,分别以崩解剂L-HPC:粘合剂HPMC E3=3∶1、4∶1:、5∶1进行包衣,考察体外释放,结果见图1。

图1 崩解剂与粘合剂比例对脉冲微丸释放的影响(n=3)
结果表明,当崩解剂L-HPC在溶胀层中的量低于3∶1时,产生的溶胀力不足以引起外层衣膜的破裂,达不到脉冲释放的效果,由试验结果可得,崩解剂∶粘合剂=4∶1。
2.4.2 溶胀层增重对药物释放的影响 脉冲制剂中溶胀层除了能屏蔽丸芯中药物与外界渗入的水分直接接触外,还要求其能在吸收水分后迅速膨胀,产生足够大的膨胀压,撑破外层衣膜,丸芯中的药物快速完全的释放。保持控释层增重不变,分别考察溶胀层包衣增重为10%、20%、30%,考察其对体外释放度的影响,结果见图2。
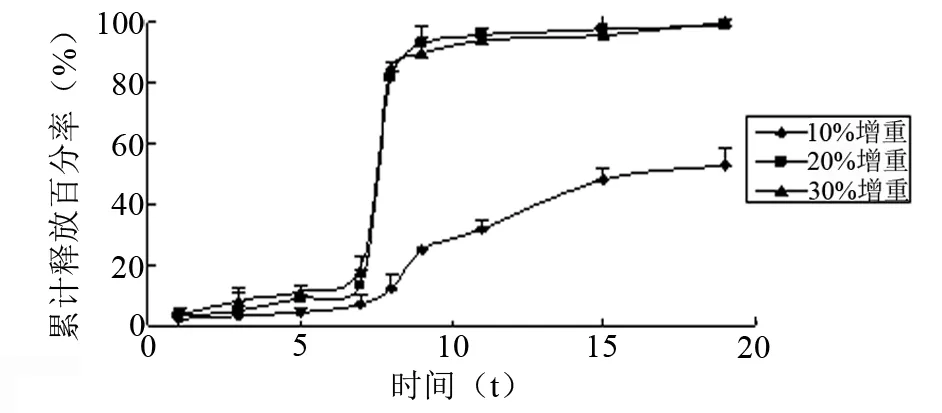
图2 溶胀层不同增重对脉冲微丸释放度的影响(n=3)
由释放结果可知,溶胀层包衣增重达到一定厚度时,方能获得脉冲释放效果。溶胀层包衣增重10%时,释药类似于缓释曲线,直到20 h药物释放仍不到50%,原因可能是由于溶胀层薄,膨胀力不足,控释层衣膜未破裂;当溶胀层包衣增重20%时,时滞6 h后开始破裂,随后4 h内药物基本释放完全,累计释药达90%以上;当包衣增重达到30%时,由释放曲线可看出与增重20%释放相近,由此可推断,当控释层增重一定,溶胀层增重达到某一厚度时,再增加包衣厚度对时滞时间几乎无影响。
2.4.3 控释层增重对药物释放的影响 根据脉冲释药的特点,要求控释层不仅能够有效的控制水分进入丸芯内部的速率,保持膜的完整性,而且当溶胀层膨胀后,在膨胀压的作用下,控释膜应保证有一定的机械强度且易于破裂。保持溶胀层包衣增重不变,改变控释层包衣增重,使其分别为15%、20%、30%,考察其对体外释放度的影响,结果见图3。

图3 控释层不同增重对脉冲微丸释放度的影响(n=3)
结果表明,随着控释层包衣增重的增加,时滞延长,改变控释层包衣增重可调整脉冲释药微丸的时滞。
2.4.4 控释层中致孔剂对药物释放的影响 由于单独使用Surelease®包衣时,EC 膜在较高增重水平下,形成完整衣膜时调整释放的能力会下降,且容易出现药物释放时滞延长,所以在包衣液中需加入少量的致孔剂。我们实验中采用HPMC 作为致孔剂,溶胀层及控释层包衣增重不变,制备致孔剂用量分别为聚合物质量分数的3%、6%、10%的包衣微丸,40 ℃干燥6 h ,考察其体外释药情况,结果见图4。

图4 致孔剂不同用量对脉冲微丸释放度的影响
由图4可见,随着致孔剂用量的增加,药物释放加快,当致孔剂用量较大时,药物释放时滞缩短,这是由于外层衣膜遇到水性介质后,致孔剂溶解,使得外层衣膜形成孔洞增加,加快水分通过衣膜渗透进入丸芯内部,溶胀层吸水溶胀速度加快,缩短了表观释药时滞;当致孔剂用量较小时,药物释放不完全。
2.4.5 处方优化 为了优选最佳处方组成,考虑制剂在晚上约10点服用,可望在凌晨3 点左右血压高峰期起效,定时释药,本课题采用星点设计—效应面优化法优化处方,在单因素考察的基础上,确定了对微丸释放影响较大的三个因素,即溶胀层增重;控释层增重;控制层中致孔剂用量,根据星点设计的原理,安排实验,其中各个因素的极大、极小值根据单因素考察的结果和制备的实际需要确定。考察指标分别是时滞时间tlag(释放10%的时间)、时滞后至释放85%的时间差Δt、归一值OD,经过统计软件design-expert 7.0处理,得到最佳处方为溶胀层增重16.20%,控释层增重22.84%,致孔剂用量5.52%。
2.5 药物2的体外释放影响因素
2.5.1 包衣膜增重对药物释放的影响 在预试验基础上,固定包衣液中Eudragit NE30D为10%(w/w),分别制备包衣增重为5%、10%、15% 的缓释微丸,40 ℃干燥12 h 后考察其体外释药情况,结果见图5。
由图5可见,随着包衣增重的增加,药物释放减慢,当包衣增质量过大时,药物释放不完全,但当包衣增质量较小时,药物释放过快,达不到缓释效果。
2.5.2 包衣液浓度对药物释放的影响 Eudragit NE30D水分散体中聚合物的浓度为30 %(w/w),将其稀释成含聚合物分别为6 %、10%、15 %不同浓度的包衣液, 分别对同一批氢氯噻嗪含药微丸进行包衣,并使包衣增重相同,测定其体外释放度,释放情况见图6。

图5 不同包衣增重对微丸释放的影响(n=3)

图6 不同包衣液浓度对HCTZ缓释微丸释放的影响(n=3)
结果显示在包衣增重相同的条件下, 用不同聚合物浓度的包衣液制得的包衣微丸,释放度没有显著差异,浓度过大时,包衣过程粘连严重,衣膜不均匀;浓度过稀,包衣耗时过长,综合考虑,本文选择聚合物浓度稀释为10%。
2.5.3 滑石粉用量的影响 在包衣过程粘连现象较严重,滑石粉对其有较好的抗粘结作用,分别将占包衣液聚合物量的30%,40%,50%滑石粉加入到包衣液中,考察对包衣效果和药物溶出度的影响,释放结果见图7。

图7 不同用量的滑石粉对HCTZ缓释微丸释放的影响(n=3)
结果表明,当滑石粉用量为聚合物量的30%时,包衣过程发生一定程度的粘连,包衣膜不均匀,当滑石粉用量增加到40%和50%时,包衣过程未发生粘连,形成的衣膜光滑完整,滑石粉用量选择占包衣液处方中聚合物量的40%。
2.5.4 致孔剂种类及用量对药物释放的影响 分别考察乳糖、Nacl、聚乙二醇6000 ( PEG6000) 、羟丙基甲基纤维素( HPMC) 为致孔剂对微丸释药的影响,释放度测定结果表明,乳糖作为致孔剂释药较平稳,其余3 种均有不同程度的突释,故选择乳糖作为致孔剂。在预试验基础上,乳糖加入量分别为包衣液聚合物的1.0% 、1.5% 、2.0% ,释放情况见图8。
结果表明,随着乳糖加入量的增加,微丸的释药速率加快。
2.5.5 后处理时间(熟化处理)对药物释放的影响 于40 ℃,分别将微丸热处理0,6,12,18 h,24 h,测定药物释放度,测定结果见图9。
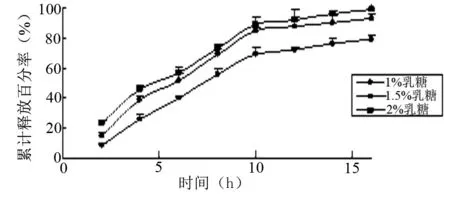
图8 不同用量乳糖剂对微丸释放的影响(n=3)

图9 不同后处理时间对微丸释放的影响(n=3)
结果表明,随着熟化处理时间的延长,微丸释药速率趋于减慢,处理时间超过12 h 后,随时间的延长,微丸释药曲线相似因子f2均大于50,无显著性变化。
2.5.6 处方优化 通过对处方工艺因素考察,选取对微丸释放影响较大的三个因素即缓释层增重、致孔剂用量、后处理时间进行三因素三水平正交设计优化处方。得到最佳处方为:缓释层增重为10%,致孔剂乳糖用量为1.5%(聚合物的1.5%),后处理时间为12 h,结果制备的氢氯噻嗪缓释微丸符合设计要求,重现性良好。
2.6 复方脉冲缓释微丸释药机制拟合
膜控微丸由于包衣膜的组成和药物在丸芯中状态的不同,往往会导致药物的释放呈现多种释药机制。本实验采用零级动力学、一级动力学、Higuchi方程对两种药物的释放曲线进行拟合。本实验对微丸时滞后累积释放百分数-时间数据进行线性方程拟合,拟合结果见表1、表2。

表1 卡托普利脉冲微丸释药模型拟合

表2 氢氯噻嗪缓释微丸释药模型拟合
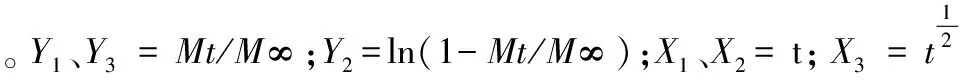
由表可看出,两种微丸释放均符合一级方程,可采用First-order方程来表征微丸释药动力学特征。
3 讨论
微丸是一种多单元型给药系统,与一单元型给药系统相比有减少或消除药物不良反应、吸收过程不受食物输送节律的影响、药物吸收及释药动力学重现性好等优点,本实验成功制备了复方脉冲微丸,且工艺简便。
底喷式流化包衣时容易出现静电、粘连等现象,本实验研究过程中,由于L-HPC分散性不好,包衣操作时管道中易沉降,流化包衣时不易黏附在药丸上,包衣效率低,试验中加入粘合剂,可有效改善包衣性能。水分散体Eudragit NE30D易成膜,但操作时易粘连,既严重影响包衣进程,又导致衣膜不均匀,试验中加入抗粘剂,消除了粘连状况,使包衣过程顺利。
Surelease水分散体的具有极好的成膜性,通过加入合适的致孔剂及用量,在膜的表面形成孔道,有助于药物的脉冲释放。
我们试验制备的微丸体外释放时滞约为5 h,适于睡前服用,于次日凌晨3:00左右(此时人体血压升高较快,也是最佳的服药时间[8])开始释放药物,在血压达到高峰时,药物亦达到最大血药浓度,有效的预防和控制血压的升高,降低脑梗死等病情的发生率。
参考文献:
[1] 钟明康, 施孝金, 王宏图, 等. 复方卡托普利片中卡托普利在人体内的药物动力学[J]. 中国医院药学杂志,1997,17(8):339-341.
[2] 郭涛. 介绍几种定时释药系统研究近况[J] . 中国药师,1999,2 (5):236-238.
[3] Pazzi F, Furlani P, Gazzaniga A, et al. The time clock system: a new oral dosage form for fast and complete release of drug after a predetermined lag time[J].J Controlled Release,1994,31(1):99-108.
[4] KrêgelI, Bodmeier R. Floating or pulsatile drug delivery systems based on coated effervescent cores [J] . Int J Pharm,1999,18(7):175-184.
[5] Schmltz P , Kleinebudde P. A new multiparticulate delayed release system. Part Ⅰ:Dissolution properties and release mechanism [J] . J Controlled Release, 1997,47(2):181-190.
[6] Satoshi UDEA,Hisani Y,M asateru K,et al.Development of novel drug release system,time-controlled explosion system(TES).Ⅱ.Design of multiparticulate TES and in vitro drug release properties[J].Chem Pharm Bull,1994(42):359-363.
[7] 陈胜君,朱家壁.缓控释微丸制剂的研究进展[J].国外医学:药学分册,2004,31(3):177-181.
[8] 陈艺娟,涂秋榕.脉冲释放系统在防治心血管疾病方面的应用[J].海峡药学,2004,16(4):148-149.

