姜黄素对糖尿病大鼠心肌的保护作用*
刘忠和, 余 薇, 刘 超, 吴基良
(1咸宁市中医院内科, 2湖北科技学院糖尿病心脑血管病变湖北省重点实验室, 湖北 咸宁 437100)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是由糖尿病引起的一种心脏结构和功能障碍,独立于高血压、冠状动脉粥样硬化性心脏病、心脏瓣膜病及其它已知心脏疾病[1]。DCM引起舒张期和(或)收缩期心功能改变,最终可能引发心肌缺血和心衰,成为糖尿病患者的重要致死原因之一。DCM的发病机理目前尚不完全清楚,心肌细胞糖脂代谢紊乱、炎症、氧化应激、心肌纤维化、心肌细胞凋亡以及线粒体损伤被认为是DCM发生和发展的可能机制[2]。姜黄素(curcumin,Cur)是从姜科植物中提取的一种黄色酚类化合物,现代药理学研究表明姜黄素能通过疏水性作用同血浆白蛋白结合运输,易于渗透细胞质,富集于膜性结构如质膜、内质网和核膜,发挥抗氧化、抗肿瘤、抗炎、降血脂和抗微生物等药理作用[3]。为此,本研究通过复制2型糖尿病大鼠模型,探讨姜黄素对大鼠糖尿病心肌病的保护作用及可能机制。
材 料 和 方 法
1 仪器与试剂
血糖测试仪(长沙三诺生物传感技术股份有限公司);pH计(Mettler Toledo公司);3-18K高速冷冻离心机(Sigma);自动发光凝胶成像系统(Syngene)。
姜黄素(陕西森弗生物技术有限公司);链脲佐菌素 (streptozotocin,STZ;Sigma);谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测试盒和丙二醛(malondialdehyde,MDA)测试盒(南京建成研究所);心肌钙蛋白I(cardiac troponin I,cTnI)酶联免疫吸附测定试剂盒(武汉优尔生科技股份有限公司);β-actin和蛋白激酶C(protein kinase C,PKC)α抗体(Santa Cruz);其余均为进口或者国产分析纯化学试剂。
2 动物分组及给药
雄性SPF级Wistar大鼠,体重70~90 g[湖南省实验动物中心(SCXK 2009-0012)]。适应性喂养1 周,动物饲养在温度控制在(22±2)℃、湿度为40%的SPF级动物房,并保持12 h的昼夜节律和自由进食进水。实验方案经过华中科技大学同济医学院动物伦理委员会批准,批准号为2011-S238。
适应性喂养1周后,动物随机分为正常对照组(control组,n=10)和糖尿病模型组(n=65)。正常对照组大鼠给予标准普通饲料喂养,糖尿病模型组大鼠以高糖高脂饲料(在普通饲料的基础上加入20%蔗糖和20%猪油)喂养。饲养8 周后,禁食12 h,糖尿病模型组大鼠一次性腹腔注射小剂量STZ 40 mg/kg,用pH 4.4的柠檬酸-柠檬酸钠缓冲液溶解配制),正常对照组大鼠腹腔注射等容量柠檬酸-柠檬酸钠缓冲液。STZ腹腔注射3 d和7 d后,禁食12 h,鼠尾取血测定空腹血糖。糖尿病模型成功大鼠诊断标准为:连续2次空腹血糖 ≥11.6 mmol/L,未达成模标准者剔除。糖尿病模型成功大鼠随机分为DCM组 (n=20)、Cur小剂量治疗组(DCM+Cur 100 mg/kg组,n=12)和Cur大剂量治疗组(DCM+Cur 200 mg/kg组,n=12)。Cur小剂量和大剂量组每日分别经口灌胃(ig)Cur 100 mg/kg和200 mg/kg。正常对照组和DCM组大鼠每日ig等容量羟甲基纤维素钠。继续原饲料喂养16周,每2周禁食12 h,鼠尾取血检测空腹血糖1次。实验期间动物自由进水,未使用胰岛素及其它降糖药物。
3 主要方法
3.1血清中cTnI含量测定 实验末,腹主动脉取血,3 000 r/min离心10 min,取上清,按照酶联免疫分析法检测cTnI含量。
3.2心肌组织中MDA含量和GSH-Px活力测定 药物治疗16周后取出心脏,制备成心脏匀浆,提取上清,按照试剂盒相关程序操作。
3.3Western blotting检测心肌组织中PKC表达 取100 mg左心室组织置于EP管中,按照体重∶体积=1∶9的比例加入900 μL组织裂解液,冰上匀浆后,13 000 r/min、4 ℃离心15 min后,取上清液,按BCA法测定蛋白浓度。用微量进样器上样后,浓缩胶电泳电压为80 V,分离胶电泳电压为100~120 V电泳,至溴酚蓝到凝胶底部。用湿转法将蛋白质从凝胶转移至PVDF膜后5%脱脂牛奶室温封闭。加入用TBST适当稀释的Ⅰ抗PKCα(1∶200)和β-actin(1∶500),置于4 ℃冰箱过夜后,加入HRP标记的羊抗兔的IgG抗体(1∶5 000)室温孵育1 h。TBST漂洗后,加入ECL荧光液,用SYNGENE自动发光凝胶成像系统检测目的蛋白表达情况。
4 统计学处理
数据以均数±标准误(mean±SEM)表示,用SPSS 11.5统计学软件分析,行One-way ANOVA检验,以P<0.05为差异有统计学意义。
结 果
1 实验动物的基本情况
整个实验期间,正常对照组大鼠毛色光白,活泼易动,双眼灵活有神;糖尿病组大鼠毛色逐渐失去光泽直至灰暗,消瘦,精神萎靡,行动迟缓,部分大鼠出现烂尾现象,其中有3只出现糖尿病性白内障。Cur大剂量治疗组大鼠毛色有光泽,对周围变化反应灵敏,精神状态较糖尿病组明显好转。
2 动物体重的变化
注射STZ之前,4组之间比较体重无显著差异(P>0.05)。注射STZ后1周即药物治疗前,与正常对照组比较,各造模组大鼠体重开始下降,显著差异(P<0.05)。实验末,与正常对照组相比,糖尿病大鼠体重均下降明显(P<0.05)。但与糖尿病组比较,Cur大剂量治疗组大鼠体重显著升高(P<0.05),见图1。
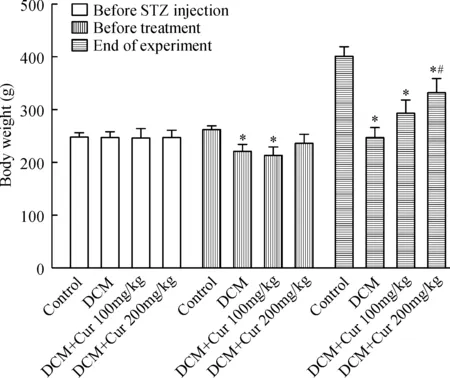
Figure 1. Effect of curcumin (Cur) on body weight of STZ-induced diabetic rats.Mean±SEM.n=8~12.*P<0.05 vs control group; #P<0.05 vs DCM group.
3 动物血糖的变化
如图2所示,注射STZ之前,4组之间比较空腹血糖无显著差异(P>0.05)。注射STZ后1周即药物治疗前,糖尿病模型成功大鼠空腹血糖较正常对照组大鼠均明显升高(P<0.05)。实验末,糖尿病组大鼠空腹血糖呈持续性升高,与正常对照组比较明显增高(P<0.05),而Cur各治疗组空腹血糖较糖尿病组显著降低(P<0.05)。
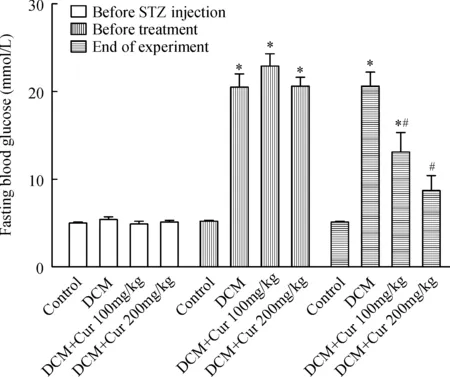
Figure 2. Effect of curcumin (Cur) on fasting blood glucose in STZ-induced diabetic rats.Mean±SEM.n=8~12.*P<0.05 vs control group; #P<0.05 vs DCM group.
4 心肌组织中GSH-Px活性以及MDA含量的变化
与正常对照组比较,糖尿病组GSH-Px活性显著下降,而MDA含量显著升高(P<0.05)。Cur治疗后可呈剂量依赖性地升高心肌GSH-Px活性,同时降低MDA含量(P<0.05),见表1。
5 血清中cTnI含量的变化
与正常对照组比较,糖尿病组大鼠血清中cTnI含量显著升高(P<0.05),Cur可显著降低糖尿病大鼠血清cTnI的含量(P<0.05),见表1。

表1 Cur对STZ所诱导的糖尿病大鼠cTnI、MDA含量以及GSH-Px活力的影响
6 心肌组织中PKC的变化
如图3所示,与正常对照组比较,糖尿病组大鼠心肌组织中PKCα表达显著增加,而Cur大剂量治疗组可逆转糖耐所致的PKCα表达增加(P<0.05)。
讨 论
在本实验中,我们首次选择70~90 g左右的Wistar大鼠给予高糖高脂饮食8周造成胰岛素抵抗后,小剂量STZ(40 mg/kg)一次性腹腔注射,成功地复制出2型糖尿病大鼠模型。我们采用的糖尿病大鼠诊断标准为连续2次测定空腹血糖≥11.6 mmol/L为模型成功大鼠。糖尿病大鼠在给予STZ腹腔注射72 h后空腹血糖开始增加,并在随后的整个实验过程中呈现出持续的高血糖,表现出高血糖所致的葡萄糖代谢紊乱。糖尿病大鼠经过姜黄素治疗后可显著降低动物空腹血糖,改善动物的体重减轻的症状。
肌钙蛋白(troponin,Tn)是横纹肌收缩的重要调节蛋白,由肌钙蛋白C(TnC)、肌钙蛋白T(TnT)和肌钙蛋白I(TnI)3个亚基组成。TnI也有3种亚型:快骨骼肌亚型、慢骨骼肌亚型和心肌亚型。cTnI仅存于心肌细胞中,为心肌特异型的肌钙蛋白,参与钙离子诱导的肌肉收缩,其敏感性和特异性比CK-MB高,是高度特异和灵敏的反映心肌细胞损伤坏死的标志物[4]。有文献报道,糖尿病大鼠6周即出现糖尿病性心肌损伤。在本研究中,我们观察到糖尿病大鼠血清cTnI的释放明显增加,而姜黄素可逆转cTnI水平改变,表明姜黄素可抑制糖尿病所致的心肌损伤。

Figure 3. Curcumin (Cur) decreased PKCα expression in the rat hearts with STZ-induced diabetic cardiomyopathy.Mean±SEM.n=3.*P<0.05 vs control group; #P<0.05 vs DCM group.
正常情况下活性氧簇(reactive oxygen species,ROS)能被体内的抗氧化酶系统如SOD、GSH-Px等和非酶系统如维生素E和维生素C清除,使体内氧化系统和抗氧化系统处于动态平衡中,维持细胞内ROS处于稳定水平[5]。然而,糖尿病时ROS还可通过脂质β氧化、葡萄糖自身氧化代谢等多种途径产生,因此糖尿病时心肌可产生更多ROS从而造成细胞DNA损伤和细胞凋亡[6]。测定MDA含量的变化以及抗氧化酶GSH-Px活力可反映心肌细胞脂质过氧化程度。据报道Cur具有较强的抗氧化能力,几乎是天然抗氧化剂维生素E的10倍左右[7]。实验中我们发现糖尿病大鼠心肌组织GSH-Px活力显著降低而MDA含量显著增高,给予Cur治疗后心肌GSH-Px活力显著升高,而脂质代谢产物MDA显著下降,表明Cur具有较强的抗氧化能力。
PKC是一种钙、磷脂依赖性蛋白磷酸化酶,具有多种亚型,在静息状态下主要以无活性的形式存在于胞浆中,是细胞内信息传递的重要分子[8]。当体内氧化应激增强时,活化的PKC通过使心肌Na+-K+-ATP酶、肌钙蛋白、微管蛋白等底物蛋白磷酸化,进而抑制肌原纤维ATP酶的活性,从而影响心肌收缩力和舒张功能[9]。在本研究中我们观察到糖尿病大鼠心肌组织中PKCα的表达明显增加,而Cur治疗后可显著减少心肌PKCα的表达。
综上所述,Cur对2型糖尿病大鼠心肌病具有保护作用,其机制可能与抑制氧化应激、下调心肌PKCα表达有关,本研究为寻求开发新的抗糖尿病心肌病的药物提供了新的思路。
[参 考 文 献]
[1] Tarquini R, Lazzeri C, Pala L, et al. The diabetic cardiomyopathy[J]. Acta Diabetol, 2011, 48(3):173-181.
[2] Khavandi K, Khavandi A, Asghar O, et al. Diabetic cardiomyopathy: a distinct disease?[J]. Best Pract Res Clin Endocrinol Metab, 2009, 23(3):347-360.
[3] Shehzad A, Ha T, Subhan F, et al. New mechanisms and the anti-inflammatory role of curcumin in obesity and obesity-related metabolic diseases[J]. Eur J Nutr, 2011,50(3):151-161.
[4] Ahmad F, Banerjee SK, Lage ML, et al. The role of cardiac troponin T quantity and function in cardiac development and dilated cardiomyopathy[J]. PLoS One, 2008, 3(7):e2642.
[5] Sadi G, Guray T. Gene expressions of Mn-SOD and GPx-1 in streptozotocin-induced diabetes: effect of antioxidants[J]. Mol Cell Biochem, 2009, 327(1-2):127-134.
[6] Wang J, Wang H, Hao P, et al. Inhibition of aldehyde dehydrogenase 2 by oxidative stress is associated with cardiac dysfunction in diabetic rats[J]. Mol Med, 2011, 17(3-4):172-179.
[7] Pandya U, Saini MK, Jin GF, et al. Dietary curcumin prevents ocular toxicity of naphthalene in rats[J]. Toxicol Lett, 2000, 115(3):195-204.
[8] 柴大军,宁若冰,祝 江,等.阿托伐他汀通过抑制PKC的激活对抗高糖诱导的人脐静脉内皮细胞氧化应激反应[J]. 中国病理生理杂志, 2012, 28(9):1537-1542.
[9] Kooij V, Zhang P, Piersma SR, et al. PKCα-specific phosphorylation of the troponin complex in human myocardium: a functional and proteomics analysis[J]. PLoS One, 2013, 8(10):e74847.

