上/下调miR-21对结肠癌细胞的生物学作用及对西妥昔单抗药物敏感性的影响*
巩 波, 李东风, 谢子钧, 段伊帆, 李子俊△
(1南方医科大学,广东 广州 510515;广东省人民医院, 广东省医学科学院 2消化科, 3医学研究中心,广东 广州 510080)
在美国和大部分欧洲国家,结直肠癌是第3位常见的恶性肿瘤,与肿瘤相关的死亡原因排第2位,在这些病人中,大约有20%的病人在获得临床诊断时已发生转移[1]。西妥昔单抗靶向表皮生长因子受体(epidermal growth factor receptor, EGFR),抑制细胞的生长、增殖和转移,已被美国FDA批准用于KRAS野生型结直肠癌的治疗[2]。但是并非所有KRAS野生型结直肠癌都能从西妥昔单抗治疗中获益,据报道在占结直肠癌60%~70% 的KRAS野生型中,只有其中60%获得治疗反应,余下40% KRAS野生型结直肠癌治疗无效或耐药[3]。而迄今研究表明miR-21在人体31种肿瘤中表达异常,也是最常见的异常microRNA之一,是一种致癌性microRNA, 在多种肿瘤的发生和发展中起着重要的作用。本实验通过体外实验上调/下调miR-21,探讨其对人结肠癌细胞RKO的增殖、克隆形成能力及对西妥昔单抗敏感性的影响,为下一步体内实验和临床研究提供依据。
材 料 和 方 法
1 细胞
人结肠癌细胞株RKO(购自中国科学院上海细胞研究所)使用MEM Alpha培养基(Life Technologies)加10%胎牛血清(Life Technologies),5% CO2、37 ℃培养。
2 方法
2.1慢病毒载体的构建 根据人miR-21的基因序列,制备上调/下调miR-21双链DNA Oligo,设计包含目的基因序列和酶切位点的互补序列,LV-miR-21上游引物5’-CGGCCGCGACTCTAGTTATCAAATCCTGCCTGACTG-3’,下游引物5’- ATAAGCTTGATATCG-TCCTCCCTCCATACTGCTG-3’;LV-anti-miR-21上游引物5’-CCGGTCAACATCAGTCTGATAAGCTATTTTTG-3’,下游引物5’-AATTCAAAAATAGCTTATCAGACTGATGTTGA-3’。将引物退火形成带黏性末端的双链DNA,利用T4 DNA ligase分别连接到GV217和GV159载体上,转化感受态细菌,挑选转化的菌落,用菌落PCR进行鉴定和测序。
2.2慢病毒载体的包装 取生长状态良好的293T细胞消化重悬后按1∶5比例传至poly-(D-lysine)(PDL)包被的10 cm皿中,加完全培养基37 ℃、5% CO2细胞培养箱中继续培养约24 h,细胞密度达50%~70%时即可用于转染。取1.5 mL/dish Opti-MEM、表达质粒6 μg/dish、包装质粒Packaging Mix 6 μg/dish,混匀,室温下温育5 min;取1.5 mL/dish Opti-MEM和POLOdeli-vererTM3000 Transfection reagent 24 μL/dish,轻轻混匀,室温下温育5 min。将两者混合,室温下孵育20 min。将DNA与POLOdelivererTM3000 Transfection reagent 的复合液均匀地滴加在293T细胞的培养液中混匀,于37 ℃、5% CO2细胞培养箱中培养,48 h后荧光显微镜观察转染效率,收集293T细胞上清液,4 ℃暂存;细胞更换新鲜完全培养基后继续培养至72 h,收集病毒上清,与第1次收集的混合,于 4 ℃、3 000 r/min 离心10 min,用0.45 μm 醋酸纤维素膜的滤器过滤于Beckman SW28离心管中,每管装36 mL病毒,4 ℃、22 000 r/min 离心2 h,弃上清,每管用130 μL预冷的PBS溶解沉淀,每管100 μL分装,-80 ℃保存。
2.3慢病毒滴度测定 测定前1 d,取测定滴度所需的293T细胞,每孔加100 μL,4×104个细胞接种到96孔板,根据病毒的预期滴度,准备7~10个无菌的EP 管,在每个管中加入 90 μL 的无血清培养基,将待测定的病毒原液 10 μL 加入到第1个管中,混匀后,取 10 μL 加入到第2个管中,继续相同的操作直到最后1管。选取所需的细胞孔,吸去 90 μL 培养基,丢弃,加入 90 μL 稀释好的病毒溶液,放入培养箱培养,24 h后,加入完全培养基 100 μL。4 d 后,观察荧光表达情况。病毒滴度=阳性细胞数×计量孔稀释倍数/接种病毒体积。
2.4细胞感染 取生长状态良好的RKO细胞,胰酶消化后用全培养基重悬细胞,每孔2×105个细胞接种到6孔板,37 ℃、5% CO2细胞培养箱中继续培养约24 h。取6孔板中的一孔细胞进行消化,计数细胞,根据MOI和细胞数量计算所需要的病毒量稀释到培养基中;吸去旧培养基,加入含病毒液的培养基,同时设置阴性对照空载体组和空白对照组,12 h后换液,继续培养72 h后在荧光显微镜下观察荧光表达情况,初步估计慢病毒感染效率。
2.5qRT-PCR检测miR-21的表达 收集上调/下调miR-21、阴性对照及空白对照的RKO细胞,采用Trizol法提取细胞总RNA并测定总RNA的浓度及纯度。根据逆转录试剂盒ReverTra Ace qPCR RT Kit(Toyobo)合成cDNA,反应条件为37 ℃ 15 min,98 ℃ 5 min,4 ℃终止。取逆转录产物作为模板,用Realtime PCR Master Mix(SYBR Green)试剂盒(Toyobo)进行qRT-PCR检测,以U6为内参照,反应条件为95 ℃ 30 s, 然后95 ℃ 10 s, 60 ℃ 20 s,72 ℃ 30 s,45个循环,每个样品设置4个复孔。采用Lightcycle罗式荧光定量PCR仪进行检测。采用2-ΔΔCt法对数据进行分析。
2.6细胞增殖实验 取对数生长期的上调/下调miR-21、阴性对照及空白对照的RKO细胞,胰酶消化,细胞计数后按照每孔1×104个细胞接种到96孔板,每组设置6个复孔,与实验孔平行设不加细胞只加培养液的空白对照孔,分别接种4块板,于培养后24 h、48 h、72 h和96 h分别加入MTT溶液(5 g/L)20 μL/well,37 ℃继续孵育4 h,终止培养,小心吸弃孔内培养上清液。每孔加入150 μL DMSO,振荡10 min,使结晶物充分溶解;于490 nm波长处测定A值。
2.7克隆形成实验 配置1.2%和0.7%无菌低熔点琼脂液体,40 ℃维持,使之保持溶解状态。按1∶1混合1.2%琼脂糖和2×完全培养基,按每孔取2 mL混合液注入6孔板中,待冷却凝固,备用。收集对数生长期的上调/下调miR-21、阴性对照及空白对照的RKO细胞,制成1×107/L的细胞悬液;按1∶1比例将0.7%琼脂和2×完全培养基在无菌试管中混合后,取1 mL混合液+0.1 mL单细胞悬液(1×103cells/well),充分混匀、注入已铺有底层琼脂的培养板中,在室温放置20 min使细胞琼脂悬液凝固。将6孔板置于CO2培养箱中37 ℃进行培养。培养10 d,观察细胞克隆形成情况并计数。
2.8凋亡实验 胰酶消化上调/下调miR-21、阴性对照及空白对照的RKO细胞,分别收集(1~5)×105细胞。在50 μL binding buffer中加入5 μL 7-AAD染液,混匀;收集细胞中加入上述7-AAD染液,混匀,室温避光反应5~15 min;再加入450 μL binding buffer混匀后加入1 μL Annexin V-PE混匀,室温避光反应5~15 min;1 h内流式细胞术检测。
2.9西妥昔单抗敏感性检测 取对数生长期的上调/下调miR-21、阴性对照及空白对照的RKO细胞,胰酶消化,细胞计数后按照每孔1×104个细胞接种到96孔板,24 h后,加入300 mg/L的西妥昔单抗,不同细胞设3复孔,继续培养24 h后,弃培养液,每孔加入100 μL无血清培养基及10 μL CCK-8,继续培养,每30 min在波长450 nm测定吸光度A值,直至未加药孔的A值为1.0~1.2时为最佳时间。细胞抑制率=(实验孔A值-空白孔A值)/(未加药孔A值-空白孔A值)×100%。
3 统计学处理
使用SPSS 13.0 软件分析。数据以均数±标准差(mean±SD)表示,采用单因素方差分析或重复测量资料的方差分析比较转染不同慢病毒的细胞间miR-21的表达、细胞增殖能力、克隆形成能力、细胞凋亡、药物敏感性等的差异,以P<0.05为差异有统计学意义。
结 果
1 重组慢病毒的包装与转染
将构建好的慢病毒干扰质粒转染到293T细胞中,包装产生重组慢病毒颗粒,通过观察绿色荧光,可见90%以上的细胞带有绿色荧光,见图1。收集浓缩病毒颗粒后测定LV-miR-21与LV-anti-miR-21的滴度分别为3.0×1012TU/L和2.0×1012TU/L,将病毒颗粒分别感染人结肠癌RKO细胞,观察绿色荧光,感染效率在80%以上,见图2。

Figure 1. 293T cells transfected with the lentivirus interference plasmids(×100). A,B: LV-miR-21; C,D: LV-anti-miR-21.A,C:fluorescence view; B,D: phase-contrast view.

Figure 2. RKO cells transfected with different lentiviral vectors(×100). A1, A2: LV-miR-21; B1, B2: LV-miR-21 NC; C1,C2: LV-anti-miR-21; D1, D2: LV-anti-miR-21 NC.A1,B1,C1,D1: fluorescence view; A2,B2,C2,D2: phase-contrast view.
2 qRT-PCR检测结肠癌细胞RKO转染慢病毒干扰载体后miR-21的表达
转染LV-miR-21、LV-anti-miR-21、相应阴性对照载体和空白组的miR-21相对表达量分别为9.45±0.56、0.55±0.13、1.17±0.10、1.11±0.09和1.00±0.00,其中LV-miR-21组的表达量高于其阴性对照组及空白组,差异有统计学意义(P<0.05);LV-anti-miR-21组的表达量低于其阴性对照组及空白组,差异有统计学意义(P<0.05),而阴性对照组与空白组的表达量之间无明显差异(P>0.05),见图3。
3 MTT检测人结肠癌细胞转染不同慢病毒后细胞增殖能力的变化
MTT实验结果表明转染LV-anti-miR-21后,随着时间的增长,细胞的增殖能力明显降低;转染LV-miR-21后,随着时间的增长,细胞的增殖能力明显增强。在第2天、3天和4天,LV-miR-21组、LV-anti-miR-21组和空白组之间细胞增殖能力有明显差异(P<0.01),见图4。
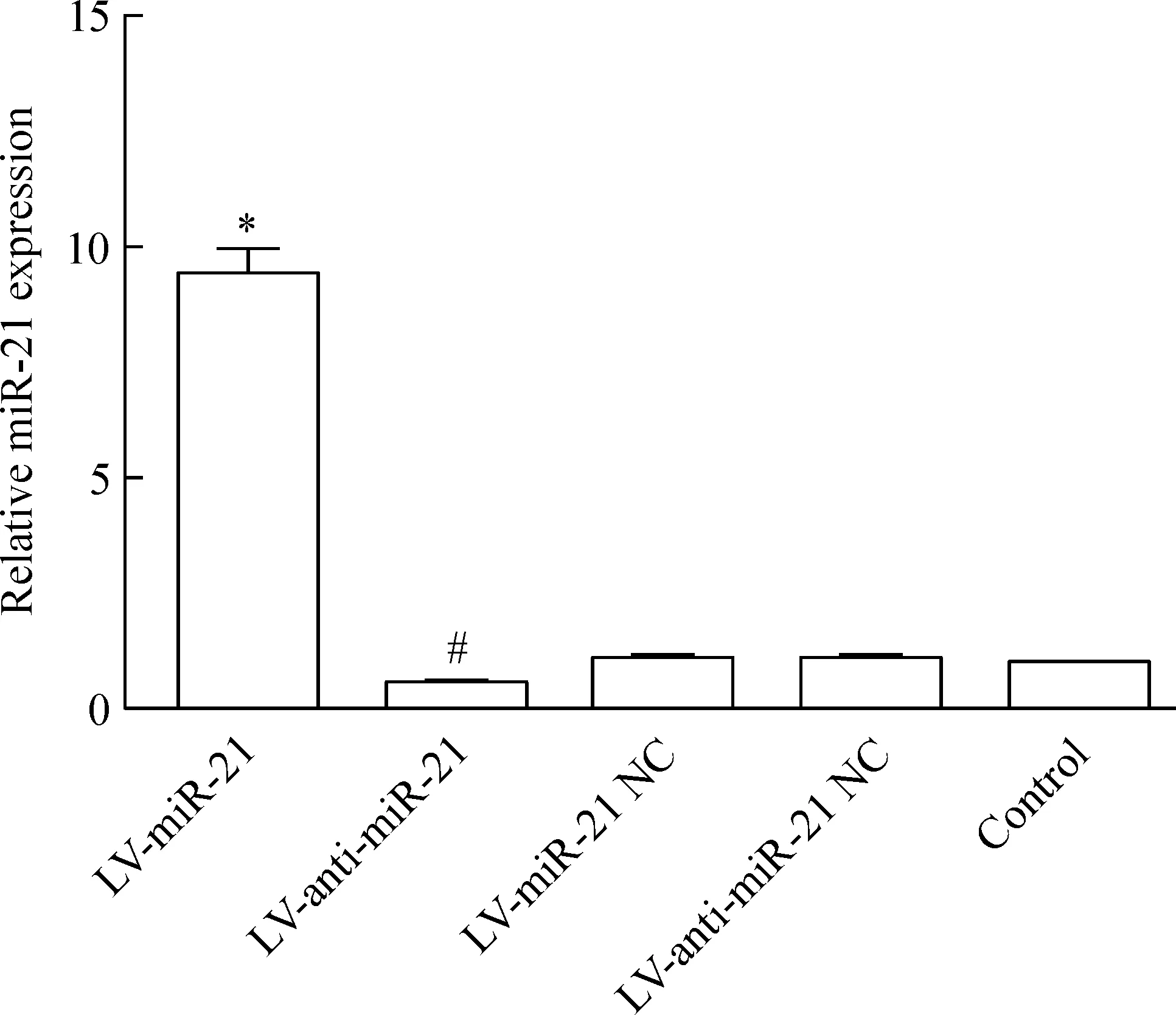
Figure 3. Expression of miR-21 in transfected RKO cells.Mean±SD.n=4. *P<0.05 vs LV-anti-miR-21, LV-miR-21 NC or control; #P<0.05 vs LV-miR-21 or LV-anti-miR-21 NC.
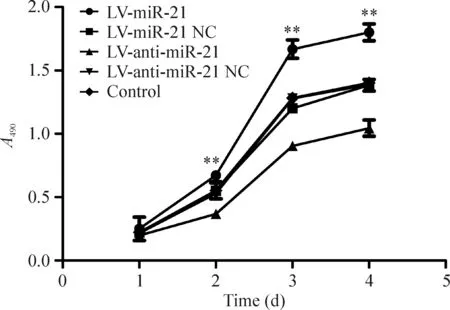
Figure 4. Proliferation of RKO cells with different treatments.Mean±SD.n=6.**P<0.01 vs LV-anti-miR-21.
4 转染不同慢病毒后克隆形成能力的变化
LV-miR-21组的细胞克隆形成能力明显高于其阴性对照组、空白组和LV-anti-miR-21组(P<0.01);而LV-anti-miR-21组的细胞克隆形成能力低于其阴性对照组和空白组(P<0.01),见图5。
5 转染不同慢病毒后细胞凋亡的变化
LV-anti-miR-21组的早期凋亡率明显高于LV-miR-21组(P<0.01),见图6。这说明下调miR-21可以促进细胞的凋亡。
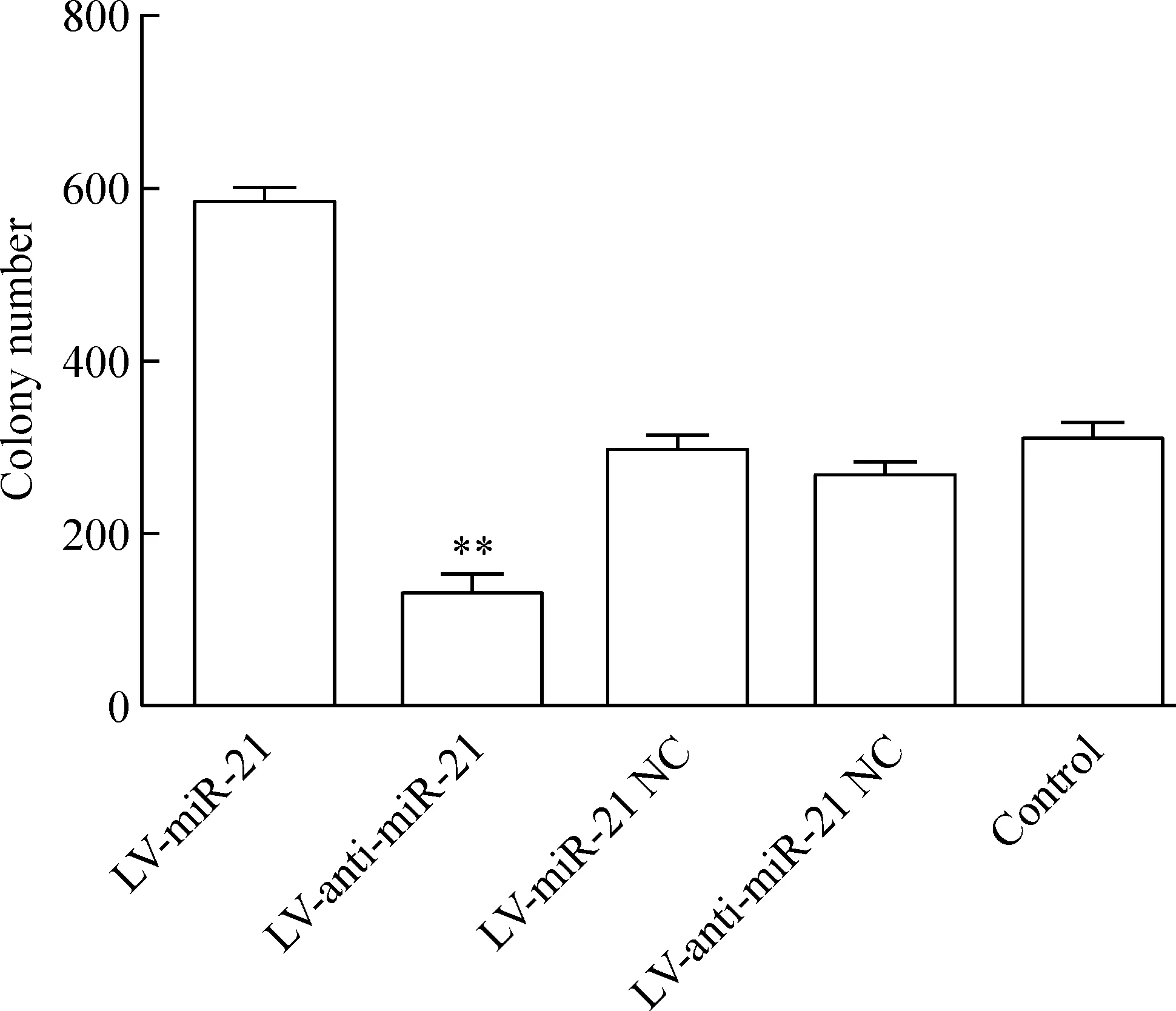
Figure 5. Colony-forming ability of the RKO cells with different treatments.Mean±SD.n=3.**P<0.01 vs LV-miR-21.
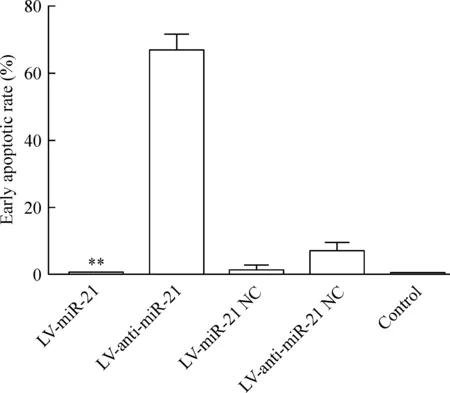
Figure 6. The early apoptotic rate of the RKO cells with different treatments.Mean±SD.n=3.**P<0.01 vs LV-anti-miR-21.
6 下调miR-21可增强肿瘤细胞对靶向治疗药物西妥昔单抗的敏感性
在300 mg/L西妥昔单抗作用下,LV-anti-miR-21组的细胞抑制率高于LV-miR-21组,差异有统计学意义(P<0.05),见图7。
讨 论
MicroRNA是一类内源性非编码小分子单链RNA,能够调控mRNA的表达或翻译, 在生物体的发育、增殖、分化及凋亡等方面发挥重要的生理作用[4]。近年来, 越来越多的研究表明, 许多micro-RNA可作为原癌基因或者抑癌基因, 在肿瘤的发生和发展中扮演着重要的角色。目前发现,食管癌、胃癌、肝癌、胰腺癌、胆管癌、结直肠癌等肿瘤中miR-21的水平明显上调。miR-21在众多肿瘤中呈现出癌基因样的作用,在肿瘤的发生发展、增殖、凋亡、侵袭、转移等多种生物学行为中发挥着重要的作用。在结肠癌的研究中,Schetter等[5]检测了84 例结肠癌组织及其癌旁正常组织的microRNA表达谱,发现有37个microRNA表达存在差异, 其中miR-21在癌组织中表达显著上调, 证实miR-21与结肠癌的发生密切相关。也有研究发现miR-21在乳腺癌组织中表达显著上调,其表达上调水平与乳腺癌临床分期、淋巴结转移及预后相关[6]。许多研究表明,microRNA具有调节下游靶基因表达的作用。在大多肿瘤中高表达的miR-21很可能是通过调节增殖、凋亡相关基因的表达而发挥促进肿瘤发生发展的作用。Park等[7]研究发现,低浓度的miR-21反义引物的核苷酸显著抑制胰腺癌细胞株的增殖,抑制miR-21表达可使胰腺癌细胞株HS766T的凋亡增加3~6倍。我们的研究表明下调miR-21能够明显抑制结肠癌细胞对增殖及克隆形成能力等。

Figure 7. The inhibitory rate of cetuximab (300 mg/L) on the RKO cells with different treatments.Mean±SD.n=3. *P<0.05 vs LV-anti-miR-21.
此外,miR-21在肿瘤药物的耐药性方面也有重要作用[8]。目前研究认为miR-21调控肿瘤细胞对多种药物敏感性的机制主要与miR-21参与调控细胞周期、抑制细胞凋亡有关。最初由Meng等[9]关于microRNA与化疗药物敏感性的研究发现,抑制miR-21的表达能够增加胆管癌细胞对吉西他滨的敏感性。深入研究机制,还发现miR-21通过激活PTEN依赖的PI3K信号通路从而调节吉西他滨介导的细胞凋亡,说明miR-21在调节肿瘤细胞化疗敏感性方面有重要作用。Park等[7]也发现反义miR-21能够增强吉西他滨的敏感性。我们通过上调/下调人结肠癌细胞RKO的miR-21表达水平,分析了miR-21对RKO细胞增殖、凋亡、克隆形成能力及对西妥昔单抗敏感性的影响,发现下调miR-21能够抑制肿瘤细胞的增殖及克隆,增加肿瘤细胞对西妥昔单抗药物的敏感性。这些结果表明miR-21的高表达可作为结直肠癌的分子标记物,下调miR-21的表达,在结直肠癌等肿瘤治疗中有应用前景,值得深入研究和验证。
[参 考 文 献]
[1] Lamas MJ, Duran G, Gallardo E. Anti-EGFR therapy in first-line colorectal cancer[J]. Expert Rev Anticancer Ther, 2011, 11(10):1499-1503.
[2] Adelstein BA, Dobbins TA, Harris CA, et al. A systematic review and meta-analysis of KRAS status as the determinant of response to anti-EGFR antibodies and the impact of partner chemotherapy in metastatic colorectal cancer[J]. Eur J Cancer, 2011, 47(9):1343-1354.
[3] García-Sáenz JA, Sastre J, Díaz-Rubio García E. Biomarkers and anti-EGFR therapies for KRAS wild-type metastatic colorectal cancer[J]. Clin Transl Oncol, 2009, 11(11):737-747.
[4] Fujita S, Ito T, Mizutani T, et al. miR-21 gene expression triggered by AP-1 is sustained through a double-negative feedback mechanism[J]. J Mol Biol, 2008, 378(3):492-504.
[5] Schetter AJ, Leung SY, Sohn JJ, et al. MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma[J]. JAMA, 2008, 299(4):425-436.
[6] 颜黎栩,黄马燕,吴秋良,等. miR-21表达异常与乳腺癌临床病理特征及预后的关系 [J]. 中国病理生理杂志, 2009, 25( 4): 676- 681.
[7] Park JK, Lee EJ, Esau C, et al. Antisense inhibition of microRNA-21 or -221 arrests cell cycle, induces apoptosis, and sensitizes the effects of gemcitabine in pancreatic adenocarcinoma[J]. Pancreas, 2009, 38(7):e190-e199.
[8] Meng F, Henson R, Lang M, et al. Involvement of human micro-RNA in growth and response to chemotherapy in human cholangiocarcinoma cell lines[J]. Gastroenterology, 2006, 130(7):2113-2129.
[9] Meng F, Henson R, Wehbe-Janek H, et al. MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer[J]. Gastroenterology, 2007, 133 (2):647-658.

