小鼠来源诱导多能干细胞定向分化为神经元的体外实验研究*
庞 卯, 杨 阳, 刘 斌, 张良明, 戎利民
(中山大学附属第三医院脊柱外科,广东 广州 510630)
脊髓损伤(spinal cord injury, SCI)是一种常见的中枢神经损伤,通常导致四肢躯干运动和感觉功能的部分丧失,甚至截瘫。目前脊髓损伤的治疗仍然是一个世界性的问题[1-2]。细胞移植治疗为脊髓损伤的修复提供了一种新的方法,常用的可供移植的细胞有神经干细胞、雪旺细胞、嗅鞘细胞和骨髓间充质干细胞[1]。因涉及到从人类胚胎或其它组织中获取细胞,故同种异体免疫排斥和伦理问题是限制其临床应用的主要障碍[3]。获得一种既能够多能性分化,又可避免免疫排斥反应的干细胞对于脊髓损伤的治疗具有重要的意义。诱导多能干细胞(induced pluripotent stem cells, iPSCs)给我们提供了一个新策略[4]。Takahashi等[5]利用逆转录病毒载体将Oct3/4、Sox2、Klf4和c-Myc 4种转录因子转移至小鼠成纤维细胞中,首次获得iPSCs。先前的研究也指出iPSCs可以分化为神经干细胞以及进一步分化为神经元、少突胶质细胞和星形胶质细胞[6-7]。因此,在脊髓损伤的实验性自体细胞移植治疗中,iPSCs显示出了广阔的前景[8]。已有报道不同来源的iPSCs可以分化为神经元,但分离过程较为冗繁[7,9]。本文旨在前期研究的基础上探讨如何大量、稳定、简便地将iPSCs定向分化为神经元,从而为其巨大治疗潜能的发挥奠定体外实验基础。
材 料 和 方 法
1 材料与试剂
小鼠iPSc细胞系购自中国科学院广州生物医药与健康研究院;胎牛血清、DMEM高糖培养基、DMEM/F12培养基、L-谷氨酰胺、非必需氨基酸(non-essential amino acid, NEAA)、N2添加物(N2 supplement)、B27添加物(B27 supplement)、含有EDTA的胰酶、β-巯基丙醇、明胶溶液、Neurobasal培养基和ITS-A(insulin-transferrin-selenium-A)添加物均购自Gibco;白血病抑制因子(leukemia inhibitory factor,LIF)购自Millipore;维甲酸(retinoic acid,RA)购自Sigma;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和表皮生长因子(epidermal growth factor,EGF)购自Peprotech;兔抗小鼠Oct4、Sox2和SSEA1抗体购自Santa Cruz;兔抗小鼠巢蛋白(nestin)单克隆抗体购自Abcam;兔抗小鼠微管相关蛋白2(microtubule-associated protein 2,MAP-2)单克隆抗体购自Millipore;兔抗小鼠胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)单克隆抗体和兔抗小鼠髓磷脂碱性蛋白(myelin basic protein,MBP)单克隆抗体购自北京博奥森生物公司;FITC标记驴抗兔IgG购自Life;FITC标记羊抗兔IgG购自Abgent;0.1% Triton X-100穿膜剂购自天津光复精细化工研究所;6%牛血清白蛋白(bovine serum albumin,BSA)溶液购自广州碧云天生物公司;染核试剂Hoechst 33342购自广州齐云生物公司;甲醇和磷酸盐缓冲液(phosphate-buffered saline solution,PBS)购自广州化学试剂厂。
2 方法
2.1培养基 小鼠iPSCs培养基:DMEM高糖培养基、15%胎牛血清、1%非必须氨基酸、1 mmol/L L-谷氨酰胺、1%β-巯基乙醇和0.1%LIF。拟胚体(embryoid body, EB)培养基:不含LIF的iPSCs培养基。神经干细胞(neural stem cells,NSCs)诱导培养基: Neurobasal培养基、DMEM/F12培养基、1% N2 supplement、2% B27 supplement 和1% ITS-A。NSCs培养基:DMEM/F12培养基、2 mmol/L GlutaMAX、2% B27 supplement 、20 μg/L bFGF和20 μg/L EGF。神经元诱导培养基:DMEM/F12培养基、5%胎牛血清和1 μmol/L RA。小鼠成纤维细胞培养基:DMEM高糖培养基和10%胎牛血清。
2.2小鼠iPSCs传代培养 将小鼠的iPSCs接种于经10 mg/L丝裂霉素C处理过的第3代小鼠胚胎成纤维细胞(mouse embryonic fibroblast, MEF)饲养层上,使用iPSCs培养基培养。待集落长满饲养层,用0.25%含有EDTA的胰酶消化,血清终止消化后将集落吹下,加入3~5 mL培养液,轻轻吹散成小集落,均匀接种于饲养层细胞上。
2.3小鼠iPSCs向NSCs的定向分化 取生长状态良好的小鼠iPSCs,使用0.25%含有EDTA的胰酶消化,用不含LIF的EB培养基吹打成小的细胞团,接种到低黏附的细菌培养皿中培养2 d,观察EB的形成。收集悬浮培养2 d的EB,用含1 μmol/L RA的EB培养基诱导培养2 d促进其进一步分化。第5天时将EB置于0.1%明胶溶液包被过的6孔板中,换用NSCs诱导培养基中,隔天换液。7 d后在解剖显微镜下使用巴氏管将rosette结构外已“爬出”的细胞分离成“碎片状”细胞集落甚至单个细胞后,再次转移至低黏附的细菌培养皿中促进神经球(neurosphere)形成。
2.4小鼠NSCs向神经元、星形胶质细胞及少突胶质细胞的分化 NSCs悬浮培养7 d后,将其转移至含1 μmol/L RA及胎牛血清的分化培养基中贴壁培养,倒置显微镜下观察诱导后细胞的形态变化。
3 iPSCs及其分化的神经谱系鉴定
3.1iPSCs内干细胞特异性标志物碱性磷酸酶检测 PBS清洗细胞3遍,加入冰甲醇4 ℃环境中固定细胞10 min;弃除冰甲醇,PBS清洗3遍,每次5 min;加入1 mL AP显色液,室温暗盒中静置15 min,PBS洗2遍后,每孔加入2 mL PBS, 倒置显微镜下拍照。
3.2免疫荧光染色检测Oct4、Sox2、SSEA1、nestin、MAP-2、GFAP及MBP的表达 PBS清洗细胞3遍,加入冰甲醇4 ℃环境中固定细胞10 min;弃除冰甲醇,PBS清洗3遍,每次5 min;加入0.1% Triton X-100及6% BSA等体积穿膜封闭混合液,室温避光孵育1 h;PBS清洗3遍,每次5 min,加入兔抗小鼠Oct4 Ⅰ抗(1∶250)、Sox2 Ⅰ抗(1∶250)、SSEA1 Ⅰ抗(1∶250)、nestin Ⅰ抗(1∶1 000)、MAP-2 Ⅰ抗(1∶1 000)、GFAP Ⅰ抗(1∶200)及MBP Ⅰ抗(1∶200),4 ℃环境中孵育过夜;第2天吸除 Ⅰ抗溶液,PBS清洗3遍,每次5 min,加入羊抗兔荧光标记Ⅱ抗(1∶50)或驴抗兔荧光标记Ⅱ抗(1∶400),室温孵育1 h;吸除Ⅱ抗溶液,PBS清洗3遍,每次5 min,Hoechst 33342染核2~3 min;吸除染核试剂,添加少量PBS后,倒置荧光显微镜下观察。
3.3RT-PCR检测GFAP、nestin、β3- tubulin、MAP-2及MBP mRNA的表达 引物序列见表1。取贴壁分化后的iPSCs, 无菌PBS洗3遍,常规 Trizol法提取总RNA。使用TaKaRa逆转录试剂盒,随机引物逆转录合成cDNA后进行PCR扩增,PCR反应条件如下:95 ℃预变性3 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,扩增30个循环,72 ℃ 10 min。取9 μL PCR产物于1 μL 10× loading buffer 中,点样于2%琼脂糖凝胶电泳,90 V、30 min。紫外灯下观察,凝胶成像系统(Gel Imaging System)拍照。

表1 引物序列
3.4MAP-2的鉴定 取MAP-2的PCR合成产物,鉴定由上海英潍捷基公司完成。
3.5流式细胞术检测分化神经干细胞及神经元的比例 细胞经胰酶消化,重悬,400目滤网过滤,每106个细胞经PBS洗涤后使用250 μL固定破膜剂(BD cytofix/cytoperm),4 ℃孵育20 min。洗涤液清洗细胞2次(BD perm/wash buffer),每次700×g离心8 min。加入FITC标记的nestin抗体(1∶200)和MAP-2抗体(1∶1 000),室温孵育30 min。检测神经元比例的细胞中继续加入FITC标记的驴抗兔Ⅱ抗(1∶200),室温孵育15 min。吸除抗体,PBS重悬后上机(BD Biosciences)检测。
结 果
1 小鼠iPSCs形态特点及定向分化为NSCs
小鼠iPSCc呈典型的克隆状生长(图1A)。克隆呈圆形或类圆形,边界清晰。克隆内细胞排列紧密,核大、核仁清晰,细胞核/质比高,高倍镜下形似鸟巢。一般在消化iPSCs后悬浮培养的第2天可见到EB形成 (图2A1、A2),EB内细胞间黏附紧密,各EB边界清楚,表面不光滑,胚体饱满,悬浮生长于培养液中。将EB置于含RA的培养基后其形态无明显变化,仍呈现圆形或类圆形的悬浮体(图2A3);EB贴壁2~3 d后可以观察到其边缘逐渐有细胞“爬出”,形成rosette结构(图2B1),其细胞形态与iPSCs明显不同,细胞体积较小,核仁不大,核浆比较低,随着时间的延长,其分化细胞数目逐渐增多,至第7天达到高峰(图2B2、B3);在解剖显微镜下经巴氏管机械分离“爬出”的“碎片”状细胞集落或单个细胞经悬浮培养2 d后,细胞逐渐聚集,再次形成圆形或类圆形的悬浮细胞聚集体,即神经球,其折光性好,内部结构清晰,呈颗粒状,与EB形态差异较大(图2C1~C3)。
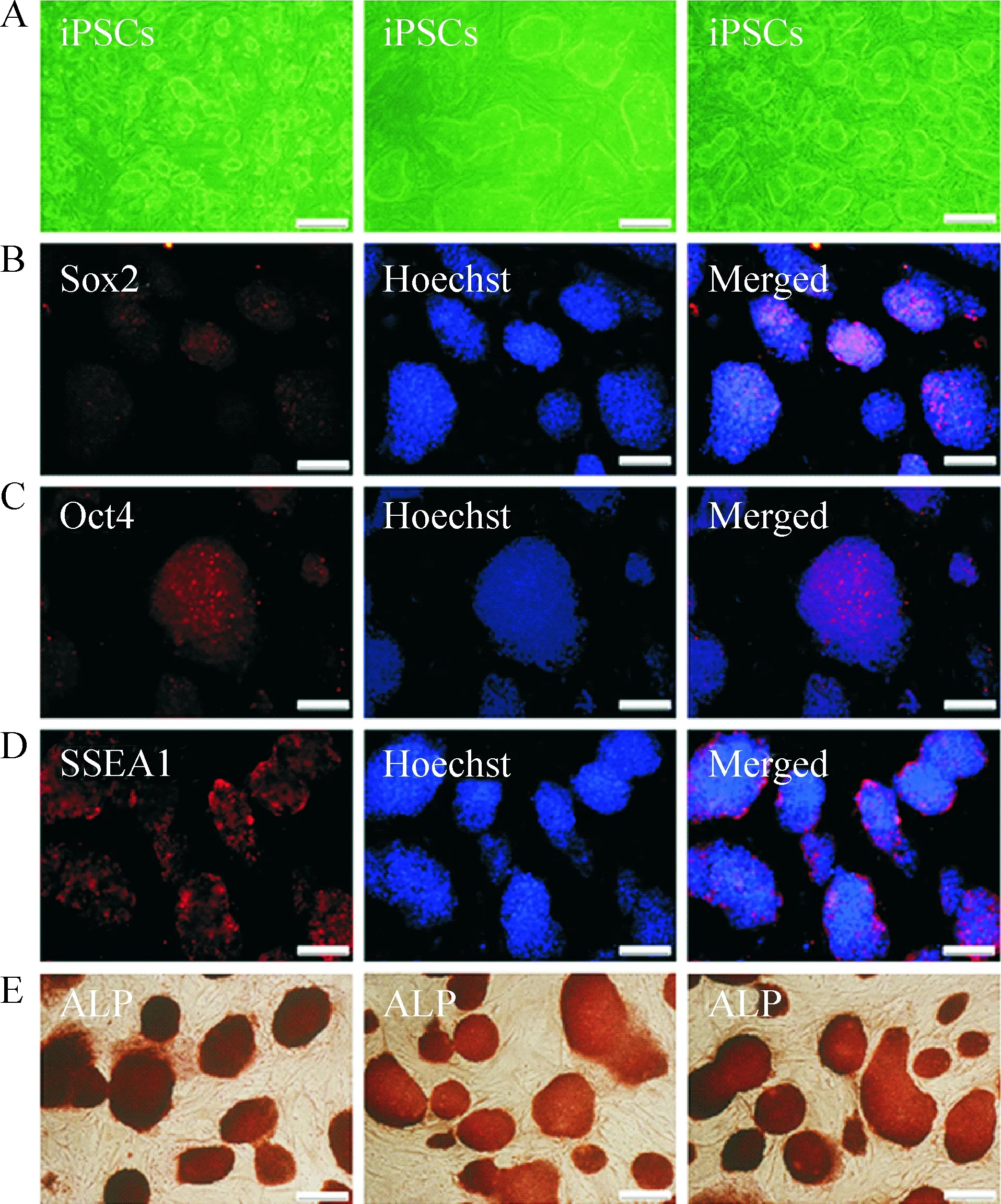
Figure 1. Charicteristics and identification of the mouse iPSCs. A: photomicrographs of the iPSCs; B~E: stem cell markers were assessed by immunofluorescence, including Sox2 (B), Oct4 (C), SSEA1 (D), and alkaline phosphatase (ALP; E). Scale bars = 200 μm.
2 小鼠NSCs定向分化为神经元、星形胶质细胞及少突胶质细胞
悬浮培养的神经球贴壁培养3~5 d后即可见有神经突起样的细胞逐渐由其边缘爬出(图2D1),7 d后,可观察到明显的神经突起样结构从贴壁的神经球中伸出,突起相互交织,形成网络;继续诱导培养,突起样结构继续增多并延长,向远处迁移,彼此间形成突触样结构(图2D2),15 d后高倍镜下见神经元胞体透亮度明显降低,神经元趋于老化(图2D3)。
3 iPSc及其分化细胞上特异性表面标志物的表达
iPSc细胞株碱性磷酸酶检测均为强阳性,呈紫红色,饲养层细胞不着色,说明iPSCs具有较高的干细胞特性(图1E)。免疫荧光结果显示稳定传代后的iPSCs表达干细胞标志物Oct4、Sox2和SSEA1(图1B~D);RA诱导后无血清培养基筛选培养7 d的神经球克隆表达NSCs标志物nestin(图3A)。神经球贴壁分化培养后的细胞表达神经元标志物(图3B)、星形胶质细胞标志物GFAP(图3C)和少突胶质细胞标志物MBP(图3D),证实神经干细胞已分化为神经元、星形胶质细胞和少突胶质细胞。

Figure 3. Immunofluorescence of mouse neurospheres and their differentiated derivatives. Neurospheres, neurons, oligodendrocytes, and astrocytes were assessed by immunofluorescence for nestin (A), MAP-2 (B), GFAP (C), and MBP (D). Scale bars =200 μm (A, C), 100 μm (B), and 50 μm (D).
4 神经球贴壁分化后GFAP、nestin、β3-tubulin、MAP-2和MBP mRNA测定及MAP-2基因的鉴定
RT- PCR结果显示神经球贴壁分化培养后的细胞分别表达神经元及胶质细胞标志物GFAP、β3-tubulin、MAP-2、和MBP,未表达神经干细胞标志物nestin(图4A),表明神经干细胞已完全分化;基因鉴定结果显示MAP-2 PCR产物与GenBank基因库中小鼠MAP-2基因相符合(图4B)。
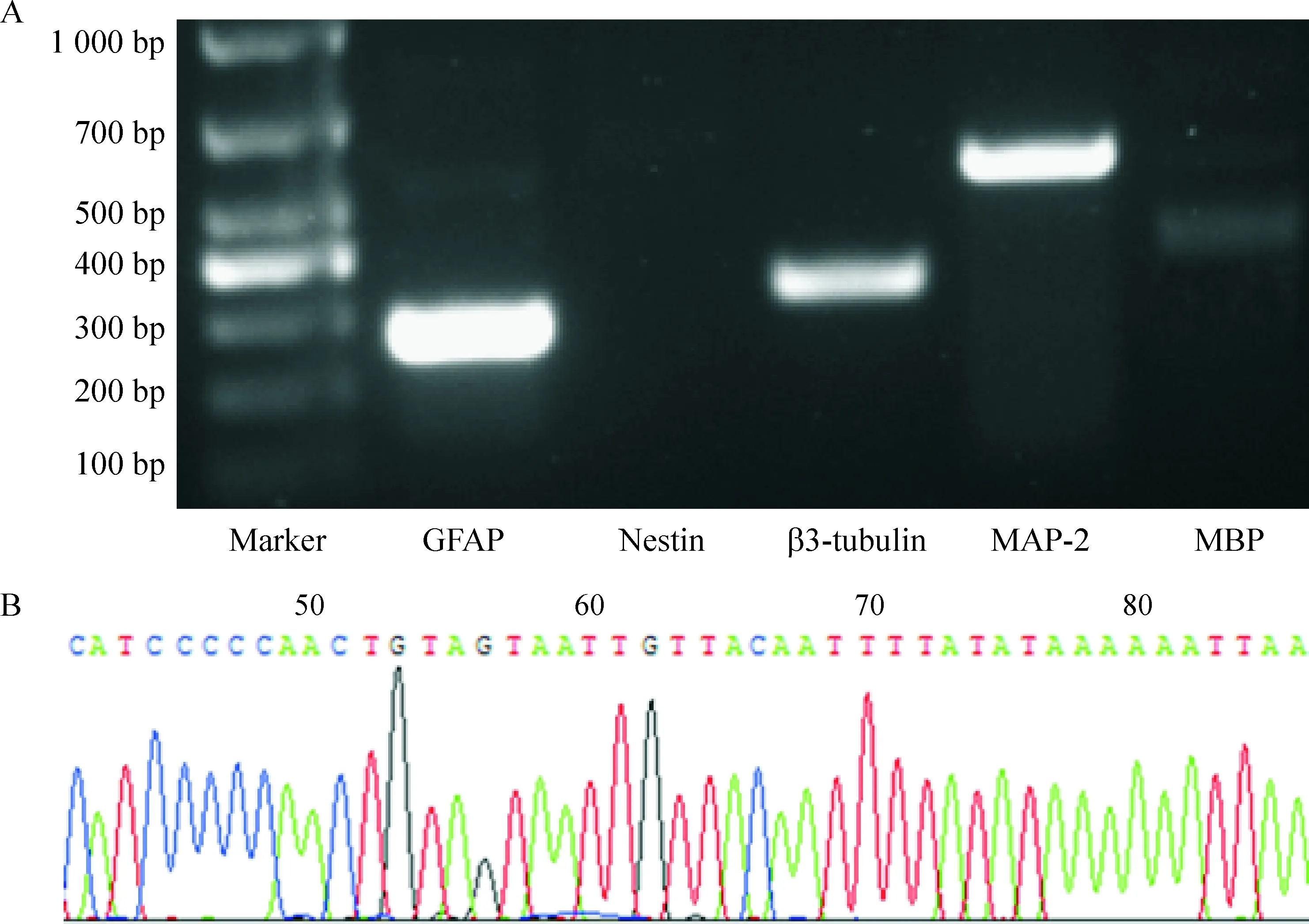
Figure 4. Sequencing result of MAP-2 gene RT-PCR product in the cells differentiated from the mouse iPSC-derived neurospheres.
5 流式细胞术检测细胞比例
流式细胞术检测结果显示分化细胞中神经干细胞和神经元的比例分别为(63.93±1.47)%和(21.40±1.70)%,见图5。
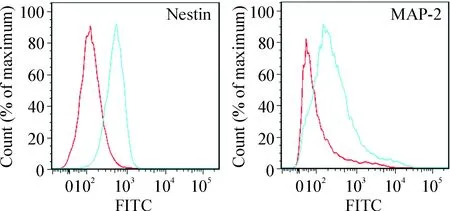
Figure 5. Flow cytometric analysis of the markers nestin and MAP-2 in the differentiated cells.
讨 论
目前对于神经系统损伤性及退行性疾病,临床上尚无安全有效的新方法,而再生医学的快速发展为此类疾病的治疗提供了新希望[10],iPSCs作为再生医学中一个新兴的成员,它的相关理念与技术在数年间迅猛发展,其应用前景也越来越广阔[11-12]。利用iPSCs的多能分化性可将其定向分化为NSCs及神经元,而NSCs可塑性较强,移植入神经组织中根据局部的信号刺激可分化为神经元及胶质细胞,从而发挥重建信号转导通路进而恢复神经功能的作用[6-7, 9],有望成为治疗脊髓损伤新兴的种子细胞。
本实验充分证明了体外合适的诱导环境可以将iPSCs定向分化为NSCs及神经元,从而为iPSCs潜在治疗效能的实现奠定了基础。我们在iPSCs向NSCs定向分化后,采用机械分离法将rossette结构外围的细胞集落尽量分散成碎片或单个细胞,简化了操作。因在解剖显微镜下操作,故需注意无菌原则,同时需细致分离以避免细胞污染。我们在实验中加用了经典的神经诱导剂RA,其在神经细胞的发育、再生和维持中发挥重要的作用,它能够抑制前部转录因子的表达,同时激活后部转录因子的表达[13]。
本实验所用iPS为病毒诱导而来,其本身存在潜在的致瘤风险,未在动物体内行移植检测是不足之处,后续实验拟使用安全性更高的穿膜蛋白[14]诱导iPSCs,并行神经细胞定向分化以及体内实验验证。我们在iPSCs定向分化过程中经过了EB中间状态,而Hester等[9]使用神经源素2(neurogenin 2, NGN2)、胰岛素基因增强结合蛋白1(islet-1, ISL-1)和LIM/同源框蛋白3(LIM/homeobox protein 3, LHX3)从iPSCs诱导至神经前体细胞(neural progenitor cells, NPCs)再定向分化为运动神经元(motor neurons, MN),不经过EB中间状态。另有研究显示在不同的诱导条件跳过iPSCs和NSCs过程直接将小鼠和人的成纤维细胞分别重编程为多巴胺能神经元和脊髓运动神经元[15-16],均简化了诱导过程。但iPSCs或成纤维细胞分化而来的神经元修复脊髓损伤的作用仍需进一步动物实验以及未来临床实验证明,同时仍需优化诱导条件及流程,使得iPSCs真正成为修复脊髓损伤的理想种子细胞。
[参 考 文 献]
[1] Tetzlaff W, Okon EB, Karimi-Abdolrezaee S, et al. A systematic review of cellular transplantation therapies for spinal cord injury[J]. J Neurotrauma, 2011, 28(8):1611-1682.
[2] 关 骅. 科学性是脊髓损伤基础与临床研究的根本[J]. 中国脊柱脊髓杂志, 2012, 22(12):1057-1058.
[3] Suter DM, Krause KH. Neural commitment of embryonic stem cells: molecules, pathways and potential for cell therapy[J]. J Pathol, 2008, 215(4):355-368.
[4] 张 琪, 陈规划. 诱导多能干细胞研究进展——细胞的炼丹术[J]. 器官移植, 2010, 1(1):52-54.
[5] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4):663-676.
[6] Yao XL, Liu Q, Ye CH, et al. Neuronal differentiation potential of mouse induced pluripotent stem cells[J]. Neuroreport, 2011, 22(14):689-695.
[7] 冯年花, 谢 安, 娄远蕾, 等. 人诱导性多能干细胞向神经干细胞分化的方法探讨[J]. 中国病理生理杂志, 2010, 26(8):1662-1664.
[8] Fujimoto Y, Abematsu M, Falk A, et al. Treatment of a mouse model of spinal cord injury by transplantation of human induced pluripotent stem cell-derived long-term self-renewing neuroepithelial-like stem cells[J]. Stem Cells, 2012, 30(6):1163-1173.
[9] Hester ME, Murtha MJ, Song S, et al. Rapid and efficient generation of functional motor neurons from human pluripotent stem cells using gene delivered transcription factor codes[J]. Mol Ther, 2011, 19(10):1905-1912.
[10] Willerth SM, Sakiyama-Elbert SE. Cell therapy for spinal cord regeneration[J]. Adv Drug Deliv Rev, 2008, 60(2):263-276.
[11] Jung YW, Hysolli E, Kim KY, et al. Human induced pluripotent stem cells and neurodegenerative disease: prospects for novel therapies[J]. Curr Opin Neurol, 2012, 25(2):125-130.
[12] Jeong SW, Chu K, Jung KH, et al. Human neural stem cell transplantation promotes functional recovery in rats with experimental intracerebral hemorrhage[J]. Stroke, 2003, 34(9):2258-2263.
[13] Kim M, Habiba A, Doherty JM, et al. Regulation of mouse embryonic stem cell neural differentiation by retinoic acid[J]. Dev Biol, 2009, 328(2):456-471.
[14] 李红阳, 李晓霞, 余榕捷, 等. 带有穿膜肽PTD的重组Oct4的制备及活性鉴定[J]. 中国病理生理杂志, 2011, 27(9):1790-1795.
[15] Caiazzo M, Dell’Anno MT, Dvoretskova E, et al. Direct generation of functional dopaminergic neurons from mouse and human fibroblasts[J]. Nature, 2011, 476(7359):224-227.
[16] Son EY, Ichida JK, Wainger BJ, et al. Conversion of mouse and human fibroblasts into functional spinal motor neurons[J]. Cell Stem Cell, 2011, 9(3):205-218.

