川崎病患儿细胞免疫功能状况及转录因子T-bet和GATA3的调控作用*
王从军, 陈 梅, 雷中劲
(1荆楚理工学院医学院, 2荆门市第一人民医院儿科, 湖北 荆门 448000)
川崎病(Kawasaki disease, KD)又称皮肤黏膜淋巴结综合征,其病因尚不清楚,是一种以全身血管炎为主要病理变化的急性发热出疹性疾病,可以产生严重的心血管并发症。因为在川崎病尸检病例中发现损伤的血管组织中有IgA、浆细胞、单核/巨噬细胞、CD8+T 淋巴细胞浸润,一般认为它是一种自身免疫性疾病[1],但对川崎病患者细胞免疫和体液免疫功能异常的研究还没有一致的结论[2-3]。本实验拟通过半定量逆转录-聚合酶链反应检测部分川崎病患儿外周血单个核细胞(peripheral blood mononuclear cells, PBMC)中T-bet 和GATA3 mRNA 转录量并同时采用三色荧光流式细胞术检测川崎病患儿外周血Th1和Th2 细胞的比例,分别从转录水平和表达水平明确KD患儿T细胞功能状态。
材 料 和 方 法
1 研究对象
以 2010 年3 月至 2011 年 9月入住荆门市第一人民医院儿科的 41 例 KD 患儿为研究对象,其中男24例,女17例,年龄2月~5岁,均符合2004年美国儿科学会和心脏病学会联合制定的KD诊断标准[4],且回顾性诊断没有误诊,根据彩色多普勒超声诊断冠状动脉有扩张的15例。同时选取年龄和性别相匹配的急性上呼吸道感染发热儿童40 例为对照组。
2 仪器及试剂
Becton Dickinson流式细胞仪。刺激素为佛波酯+ionomycin+monensin(Sigma)。抗体:细胞表面标记抗体,CD3-TC和CD8-FITC;细胞因子抗体,IL-4-PE和IFN-γ-PE。同型对照: Mouse IgG1-PE(对应于IL-4-PE)和Mouse IgG2-PE(对应于IFN-γ-PE);IntraPrep破膜剂,以上均为Pharmingen产品。TRIzol购自深圳晶美公司; PCR试剂盒、DNA marker、逆转录酶、RPMI-1640、Taq酶及缓冲液为Promega产品。
3 方法
3.1PBMC的分离 用肝素抗凝管采集静脉血至少 2 mL,采集后 4 h内使用; 加入等体积的 Hank 平衡盐缓冲液(HBSS, pH 7.2~7.4)稀释血液,取与稀释后血液等体积的淋巴细胞分层液(Ficoll 液)加入离心管中,将稀释血液小心地加到淋巴细胞分层液上,注意保持两者界面清晰,室温下2 000 r/min离心 20 min; 用毛细吸管轻轻吸出单个核细胞层,加入含有 5 mL HBSS 的试管中,充分混匀, 1 500 r/min离心 10 min,弃上清后,再洗1次,弃上清,用 RPMI-1640(含 10%热灭活 FBS)重悬单个核细胞,用台盼蓝染色计数活细胞数(应在 95%以上); 调节细胞浓度为 2×109/L,-20 ℃冻存待测。
3.2总RNA的抽提与鉴定 按照TRIzol法提取PBMC总RNA。抽提完后分别用荧光分光光度计测定A260和A280并计算比值,进一步采取1%琼脂糖电泳以分析RNA的纯度和完整性, 见到典型3条条带(5S、18S、28S)后行逆转录反应。
3.3RT-PCR检测目的基因mRNA的转录量 总RNA提取鉴定后立即逆转录合成 cDNA以防降解,合成的cDNA置-20 ℃冰箱保存备用或直接行PCR反应。PCR反应体系:10×PCR buffer 5 μL,10 mmol/L dNTP Mix 5 μL, RT-PCR产物cDNA 2 μL,上游引物 20 μmol/L,下游引物 20 μmol/L,Taq polymerase 0.25 μL,灭菌水调总反应体积至50 μL。94 ℃预变性 5 min;94 ℃ 45 s,55 ℃ 50 s,72 ℃ 1 min,25个循环;72 ℃ 7 min。点取 T-bet、GATA3及 GAPDH扩增产物 10 μL在 1.2%琼脂糖凝胶板孔中,100 V电泳20 min。凝胶电泳图像输入Kodak Digital Science System DC40凝胶成像系统,应用图像分析软件进行各条带平均灰度值分析,以同时扩增的 GAPDH为外参照,用转录因子/GAPDH的比值表示转录因子相对表达量。各对引物见表1。
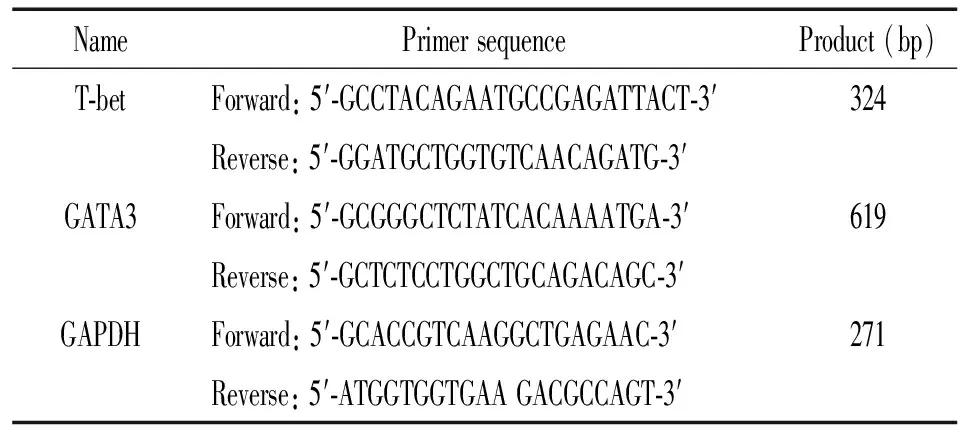
表1 T-bet、GATA3、GAPDH PCR引物序列
3.4流式细胞术检测Th1和Th2细胞 取 600 μL PBMC(2×109cells/L)于试管中,加入 10 μL 1 mg/L 佛波酯工作液 + 8 μL 50 mg/L ionomycin 工作液 + 6.8 μL 0.1 g/L monensin 工作液混匀,37 ℃、5% CO2培养箱培养 4~6 h。混匀细胞,加入 20 μL CD3-TC 和 20 μL CD8-FITC,室温下避光孵育 15 min。将细胞分成4 管,每管加入 100 μL PBMC,编号为 A1、A2、A3和A4;每管中加入 100 μL Fix&Perm 中的 Reagent A(固定液),室温避光孵育15 min;每管中加入 3 mL PBS,1 200 r/min 离心 5 min,弃除上清;每管中加入 100 μL Fix&Perm 中的 Reagent B,同时各管中分别加入相应的抗体各 10 μL (A1: Mouse IgG1-PE;A2: IFN-γ-PE;A3: Rat IgG1-PE;A4: IL-4-PE);室温下避光孵育15 min。每管中加入3 mL PBS,1 200 r/min 离心5 min,弃除上清;取0.5 mL PBS重悬细胞,上机检测,每一样品检测 20 000个细胞。
4 统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 17.0统计软件分析,组间比较采用独立样本t检验, T-bet mRNA、GATA3 mRNA 分别与Th1、Th2细胞间的相关性采用Spearman相关分析法。以P<0.05为差异有统计学意义。
结 果
1 KD患儿与对照组患儿外周血淋巴细胞转录因子 T-bet及GATA3转录水平
由图1和表2可见,KD患儿外周血淋巴细胞转录因子T-bet和GATA3 mRNA的水平均显著低于对照组。
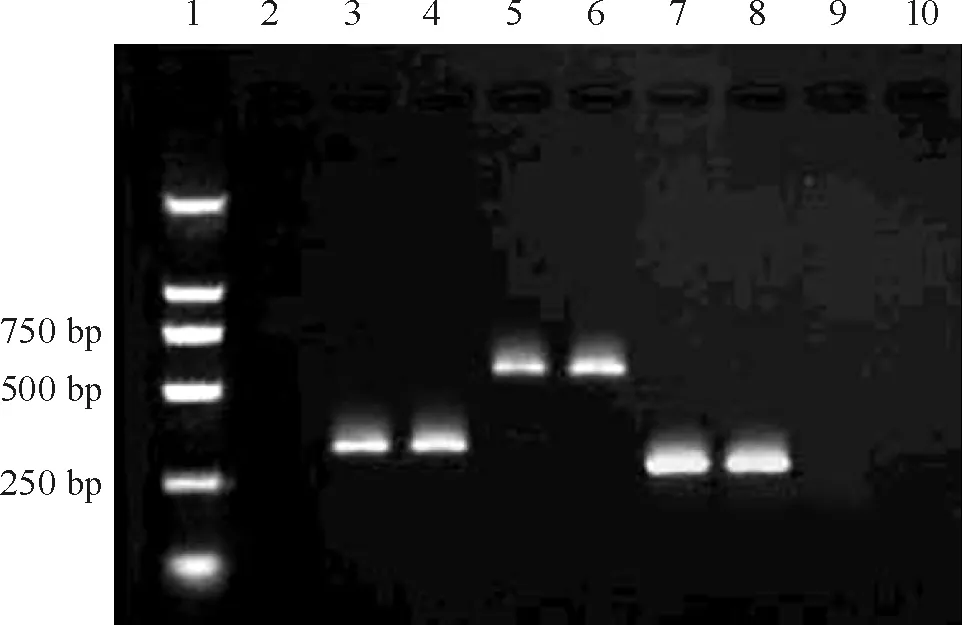
Figure 1. The electrophoretogram of T-bet, GATA3 and GAPDH mRNA in peripheral blood in KD group and control gorup.1: DNA marker; 3: T-bet mRNA of KD group; 4: T-bet mRNA of control group; 5: GATA3 mRNA of KD group; 6: GATA3 mRNA of control group; 7: GAPDH mRNA of KD group; 8: GAPDH mRNA of control group.
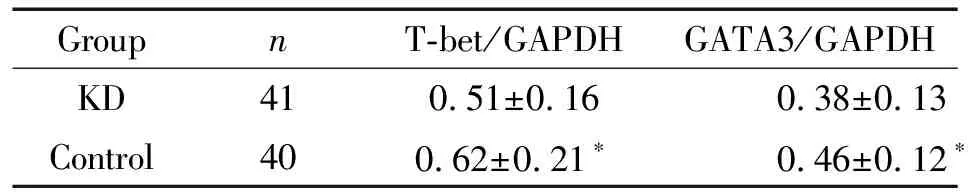
表2 KD组与对照组T-bet mRNA和GATA3 mRNA的 RT-PCR检测结果
2 KD患儿外周血淋巴细胞亚群 Th1和Th2细胞百分率的变化
用 CD3 和 CD8反设CD4细胞,即 CD3+CD8-的细胞被认为是 CD3+CD4+的细胞。以散点图IFN-γ和IL-4染色阳性分别表示Th1和Th2细胞,见图2。用Cells Quest软件获取并分析数据,流式细胞术检测结果显示KD患儿外周血淋巴细胞亚群Th1和Th2细胞的百分率显著低于对照组(P<0.05),Th1/Th2的比值与对照组相比无显著差异(P>0.05),见表3。
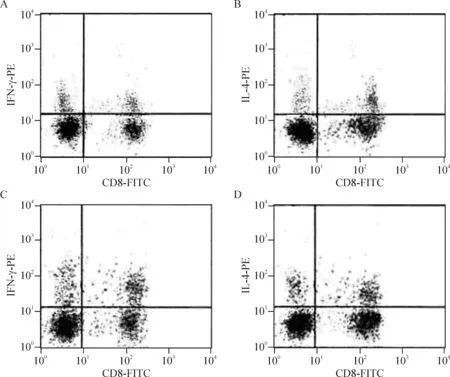
Figure 2. Detection of Th1 and Th2 cells in peripheral blood by flowcytometry method in KD group and control gorup.A: Th1 cells in flow cytometry graph of KD group; B: Th2 cells in flow cytometry graph of KD group; C: Th1 cells in flow cytometry graph of control group; D: Th2 cells in flow cytometry graph of control group.
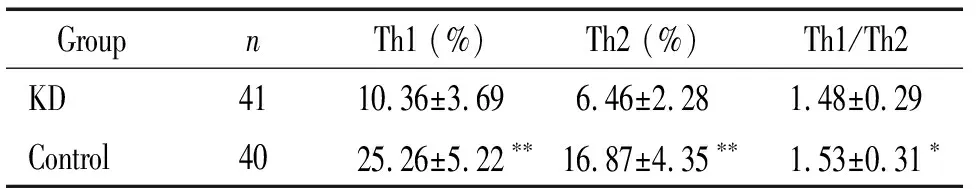
表3 KD组与对照组Th1和Th2细胞流式细胞术检测结果
3 T-bet mRNA与Th1细胞、GATA3 mRNA与Th2细胞间的相关分析
对全部81例研究对象T-bet和GATA3 mRNA半定量值与Th1、Th2细胞百分比分别进行Spearman相关分析,结果显示T-bet mRNA转录量与Th1细胞比例呈正相关(r=0.69,P<0.05),GATA3 mRNA转录量与Th2细胞比例呈正相关(r=0.65,P<0.05),见图3。
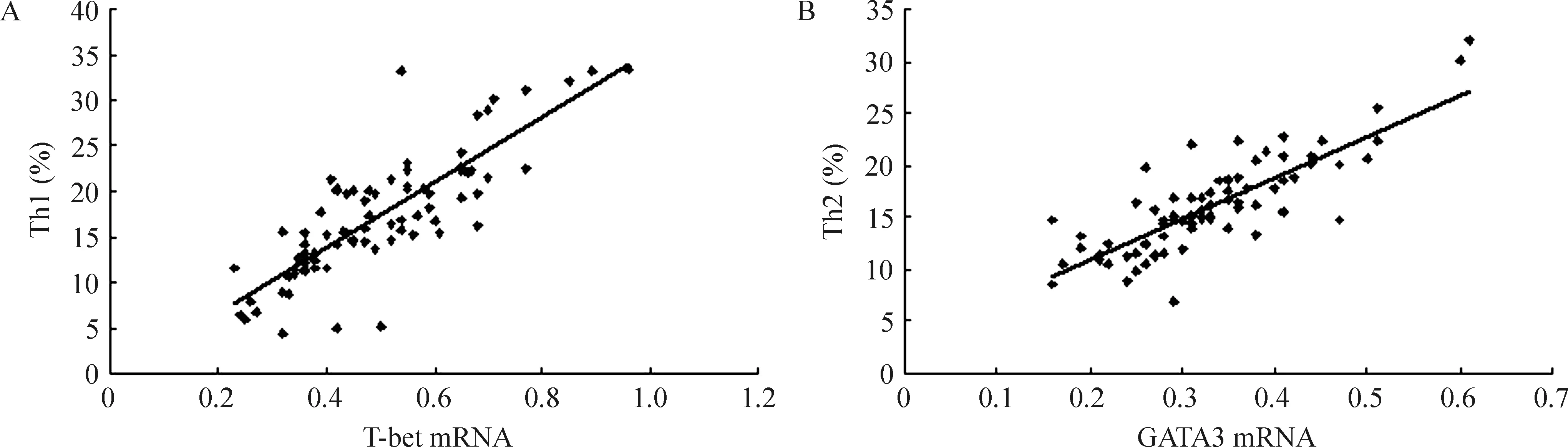
Figure 3. The correlations between T-bet mRNA and Th1 cells (A), and between GATA3 mRNA and Th2 cells (B).
讨 论
KD的病因及发病机制尚未清楚,多数学者认为本病与感染介导的免疫系统高度活化密切相关[5-6]。目前报道与川崎病发病有关的病原体有10余种,包括链球菌[7]、葡萄球菌[8]、支原体[9]、人类微小病毒B19[10]等。在感染等因素作用下,急性期CD4+T细胞数目增多,CD8+T细胞数目减少,CD4+T细胞表面CD40配体表达明显增高,提示患儿细胞免疫功能紊乱[11]。但有实验表明川崎病急性期CD4+调节性T 细胞数目减少,辅助性T 细胞Th1、Th2细胞产物减少,因此对于T细胞功能在儿童川崎病中的地位仍有争议[12]。
T-bet是T-box转录因子家族中的新成员,不仅控制Th1细胞特征性细胞因子IFN-γ的表达,而且抑制Th2细胞特征性细胞因子 IL-4的产生,被确认为Th1特异性转录因子。GATA3是一个锌指蛋白,属于GATA家族成员,是Th2细胞特异的转录因子,GATA3不仅在Th2细胞分化过程中起关键作用,而且它还是所有Th2型细胞因子转录所必需的,能促使正在分化或已分化的Th细胞合成Th2细胞因子[13]。既往对川崎病患儿T细胞免疫功能状况的研究主要通过采用ELISA的办法检测2种Th细胞的特异性因子来间接检测Th1和Th2细胞的数目和功能[14],本研究通过检测两种T细胞亚群的特异性转录因子T-bet和GATA3并采用细胞内因子标记CD3、CD8设门的办法用流式细胞术检测外周血Th1和Th2细胞,进一步确定川崎病患儿T细胞功能状态,结果显示川崎病患儿急性期外周血PBMCs中T-bet mRNA和GATA3 mRNA低于对照组,提示川崎病急性期上述2种转录因子被不同程度抑制,而流式细胞术的检测结果也显示川崎病患儿外周血Th1和Th2细胞比例均较对照组显著减少。Spearman相关分析显示T-bet mRNA与Th1细胞比例、GATA3 mRNA与Th2细胞比例呈正相关。以上结果表明川崎病急性期PBMC中T-bet和GATA3 mRNA表达被抑制,相关表达产物减少,使Th细胞在向其亚群Th1、Th2转化方面被抑制而导致了Th1和Th2细胞减少,提示川崎病患儿急性期T淋巴细胞并非活化而是处于抑制状态,这和以往部分研究结果不一致。需要说明的是我们仅检测了川崎病急性期T淋巴细胞免疫功能状态,并不能完全反映川崎病亚急性期和恢复期特点,或许在川崎病的亚急性期和恢复期细胞免疫功能状况逐渐被激活,而部分研究者因在不同病程时间采集标本从而造成研究结果不一致,也有可能川崎病发病时循环池淋巴细胞被抑制而周围池被激活从而导致循环淋巴细胞减少,这需进一步动态测定川崎病各期T淋巴细胞功能状况并对炎性血管壁局部组织中的淋巴细胞功能状态进行研究加以证实。另外,我们也比较了川崎病患儿组与对照组儿童的Th1/Th2比值,并没发现显著差异,因此对于川崎病细胞免疫所起的作用还需进一步研究证实,同时对于川崎病急性期细胞免疫为什么被抑制也是需要通过进一步研究明确。
[参 考 文 献]
[1] Yeung RS. Kawasaki disease: update on pathogenesis[J]. Curr Opin Rheumatol,2010, 22(5):551-560.
[2] Suzuki H, Suenaga T, Takeuchi T, et al. Marker of T-cell activation is elevated in refractory Kawasaki disease[J]. Pediatr Int, 2010, 52(5):785-789.
[3] Franco A, Shimizu C, Tremoulet AH, et al. Memory T-cells and characterization of peripheral T-cell clones in acute Kawasaki disease[J]. Autoimmunity, 2010, 43(4):317-324.
[4] Newburger JW, Takahashi M, Gerber MA, et al. Diagnosis, treatment, and long-term management of Kawasaki disease: a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association [J]. Circulation, 2004, 110(17):2747-2771.
[5] Principi N, Rigante D, Esposito S. The role of infection in Kawasaki syndrome [J]. J Infect, 2013, 67(1):1-10.
[6] 孙 飞,顾再研,丁韧烨,等. CD14+CD16+单核细胞在川崎病患儿中的变化[J]. 中国病理生理杂志,2008, 24(10):2042-2043.
[7] Matsubara K, Fukaya T. The role of superantigens of group AStreptococcusandStaphylococcusaureusin Kawasaki disease[J]. Curr Opin Infect Dis, 2007, 20(3):298-303.
[8] Guerineau LR, Burriel EG, Nebot MS, et al. Disseminated staphylococcal infection resembling Kawasaki disease[J]. An Pediatr (Barc), 2012, 76(3):176-177.
[9] Chemli J, Hassayoun S, Ketata S, et al. Kawasaki disease andMycoplasmapneumoniaeinfection[J]. Med Mal Infect, 2010, 40(12):717-719.
[10] 郑 岩. 61例不完全性川崎病与微小病毒B19感染[J]. 中国实验诊断学, 2012, 16(3):439-441.
[11] Guggino G, Cimaz R, Accomando S,et al. Increased percentages of tumor necrosis factor-alpha+/interferon-gamma+T [corrected]lymphocytes and calprotectin+/tumor necrosis factor-alpha+monocytes in patients with acute Kawasaki disease [J]. Int J Immunopathol Pharmacol, 2012, 25(1):99-105.
[12] Kimura J, Takada H, Nomura A, et al.Th1 and Th2 cytokine production is suppressed at the level of transcriptional regulation in Kawasaki disease[J]. Clin Exp Immunol, 2004, 137(2):444-449.
[13] Peine M, Rausch S, Helmstetter C, et al. Stable T-bet+GATA3+Th1/Th2 hybrid cells ariseinvivo, can develop directly from naive precursors, and limit immunopathologic inflammation[J]. PLoS Biol, 2013, 11(8):e1001633.
[14] 常 健,鲁继荣,梁 东,等. 川崎病患儿急性期 Th1/Th2细胞功能状态的研究[J]. 中华儿科杂志, 2006, 44(5):377-378.

