miR-193通过细胞周期相关蛋白调控大鼠骨髓间充质干细胞的增殖能力*
毛晨熙, 陆 地, 孙成超
(温州医科大学附属第一医院心胸外科,浙江 温州 325000)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,MSCs)因其取材方便、无免疫排斥反应、具有多向分化潜能等优势而成为再生医学研究领域的热点种子细胞[1]。干细胞治疗临床前研究表明,移植细胞的数量、种类,及移植的时间是制约干细胞治疗疗效的关键[2]。因此,如何在短时间内获得更多的干细胞成为干细胞应用于临床的一个关键因素。
MicroRNA是一种由20~23个核苷酸片段构成的短片段RNA,能通过抑制靶蛋白mRNA的表达及促进其降解发挥作用[3]。在干细胞领域较多的microRNA被发现在调控细胞增殖、分化等过程中发挥重要作用[4]。因此,本研究将集中探究microRNA-193 (miR-193)在MSCs增殖过程中的功能,及其可能的作用通路。
材 料 和 方 法
1 动物
实验动物为SPF级SD大鼠,雄性,体重为60~80 g,购自温州医科大学实验动物中心,本实验经温州医科大学实验委员会批准。
2 主要试剂
DMEM培养基购自Gibco,胎牛血清(fetal bovine serum,FBS)购自Invitrogen,siPORT NeoFX Transfection Agent及TaqMan MicroRNA Assay系统均购自Ambion,miR-193转染片段和抑制剂购自上海GenePharma,MTS检测试剂盒和M-MLV逆转录酶购自Promega,BrdU增殖检测试剂盒购自Calbiochem,Ki-67抗体购自Abcam,Annexin V-FITC/PI细胞凋亡检测试剂盒购自北京宝赛生物公司,Trizol试剂购自Invitrogen。
3 主要方法
3.1MSCs的分离、培养和鉴定 取60~80 g SD大鼠颈椎脱臼法处死,75%乙醇浸泡3~5 min,取股骨、胫骨,PBS洗去残留血液。剪去股骨、胫骨两端骨骺,用含10%FBS的DMEM培养基反复冲洗骨髓腔中细胞,接种至培养瓶内。原代培养48 h换液1次,细胞达80~90%时1∶3传代,3~4代细胞用于本实验。采用流式细胞术鉴定MSCs表面抗原类型。
3.2miR-193及其抑制剂转染 MSCs密度达60%~70%时分别转染miR-193片段(pre-miR-193)或其阴性对照(miRNA mimic)以及miR-193抑制剂(anti-miR-193)或其阴性对照(miRNA inhibitor),miRNA mimic和miRNA inhibitor组作为阴性对照组(NC-mim和NC-inh),转染终浓度为30 nmol/L,转染后24~72 h进行相关检测。转染一般步骤参见siPORT NeoFX Transfection Agent(Ambion)转染说明书。荧光染色和qRT-PCR法检测转染效率。相关miRNA序列见表1。

表1 miRNA序列
3.3MTS细胞增殖检测 MSCs经3.2转染处理,分别取转染后24 h、48 h和72 h的细胞,将其接种到96孔板上,再加入20 μL MTS,继续培养3 h。然后在酶联免疫检测仪上选择490 nm波长,测定各孔吸光度。
3.4BrdU细胞增殖检测 将MSCs接种到96孔板,经3.2转染处理。转染24 h后,每孔细胞中加入20 μL BrdU工作液,继续培养12 h后进行检测。
3.5细胞免疫组化染色 将经3.2转染处理后的各组MSCs接种到盖玻片上,4%多聚甲醛固定20 min,0.3%Triton X-100孵育10 min,再用1%BSA封闭20 min,加入Ki-67(1∶200)4 ℃下孵育过夜。用PBS浸洗3次后,加入FITC标记的II抗工作液37 ℃孵育30 min。荧光显微镜下观察结果。
3.6Annexin V/PI双染流式细胞术检测细胞凋亡 取经3.2转染处理后MSCs,在低血清DMEM培养液里培养48 h后收集细胞,Annexin V/PI染色后经流式细胞仪检测,以区分活细胞、早期凋亡细胞、晚期凋亡/坏死细胞(分别标记为Annexin V-/PI-、Annexin V+/PI-、Annexin V+/PI+)。
3.7细胞周期相关蛋白mRNA表达检测 将经3.2转染处理的各组MSCs按试剂盒中方法进行总RNA提取,检测A260/A280以判定RNA纯度和浓度,琼脂糖凝胶电泳确定RNA质量,再进行qRT-PCR检测。相关引物序列见表2。

表2 引物序列
4 统计学处理
采用SPSS 13.0 统计软件处理,数据用均数±标准差(mean±SD)表示,各组间的差别采用单因素方差分析进行比较,以P<0.05为差异有统计学意义。
结 果
1 MSCs鉴定结果
流式细胞技术检测体外培养的MSCs表面抗原结果,CD29阳性率99.64%,CD44阳性率97.97%,CD34阳性率只有6.25%,CD45阳性率仅为3.35%,符合已知的MSCs表面抗原特点,表明本实验所使用细胞确为大鼠MSCs,见图1。
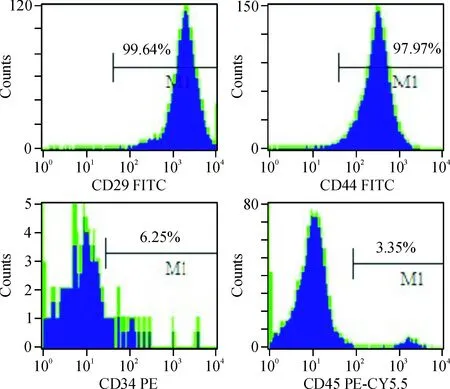
Figure 1. Flow cytometry analysis was used to evaluate surface antigen expression in MSCs.
2 miR-193转染细胞的效率检测
构建短片段miR-193对MSCs进行转染。携带荧光的miR-193片段能较好的转染MSCs,荧光发光比例能达到70%以上,见图2A。qRT-PCR检测发现转染miR-193或其抑制剂分别显著增加或抑制MSCs中miR-193的表达量(均P<0.01),见图2B。
3 miR-193对MSCs增殖水平的影响
3.1MTS检测MSCs增殖能力变化 在MSCs转染miR-193后24 h、48 h及72 h分别与对照组相比,MSCs增殖能力显著增高,抑制miR-193的表达则能造成MSCs增殖能力的下降,以24 h和72 h最为显著,差异有统计学意义(均P<0.01),见图3。
3.2BrdU检测MSCs增殖能力变化 miR-193能够显著改变转染24 h后MSCs的增殖状态,过表达miR-193促进MSCs的增殖,而抑制miR-193则能够抑制MSCs的增殖,差异有统计学意义(均P<0.01),见图4。
3.3细胞大体变化及Ki-67染色 采用Ki-67染色来明确miR-193转染后MSCs核增殖状态的变化,并在大体上对细胞的生长状态进行评价,结果发现过表达miR-193能增加Ki-67染色阳性细胞数,而抑制miR-193表达则会造成阳性细胞的减少,与对照组相比差异均有统计学意义(均P<0.05),见图5。

Figure 2. Transfection efficiency of miR-193 in MSCs.A: transfected MSCs with FAMTM dye-labeled miR-193 for 2 days (scale bars: 50 μm);B: the miR-193 expression detected by qRT-PCR. Mean±SD.n=3.**P<0.01 vs NC-mim or NC-inh.
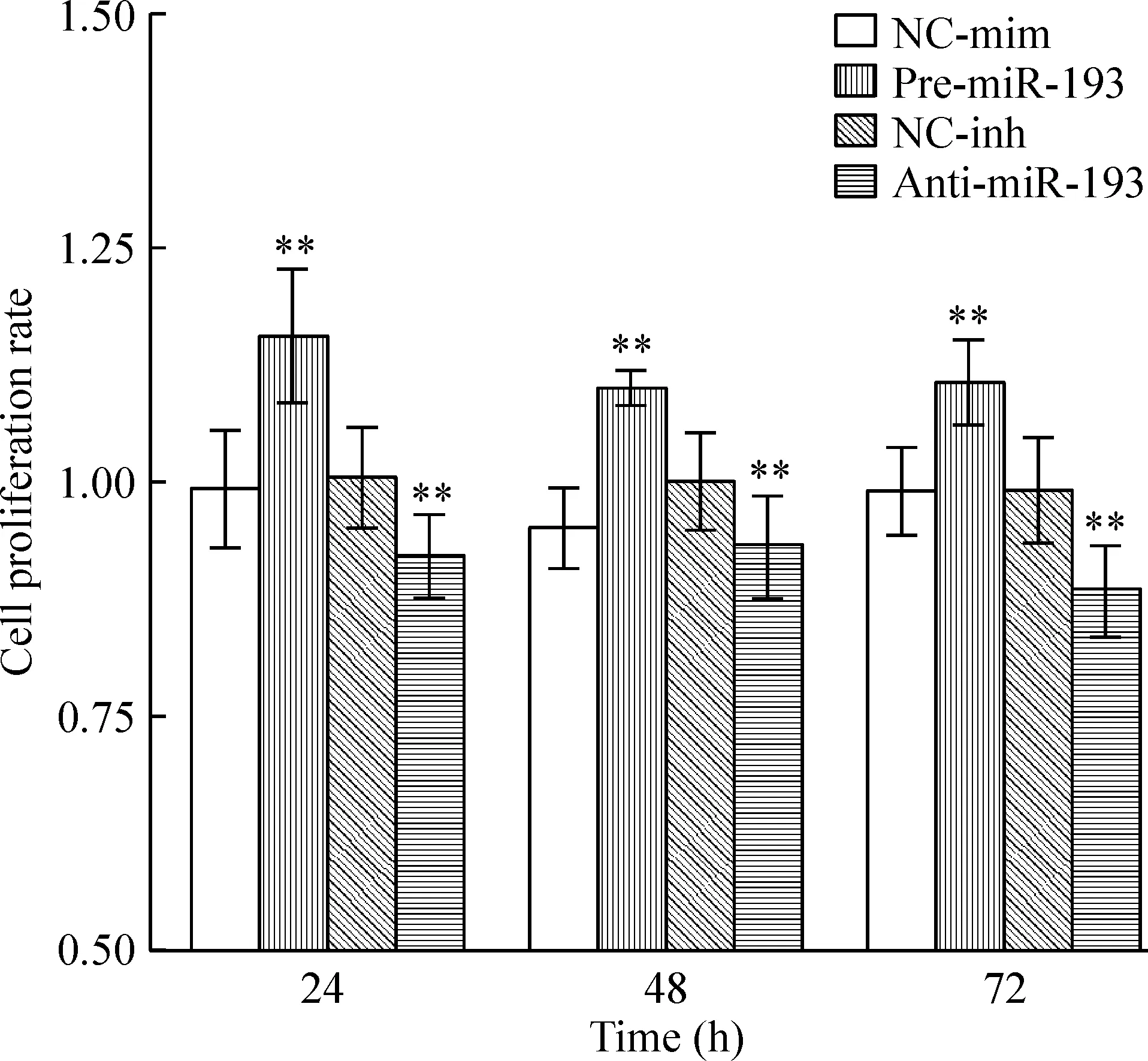
Figure 3. miR-193 regulated proliferation of MSCs at different time points. Mean±SD.n=3.**P<0.01 vs NC-mim or NC-inh.
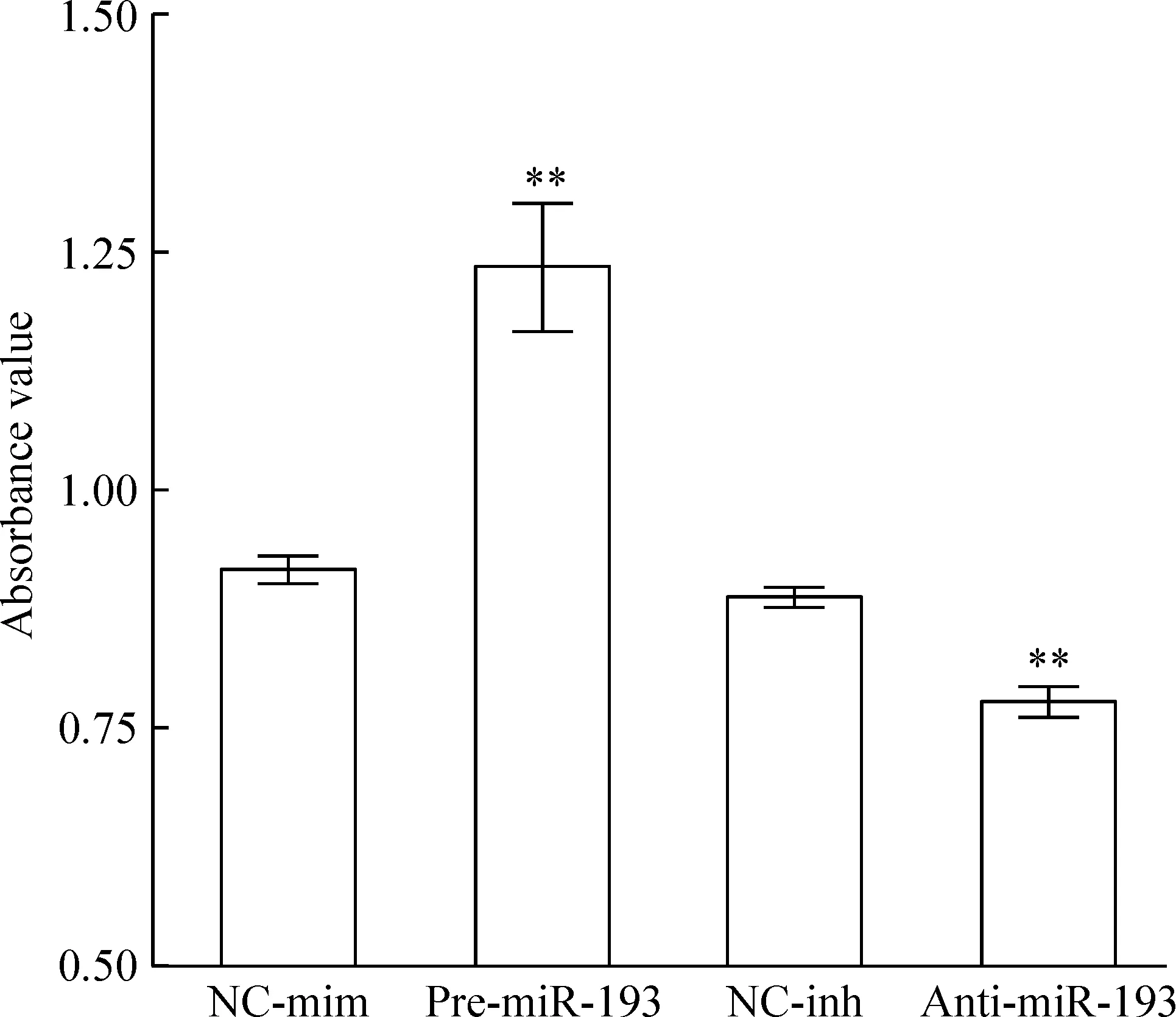
Figure 4. Effect of miR-193 on the proliferation of MSCs detected by BrdU incorporation assay after transfection for 24 h. Mean±SD.n=3.**P<0.01 vs NC-mim or NC-inh.
以上结果通过3种不同的方法,从不同层面证明了miR-193能够增强大鼠MSCs的增殖能力。
4 miR-193对MSCs凋亡水平的影响
miR-193抑制组的早期凋亡率要略低于对照组和过表达组,但各组间差异没有统计学意义(P>0.05);而miR-193过表达组的晚期凋亡水平要略高于对照组和抑制组,但各组间差异也无统计学意义(P>0.05),见图6。
5 miR-193调控细胞周期相关蛋白的表达
MSCs过表达miR-193能增加细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2, CDK2)mRNA的表达,相反抑制miR-193则下调CDK2 mRNA的表达(P<0.01)。此外,miR-193仅引起CDK2的表达改变,对于其它细胞周期相关蛋白的表达则没有显著影响,见图7。

Figure 5. Effect of miR-193 on the proliferation of MSCs detected by Ki-67 immunostaining (scale bars: 50 μm). Green fluorescence indicates Ki-67-positive cells. Mean±SD.n=3.*P<0.05 vs NC-mim or NC-inh.
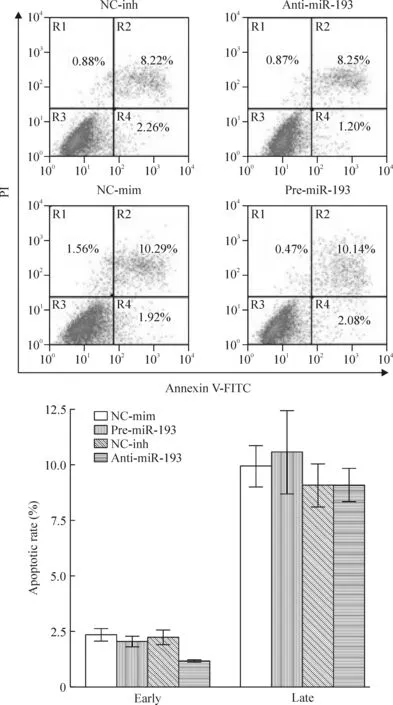
Figure 6. miR-193 couldn’t regulate the apoptosis of MSCs. Apoptosis of MSCs was detected by flow cytometry.Mean±SD.n=3.
讨 论
早在1960年,Hayflick就通过体外细胞培养实验发现MSCs与其它体细胞一样具有有限的增殖能力,这一现象被誉为Hayflick现象[5]。近期也有研究表明小鼠和人类的MSCs在长期的细胞培养过程中,它们的增殖能力随着代数的增加而减少[6]。如何提高MSCs的增殖能力对于提高细胞治疗的疗效起着重要的作用。
部分miRNA被发现与干细胞增殖能力相关,如在胚胎干细胞中敲除Dicer或Dgcr8这2种对于miRNA合成至关重要的酶,将导致胚胎干细胞增殖能力的明显降低;而miR-290家族则被证明能够促进胚胎干细胞增殖[7]。本研究通过对miR-193的过表达和抑制实验,使用3种检测方法,从不同层面证实miR-193能显著改变MSCs的增殖能力。为明确miR-193过表达后MSCs数量的增多是否是由miR-193对MSCs凋亡水平的调控引起的,本研究又通过流式细胞技术证明miR-193不影响MSCs的凋亡水平。
研究发现,miRNA能调控大量的细胞周期因子,进而调控细胞增殖[8]。在本研究中,使用qRT-PCR技术检测MSCs中部分细胞周期相关蛋白的表达,发现过表达miR-193能显著升高CDK2的表达水平。而CDK2在细胞增殖过程中起着关键作用,CDK/cyclin复合物能够调控细胞由G1期进入S期的过程[9],这一过程的长短正是细胞增殖能力强弱的表现[10]。另有文献报道,CDK2可能通过改变人类细胞对细胞生长因子的应答能力来调控细胞周期的转变,进而调控细胞的增殖能力[11]。因此推测miR-193调控MSCs增殖能力的功能可能是通过调控CDK2的表达来实现的。
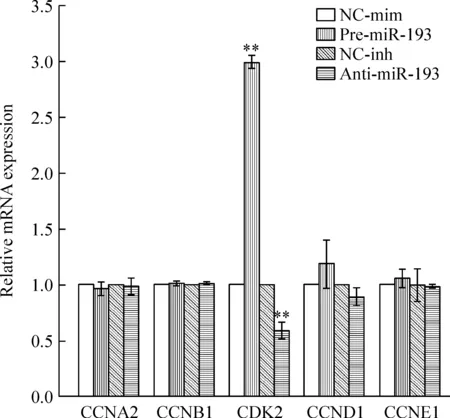
Figure 7. Effects of miR-193 on the mRNA expression of cell cycle-related proteins in MSCs detected by qRT-PCR. CCNA2:cyclin A2;CCNB1:cyclin B1;CDK2: cyclin-dependent kinase 2; CCND1:cyclin D1;CCNE1:cyclin E1.Mean±SD.n=3.**P<0.01 vs NC-mim or NC-inh.
综上所述,miR-193可能通过增强CDK2的表达,最终上调MSCs的增殖水平。
[参 考 文 献]
[1] Heil M, Ziegelhoeffer T, Mees B, et al. A different outlook on the role of bone marrow stem cells in vascular growth: bone marrow delivers software not hardware[J]. Circ Res, 2004,94(5):573-574.
[2] van der Spoel TI, Jansen of Lorkeers SJ, Agostoni P, et al. Human relevance of pre-clinical studies in stem cell therapy: systematic review and meta-analysis of large animal models of ischaemic heart disease[J]. Cardiovasc Res, 2011,91(4):649-658.
[3] Ambros V. The functions of animal microRNAs[J]. Nature, 2004,431(7006):350-355.
[4] Gangaraju VK, Lin H. MicroRNAs: key regulators of stem cells[J]. Nat Rev Mol Cell Biol, 2009,10(2):116-125.
[5] Hayflick L. The limitedinvitrolifetime of human diploid cell strains[J]. Exp Cell Res, 1965,37(3):614-636.
[6] Baxter MA, Wynn RF, Jowitt SN, et al. Study of telomere length reveals rapid aging of human marrow stromal cells followinginvitroexpansion[J]. Stem Cells, 2004,22(5):675-682.
[7] Wang Y, Baskerville S, Shenoy A, et al. Embryonic stem cell-specific microRNAs regulate the G1-S transition and promote rapid proliferation[J]. Nat Genet, 2008,40(12):1478-1483.
[8] Bueno MJ, Malumbres M. MicroRNAs and the cell cycle[J]. Biochim Biophys Acta, 2011,1812(5):592-601.
[9] Lim S, Kaldis P. Loss of Cdk2 and Cdk4 induces a switch from proliferation to differentiation in neural stem cells[J]. Stem Cells, 2012,30(7):1509-1520.
[10] Salomoni P, Calegari F. Cell cycle control of mammalian neural stem cells: putting a speed limit on G1[J]. Trends Cell Biol, 2010,20(5):233-243.
[11] Merrick KA, Wohlbold L, Zhang C, et al. Switching Cdk2 on or off with small molecules to reveal requirements in human cell proliferation[J]. Mol Cell, 2011,42(5):624-636.

