雌激素对子宫内膜异位症在位内膜间质细胞巨噬细胞移动抑制因子表达的调控作用*
王明珍, 裘月红, 穆 琳, 郑 伟
(1浙江省桐庐县第一人民医院妇产科,浙江 桐庐 311500; 2浙江大学医学院附属第二医院妇科,浙江 杭州 310009)
子宫内膜异位症(endometriosis,EM)是发生于女性生殖系统的一个具有侵袭性的良性病变[1],其发病率约为5%~15%[2],可引起多种形式的临床表现,治疗后复发率高,但其发病机制仍未完全阐明。EM又是一种雌激素依赖性疾病,雌二醇(estradiol,E2)在EM发病中作用已有大量研究[3]。李华军等[4]报道EM在位内膜细胞对E2的反应性有别于正常妇女子宫内膜细胞,处于一种超敏状态。EM在位内膜细胞对外源性E2刺激的超敏状态,可能在一定浓度的E2作用下,使逆流入盆、腹腔的内膜碎片易侵袭、形成新生血管及分裂增殖,最终形成病灶。我们以前的研究中发现巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)在EM在位内膜中表达增高,并与临床病理特征呈现相关性[5]。本研究通过原代培养分离EM与对照组子宫内膜间质细胞,观察雌激素对其分泌的MIF表达水平是否有影响, 以进一步探讨MIF在EM发生发展中的作用。
材 料 和 方 法
1 临床资料
所有病例均选自2009年3月至2010年12月在浙江大学医学院附属第二医院住院接受腹腔镜手术或开腹手术患者,均无内科合并症,术前3个月内未接受任何抗感染治疗和激素治疗并具有规则的月经周期,内异组共11例,患者年龄为24~46岁,平均(36±3)岁,均已有婚育史,手术方式为囊肿剔除或患侧附件切除术,术中同时刮取子宫内膜组织,术后病理诊断为卵巢子宫内膜异位囊肿患者。对照组:共12例,患者年龄为27~45岁,平均(37±4)岁,其中因不孕行腹腔镜检查者5例,因子宫肌瘤行子宫切除术者7例,并排除子宫腺肌病患者,手术过程中检查证实无EM病灶及炎症。2组患者年龄比较,差异无统计学意义(P>0.05)。该研究报浙江大学医学院附属第二医院伦理委员会批准,并通过患者知情同意。
2 方法
2.1标本处理 在无菌条件下刮取新鲜子宫标本的内膜组织,立即放入含2%FBS的DMEM/F12细胞培养液中,迅速低温转移至实验室操作。全部标本均留部分组织用10%甲醛液固定后进行病理学检查,内膜组织学检查均未发现病理改变, 其组织学分期与月经周期相符。
2.2子宫内膜间质细胞原代培养 将所获子宫内膜组织用PBS洗涤2~3次,用眼科剪将其剪成0.5 mm×1 mm×1 mm大小碎块后加入2倍组织体积的胶原酶Ⅰ(0.2%),37 ℃水浴箱振荡消化30 min;用2% FBS细胞培养液漂洗2~3次,加入2倍组织体积的消化酶Ⅱ(0.1%胶原酶+0.01%DNase)混合消化液, 37℃水浴箱振荡消化30 min;100目细胞筛过筛去除大块未消化组织,2%FBS细胞培养液漂洗2~3次,800 r/min离心10 min,去除上清液;沉淀、细胞筛过滤并收集通过滤网的细胞滤过液吸到离心管中,500 r/min离心,弃上清,将沉淀用D-Hanks液进行冲洗,再进行离心,反复进行2次后加入10%FBS DMEM/F12培养液,经0.4%台盼蓝染色以测定细胞活性并细胞计数后接种于培养板,置37 ℃、含5%CO2的培养箱内培养,24 h后观察细胞有无贴壁; 10%FBS细胞培养液终止消化;略吹打后收集细胞,细胞计数后接种于培养板;用2%FBS细胞培养液换液,待细胞融合率达到50%~60%时,加入含1%活性炭吸附血清的无酚红DMEM/F12培养基作用至细胞融合率达70%~80%时,分别加入10-7nmol/L E2,分别于培养6、12、24、48 h后收集细胞。对照组培养液内不加任何激素,对照组及各实验组均三皿平行,实验重复3次,培养24 h后收集细胞行RT-PCR及蛋白免疫印迹检测;其中一部分细胞接种至放有盖玻片的6孔板中同法培养,待细胞在玻片上铺成单层,取出玻片,用CD10为Ⅰ抗进行细胞免疫组化鉴定子宫内膜间质细胞,判断间质细胞的纯度,细胞纯度达90%以上则进行下一步实验。
2.3细胞免疫组化鉴定子宫内膜间质细胞 待盖玻片上的子宫内膜细胞基本铺成单层,自6孔板内取出盖玻片,用PBS洗3次;固定、PBS冲洗并浸泡其中3次;用非免疫动物血清以盖满载玻片为止,吸干血清后分别加入1∶100稀释的CD10抗体,并以PBS代替Ⅰ抗作阴性对照,室温孵育2 h;加入Ⅱ抗,室温孵育30 min;DBA显色,作用2~5 min,(显微镜下控制)后PBS冲洗干净,吸干; 苏木素复染,中性树脂封片;显微镜下观察。
2.4RT-PCR检测MIF mRNA表达 取RNA提取液2 μL,加入98 μL RNase-free纯水混匀,DU-640紫外分光光度仪测A260/A280,检测核酸纯度,计算核酸量。逆转录合成cDNA后 PCR扩增,引物序列见表1。为控制实验操作时的加样误差和各反应管扩增效率的差异,设立GAPDH作为内参照,并把循环周期控制在扩增反应线性期。取10 μL PCR产物,加6×凝胶电泳加样缓冲液2 μL,混匀后经2%琼脂糖凝胶(含0.5 g/L溴化乙啶)电泳,紫外线下拍照,Kodak EDAS 290成像系统摄像,KodakID 3.5软件系统测DNA条带的灰度,目的条带灰度与GAPDH条带灰度的比值为标本MIF mRNA的相对表达量。

表1 PCR引物序列
2.5蛋白免疫印迹法检测MIF蛋白表达 刮取收集细胞,PBS冲洗3遍,600×g离心10 min,置液氮10 min后,-80 ℃冰箱内保存;提取蛋白,分装,置-80 ℃冰箱内保存;蛋白质定量分析:灌胶、电泳、电转、封闭、弃去封闭液,立即加入I抗稀释液与硝酸纤维素膜一起孵育(抗MIF抗体稀释度为1∶200,β-actin稀释度为1∶400),混合显色A、B液各2 mL,5 min后将其与硝酸纤维素膜孵育1 min,放射自显影,曝光3~5 min,冲洗胶片;将放射自显影条带进行扫描,用Bio-Rad公司的Quantity One分析软件对显影条带进行灰度分析,将目的条带灰度与β-actin灰度的比值作为目的蛋白相对表达量。
3 统计学处理
采用SPSS 10.0统计软件分析。资料正态性用Kolmogorov-Smirnov检验,方差齐性用Levene检验。经检验所有数据均呈正态或近似正态分布,方差均具有齐同性,数据用均数±标准差(mean±SD)表示。采用One-way ANOVA对MIF表达水平进行比较,如有统计学意义,再行组内两两Bonferroni检验。以P<0.05为差异有统计学意义。
结 果
1 培养细胞形态特点
子宫内膜间质细胞接种30 min后开始贴壁,24 h后已完全贴壁。多呈梭形,偶见多角形,胞质薄而透明,核呈椭圆形,易出现平行排列生长,48 h内可见分散生长,3 d后亦出现并行排列生长。培养到5 d,细胞排列紧密,并融合成片,细胞多为纺锤形或多角形,边界清楚,胞体透明,胞浆中颗粒丰富,核大而圆,核仁明显,细胞铺满瓶底后用消化液传代。传代后细胞外形多呈梭形,贴壁快。免疫组化染色,90%以上的细胞CD10呈阳性染色,见图1。

Figure 1. Immunohistochemical identification of the cultured endometrial stromal cells (×400). A: negative control; B: CD10 positive.
2 E2对正常子宫内膜间质细胞中MIF表达的调节
RT-PCR产物琼脂糖凝胶电泳结果显示,组织标本中MIF mRNA扩增产物为620 bp,GAPDH为452 bp。目的条带与内参照比较,进行半定量分析,其相对表达量均符合正态分布。蛋白免疫印迹结果显示,所有的细胞标本中均在43 kD处检测到内参照β-actin,其表达强度基本一致,处理组和对照组细胞中均能检测到MIF。子宫内膜间质细胞经E2作用24 h后MIF mRNA及蛋白水平明显增高(P<0.05),见图2、3。
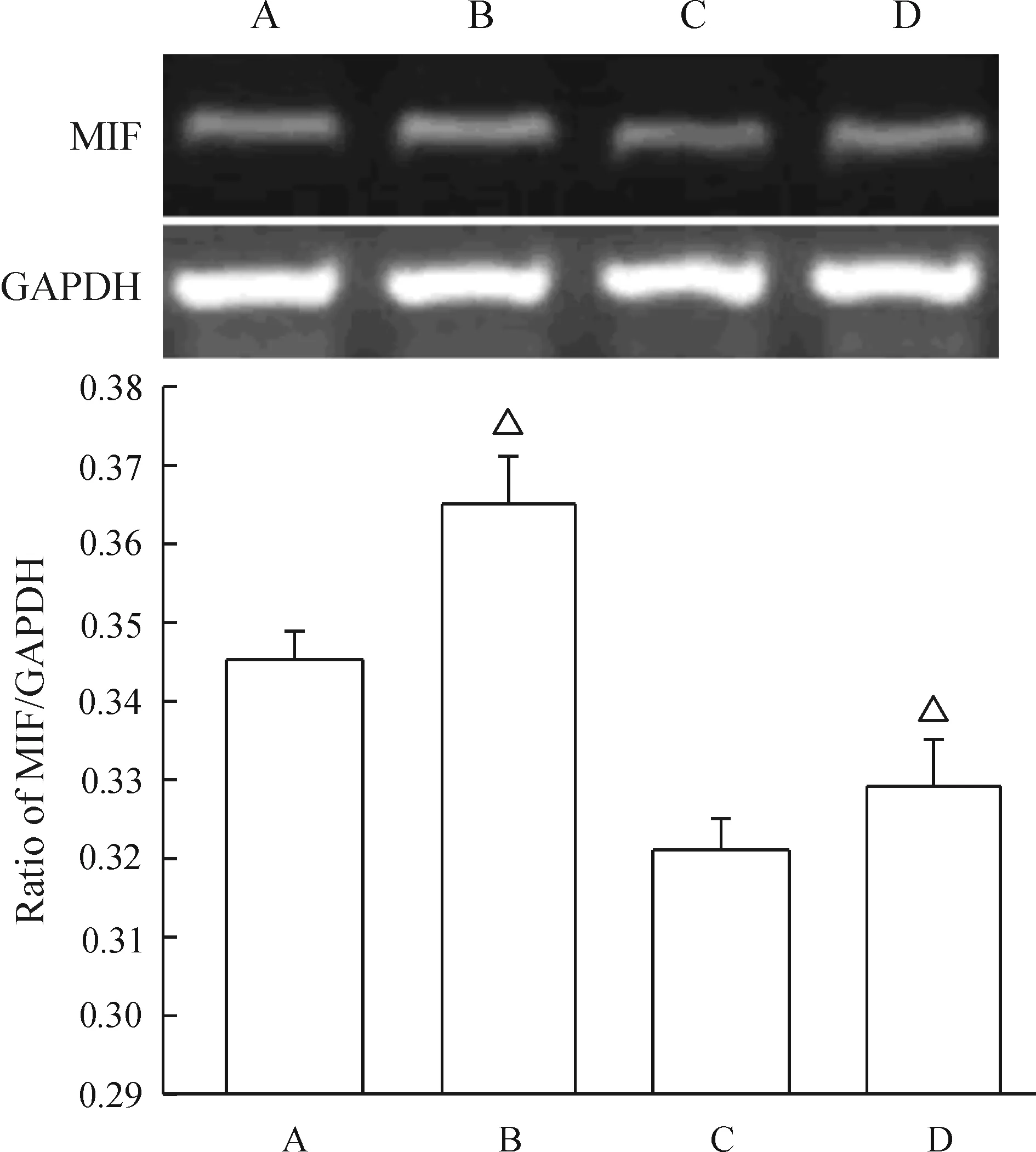
Figure 2. MIF mRNA expression in cultured endometrial stromal cells was assessed by RT-PCR. A: cultured endometrial stromal cells from EM (no estrogen); B: cultured endometrial stromal cells from EM (treated with estrogen);C: cultured endometrial stromal cells from women with EM(no estrogen); D: cultured endometrial stromal cells from women without EM (treated with estrogen).Mean±SD. n=3.△P<0.05 vs A or C.
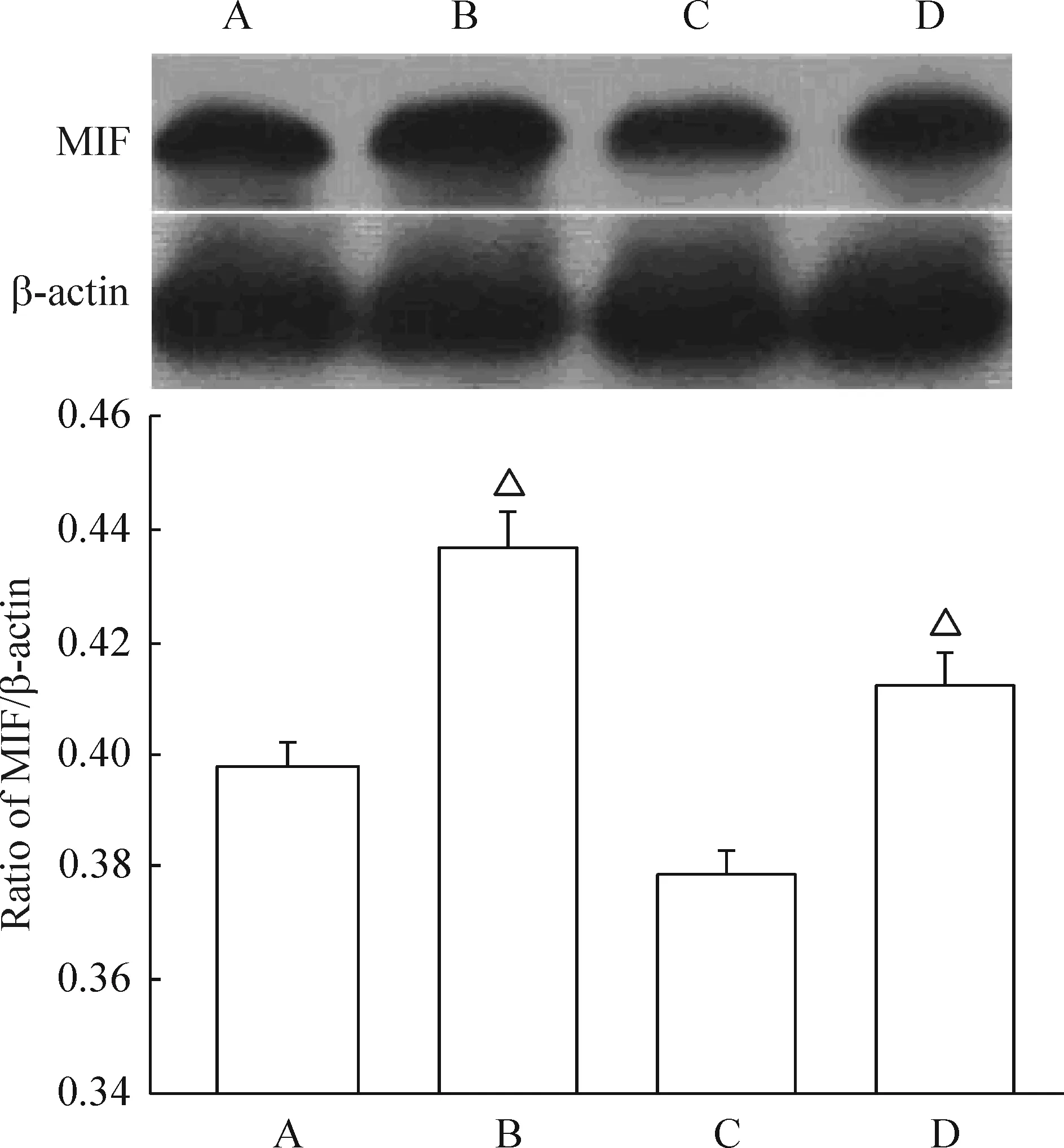
Figure 3. MIF protein expression in cultured endometrial stromal cells was assessed by Western blotting. A: cultured endometrial stromal cells from EM (no estrogen); B: cultured endometrial stromal cells from EM (treated with estrogen); C: cultured endometrial stromal cells from women with EM (no estrogen); D: cultured endometrial stromal cells from women without EM (treated with estrogen).Mean±SD.n=3.△P<0.05 vs A or C.
3 在位内膜间质细胞中MIF表达对雌激素的反应
E2作用后MIF表达水平减去空白对照组MIF表达水平为E2作用后细胞MIF蛋白上调水平,MIF蛋白上调水平(0.037±0.005)明显高于正常组(0.031±0.003)(P<0.01)。
讨 论
雌激素诱导细胞变化可以通过不同的机制,其核心是与雌激素结合的雌激素受体(estrogen receptor,ER),雌激素弥散入细胞,与位于细胞核上的ER结合形成雌激素-ER复合物,该复合物与雌激素反应元件通过蛋白质与雌激素应答基因启动子区域的激活蛋白因子或特异性β1糖蛋白直接或间接相互作用,导致共调节蛋白(共激活剂或共抑制剂)对启动子的作用恢复,调节mRNA水平和相关蛋白的形成以及相应的生理反应。该过程发生需要数小时的时间,是雌激素的“经典机制”或“基因组机制”。雌激素还可以在更短的时间内(几秒或几分钟)通过非基因机制起作用,通过局部的ER或者细胞膜间的连接或其它和雌激素结合有关的非细胞膜上的ER,引起细胞反应。本研究通过建立体外子宫内膜间质细胞培养体系,消除体内各种复杂因素影响,发现体外培养的子宫内膜间质细胞在给予不同药物刺激时,其MIF mRNA和蛋白的表达量有所变化,子宫内膜间质细胞经雌激素作用24 h后MIF mRNA及蛋白水平明显增高。关于雌激素对子宫内膜间质细胞MIF表达影响本研究仅仅做了初步探索,其具体信号途径尚需进一步探讨。
本研究发现EM在位内膜间质细胞在雌激素作用后MIF水平上调并高于正常组,提示EM在位内膜间质细胞中MIF的表达对雌激素的刺激更加敏感。有研究认为EM是一种激素依赖性疾病,多发生于中青年妇女,雌激素在EM发病中的作用已有大量研究[3],但患者体内的雌激素水平并不高于正常水平。李华军等[4]曾经报道EM在位内膜细胞对雌二醇的反应性有别于正常妇女子宫内膜细胞,在EM体外细胞模型上直接观察到雌激素有刺激血管内皮生长因子、金属基质蛋白酶分泌和促进细胞增殖、抑制细胞凋亡的作用,影响的程度均强于正常妇女的子宫内膜细胞,即EM在位内膜细胞对外源性雌激素的刺激处于一种超敏状态。我们的研究结果显然也验证了EM内膜间质细胞对雌激素的超敏状态。关于在EM形成这种状态的机制,Bulun等[3]研究发现雌激素刺激RM在位内膜细胞前列腺素E2(prostaglandin E2, PGE2)合成,PGE2又刺激这些细胞中芳香化酶P450的活性,使其合成更多的雌激素,形成一个正反馈,外源性雌激素触发了这一反馈,而正常妇女子宫内膜没有这种机制。EM在位内膜细胞对外源性雌激素刺激的超敏状态,可能至少部分归因于这种正反馈,从而在一定浓度的雌激素作用下,EM在位内膜MIF表达增高,使逆流入盆、腹腔的内膜碎片易侵袭、形成新生血管及分裂增殖,最终形成异位病灶[6]。
根据本实验中EM对雌激素刺激表现出来的差异,推测EM子宫内膜间质细胞中MIF的表达对雌激素的刺激呈现超敏状态,由此使子宫内膜间质细胞内MIF表达升高,进而促进了EM的发生发展,该结果可能为临床EM的治疗提供了新的思路和方法。
[参 考 文 献]
[1] Bulletti C, Flamigni C, de Ziegler D. Implantation mar-kers and endometriosis[J]. Reprod Biomed Online, 2005,11(4):464-468.
[2] Strathy JH, Molgaard CA, Coulam CB, et al. Endometriosis and infertility: a laparoscopic study of endometriosis among fertile and infertile women[J]. Fertil Steril,1982,38(6):667-672.
[3] Bulun SE, Cheng YH, Yin P, et al. Progesterone resis-tance in endometriosis: link to failure to metabolize estra-diol[J]. Mol Cell Endocrinol, 2006, 248(1-2): 94-103.
[4] 李华军, 郎景和, 刘珠凤,等. 子宫内膜异位症在位内膜细胞对雌二醇超敏状态的研究[J]. 现代妇产科进展,2007,16(6):449-452.
[5] 裘月红, 穆 琳, 王 良,等. 巨噬细胞移动抑制因子在子宫内膜异位症患者在位子宫内膜中的表达及其意义[J]. 中华妇产科学杂志, 2007,42(12):856-858.
[6] 李洪义, 郑 辉, 段 山,等. 内异症子宫内膜ER、PR 基因表达的研究[J].中国病理生理杂志, 2003, 19(4): 529-532.

