血管紧张素II通过细胞外信号调节激酶1/2通路调控过氧化氢酶的表达及促进成纤维细胞表型转化*
沈 凯, 陈 芬, 林卓明, 陈士良, 袁国裕, 刘晓光△
(温州医科大学附属舟山医院 1心血管内科, 2细胞分子生物学实验室,浙江 舟山 316004)
血管重塑是指血管内径和血管壁厚度的适应性变化,是高血压病显著病理特征和并发症产生的主要原因[1]。研究发现病理状态下血管外膜可产生大量活性氧(reactive oxygen species, ROS),通过自分泌、旁分泌作用参与血管重塑发生。而过氧化氢酶(catalase, CAT)在清除ROS中发挥重要作用,病理情况下,CAT表达和活性受到抑制,机体的氧化-抗氧化系统的平衡遭到破坏,大量ROS蓄积就导致病理性血管重塑[2]。
血管紧张素II (angiotensin II, Ang II)是引起高血压性血管重塑的重要介质,研究表明细胞外调节蛋白激酶1/2(extracellular regulated protein kinase 1/2, ERK1/2)信号通路在Ang II诱导的氧化应激反应中发挥着重要作用,通过下调血管成纤维细胞内CAT的表达和活性,导致H2O2大量蓄积、细胞发生表型转化[3-4]。本文通过对大鼠高血压模型的研究显示Ang II通过ERK1/2通路调节CAT表达,从而在高血压大鼠模型动脉外膜成纤维细胞表型转化中发挥了作用,为高血压血管重塑的防治提供新的理论依据。
材 料 和 方 法
1 材料
1.1主要试剂和材料 150~200 g清洁级SD大鼠购自上海斯莱克实验动物有限公司。Alzet微泵(型号2002)。血管紧张素Ⅱ、CAT抗体(鼠来源)和α-actin抗体购自Sigma。ERK1/2抑制剂PD98059购自碧云天公司。DMEM高糖培养基及胎牛血清购自Gibco。小动物无创尾动脉血压测量仪(Softron BP98A)。
1.2动物分组 SD大鼠150~200 g 18只,随机分为3组,每组6只,分为未处理组(对照组)、Ang II灌注组(500 ng·kg-1·min-1)和生理盐水对照组。
2 主要方法
2.1动物模型制备 SD大鼠用10%水合氯醛腹腔注射麻醉后,背部埋入预置AngⅡ或生理盐水的微量泵,逐次缝合皮下及皮肤。连续灌注14 d,分别在0、3、7和14 d利用Softron BP98A 尾动脉血压测量仪测定安静状态下的大鼠尾动脉收缩压。每次测量至少5次,取平均值。
2.2细胞培养 处死大鼠后,取胸主动脉,放入盛有DMEM 的培养皿中。仔细分离血管周围结缔组织,纵向剖开血管。在另一培养皿中放少量培养液,仔细分离内膜、中膜和外膜。在另一培养皿中滴加1滴胎牛血清,将外膜剪成大约1 mm×1 mm×1 mm大小的组织块。添加含20%胎牛血清的 DMEM 培养液,放置 5% CO2、37 ℃培养箱培养。5~7 d后细胞 80%~90%融合时用0.25%胰蛋白酶消化,传代。取4~7代用于实验。分别用4种方法进行培养:(1) 不特殊处理培养24 h;(2) 单纯Ang II(10-7mmol/L)培养24 h;(3) PD98059(10-5mmol/L)培养24 h;(4)Ang II+PD98059(10-5mmol/L)培养24 h。
2.3血管形态学检测 在Ang II灌注后14 d行4%多聚甲醛灌注,取颈动脉常规固定、石蜡包埋制备石蜡切片。之后分别行HE染色检测血管形态学改变。
2.4Western blotting 培养的血管外膜成纤维细胞按上述分组后干预24 h,提取细胞总蛋白后进行聚丙烯酰胺凝胶电泳,转膜。5%脱脂牛奶封闭2 h,Ⅰ抗(CAT:1∶1 000;β-actin:1∶5 000) 4 ℃孵育过夜,第2天复温后加HRP标记的Ⅱ抗孵育1 h,之后用ECL发光液显影。利用Gelpro32软件进行定量分析。
3 统计学处理
数据用SPSS 16.0软件包分析。数据用均数±标准差(mean±SD)表示,多组间两两比较用单因素方差分析检验,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠尾动脉收缩压变化情况
分别于Ang II灌注之前及灌注后3 d、7 d、14 d测量大鼠尾动脉血压。在灌注之前,各实验组大鼠的尾动脉收缩压无显著差异。灌注3 d后Ang II灌注组其尾动脉收缩压水平持续升高,而对照组及生理盐水组收缩压未有明显改变,Ang II灌注组与其余2组相比,差异有统计学意义(P<0.05,P<0.01),见表1。
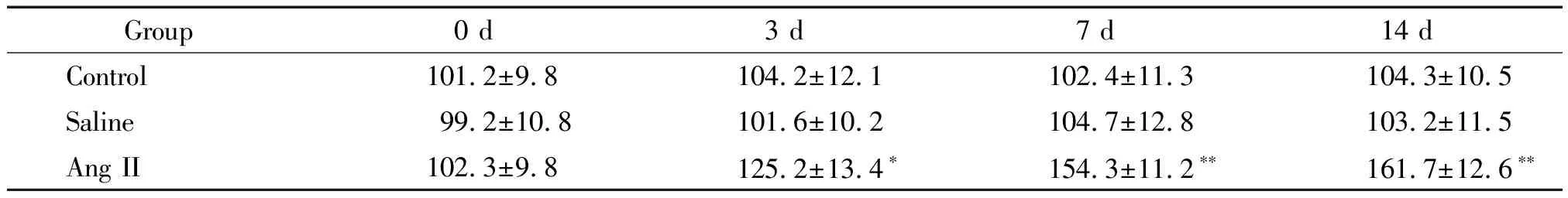
表1 各组大鼠的血压变化情况
2 SD大鼠颈动脉形态学变化情况
在灌注14 d后用HE染色检测各组大鼠颈动脉中膜厚度。Ang II灌注后能够使颈动脉中膜厚度显著增厚,与对照组及生理盐水组相比差异有统计学意义(P<0.01),见图1。这表明Ang II能够显著促进血管重塑的发生。

Figure 1. HE staining of carotid and determination of media thickness (×100). A: control group; B: saline group; C: Ang II group.Mean±SD.n=3. **P<0.01 vs control.
3 Ang II通过ERK1/2通路调控CAT表达及促进表型转化
4种方法培养外膜成纤维细胞24 h后用Western blotting检测CAT,发现单纯Ang II培养中外膜成纤维细胞CAT蛋白明显高于未特殊处理的对照培养组(P<0.05)。给予ERK1/2信号抑制剂PD98059后,外膜成纤维细胞CAT蛋白明显高于单纯Ang II培养(图2),同时也降低了α-actin的表达(图3),这表明Ang II通过ERK1/2信号通路下调抗氧化酶CAT的表达,进而促进成纤维细胞的表型转化。
讨 论
既往关于血管重塑的研究主要集中于血管内膜的内皮细胞和中膜的血管平滑肌细胞,却忽略了血管外膜改变在重塑形成中的作用,但越来越多的研究证明血管外膜在各种血管重塑过程中发挥着重要作用[5],Schulze-Bauer等[6]在研究人类血管外膜的力学特征时发现血管外膜对血管的塑形起重要作用。血管外膜受到损伤等因素刺激时能够释放多种血管活性物质(IL-6、MCP-1等)刺激细胞增殖、迁移等病理变化[7]。
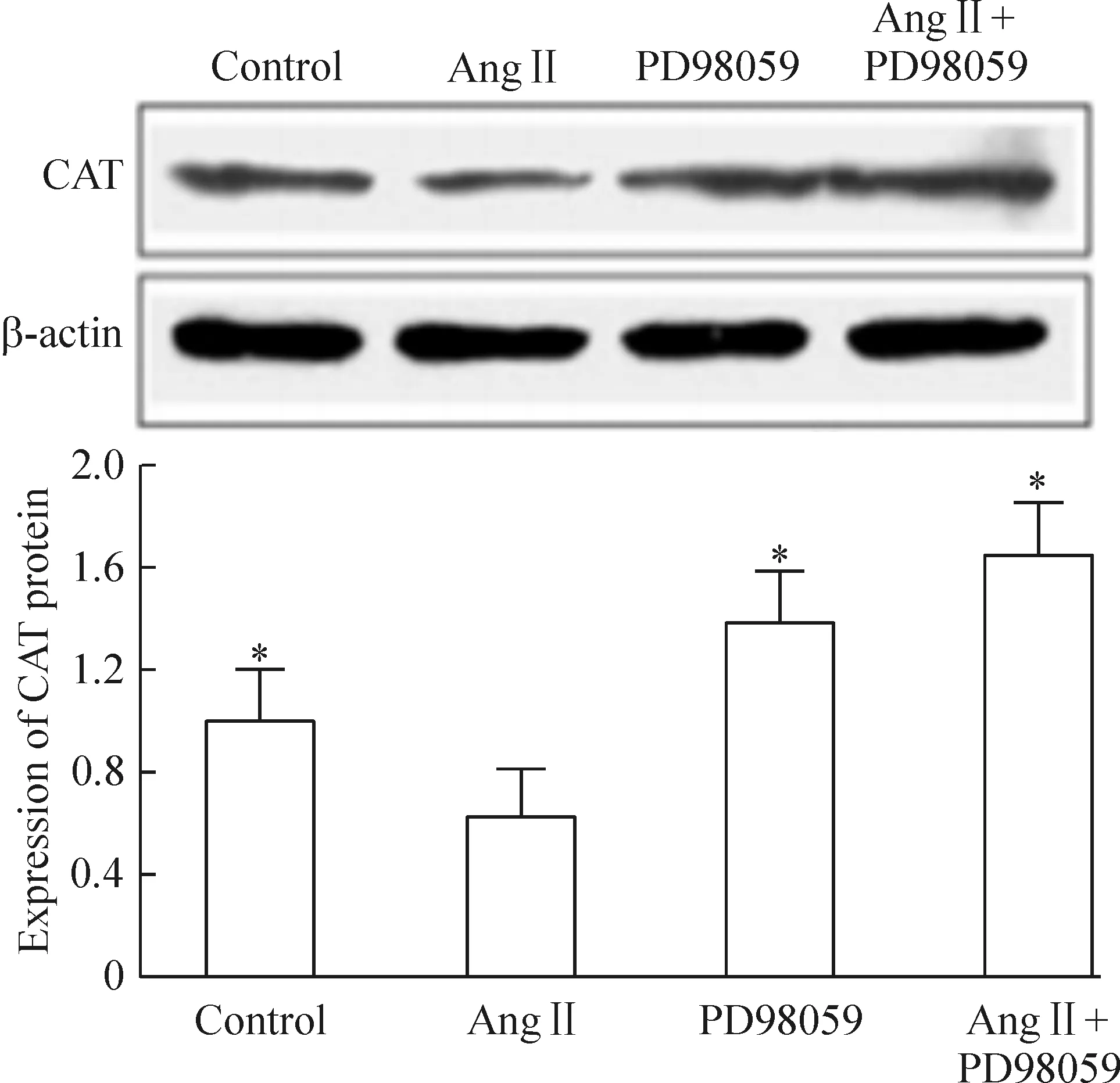
Figure 2. The expression of CAT was regulated by Ang II through ERK1/2 pathway.Mean±SD.n=3. *P<0.05 vs Ang II.
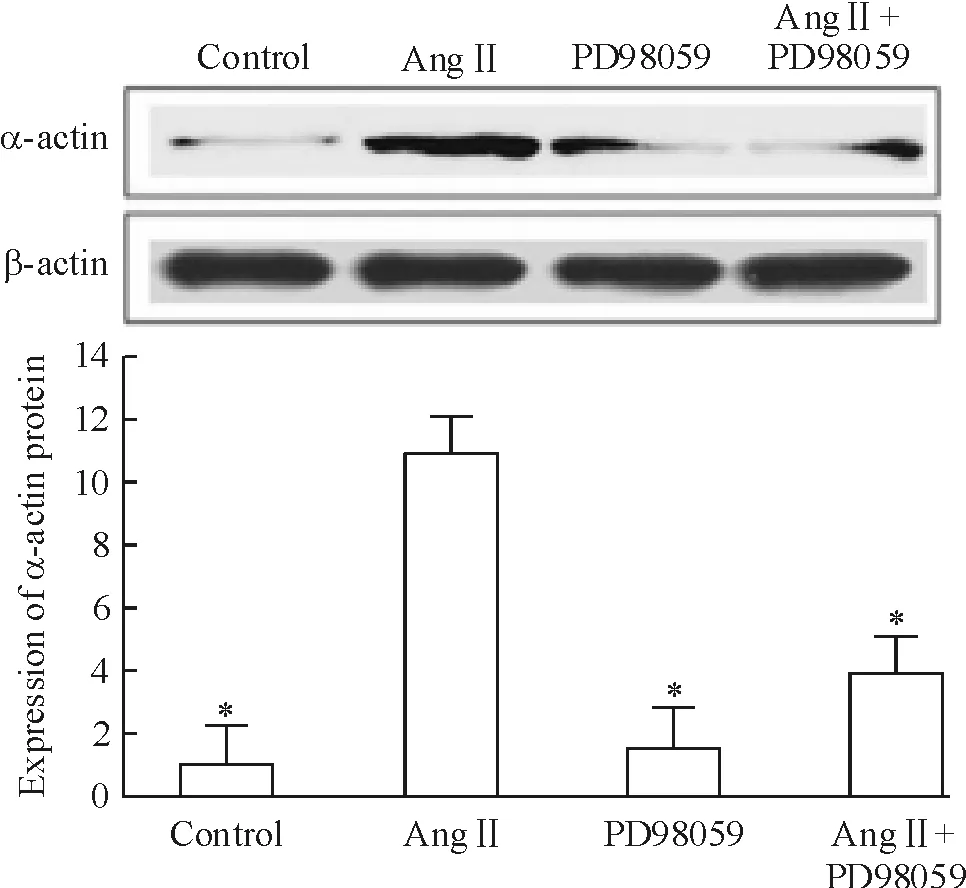
Figure 3. The expression of α-actin was regulated by Ang II through ERK1/2 pathway.Mean±SD.n=6. *P<0.05 vs Ang II.
Ang II有2个受体,即血管紧张素II 1型受体(angiotensin II type 1 receptor, AT1R)和血管紧张素II 2型受体(angiotensin II type 2 receptor, AT2R),Ang II可通过作用于AT1R受体使血管平滑肌细胞蛋白激酶C 2α亚类和ERK1/2表达增高,Gorin等[8]发现在AngⅡ通过AT1受体诱导的系膜细胞增殖与肥大中,ERK1/2起了非常重要的作用。另外,外膜成纤维细胞也是产生ROS主要位点之一[2]。ROS是Ang II 等各种病理要素引起血管病变的重要病理生理机制。Nakamura等[9]的研究显示抗氧化剂可减弱Ang II引起的血管细胞表型转化,并证明Ang II引起细胞表型转化的部分原因是产生ROS。后证明Ang II通过NAPD/NAPDH氧化酶导致超氧化物的产生[10]。ROS作为信号转导通路的重要环节,进一步可激活MAPK途径和上调IL-6而导致细胞转型[11]。但既往研究主要从ROS的产生及氧化酶方面对Ang II等诱导的细胞转型进行了探讨。很少有从机体抗氧化系统的角度进行分析,而本研究正是着眼于Ang II通过ERK1/2信号通路介导调控CAT的表达在高血压血管重塑中的作用。本研究结果表明,在Ang II刺激下大鼠收缩压和血管中膜厚度明显增加,说明血管发生形态改变。而且Ang II能磷酸化ERK1/2下调CAT并促进外膜成纤维细胞α-actin的升高,表达外膜成纤维细胞在向肌成纤维细胞转化,进而促进血管重塑的发生。此外,给以ERK1/2信号通路抑制剂PD98059后能够阻断Ang II诱导的CAT下调及外膜成纤维细胞的表型转化,证实Ang II是可通过ERK1/2信号通路介导调控CAT的表达变化及细胞表型转化,提示恢复抗氧化系统的表达能够显著改善Ang II诱导的高血压性血管重塑。
综上所述,本研究证实过氧化氢酶CAT及ERK1/2参与了Ang II诱导的血管重塑过程,Ang II导致的氧化/抗氧化体系的失衡是导致血管重塑的重要原因,这为高血压及其并发症的防治提供了新的理论思路和潜在的治疗靶点。
[参 考 文 献]
[1] Briet M, Schiffrin EL. Treatment of arterial remodeling in essential hypertension[J]. Curr Hypertens Rep, 2013, 15(1): 3-9.
[2] Shi Y, Niculescu R, Wang D, et al. Increased NAD(P)H oxidase and reactive oxygen species in coronary arteries after balloon injury[J]. Arterioscler Thromb Vasc Biol, 2001, 21(5): 739-745.
[3] Han C, Liu J, Liu X, et al. Angiotensin II induces C-reactive protein expression through ERK1/2 and JNK signaling in human aortic endothelial cells[J]. Atherosclerosis, 2010, 212(1): 206-212.
[4] 何建桂, 黄艺仪, 马 虹, 等. 血管紧张素-(1-7) 对心肌肥厚的影响及其与细胞外信号调节激酶的关系[J]. 中国病理生理杂志, 2005, 21(9): 1713-1716.
[5] Shi Y, O’Brien JE, Fard A, et al. Adventitial myofibroblasts contribute to neointimal formation in injured porcine coronary arteries[J]. Circulation, 1996, 94(7): 1655-1664.
[6] Schulze-Bauer CA, Regitnig P, Holzapfel GA. Mechanics of the human femoral adventitia including the high-pressure response[J]. Am J Physiol Heart Circ Physiol, 2002, 282(6): H2427-H2440.
[7] Tieu BC, Ju X, Lee C, et al. Aortic adventitial fibroblasts participate in angiotensin-induced vascular wall inflammation and remodeling[J]. J Vasc Res, 2011, 48(3): 261-272.
[8] Gorin Y, Ricono JM, Wagner B,et al. AngiotensinⅡ-induced ERK1/2 activation and protein synthesis are redox-dependent in glomerular mesangial cells[J]. Biochem J, 2004, 381(Pt 1): 231-239.
[9] Nakamura K, Fushimi K, Kouchi H, et al. Inhibitory effects of antioxidants on neonatal rat cardiac myocyte hypertrophy induced by tumor necrosis factor-alpha and angiotensin II[J]. Circulation, 1998, 98(8): 794-799.
[10] Ito N, Ohishi M, Yamamoto K, et al. Renin-angiotensin inhibition reverses advanced cardiac remodeling in aging spontaneously hypertensive rats[J]. Am J Hypertens, 2007, 20(7): 792-799.
[11] Sano M, Fukuda K, Sato T, et al. ERK and p38 MAPK, but not NF-κB, are critically involved in reactive oxygen species-mediated induction of IL-6 by angiotensin II in cardiac fibroblasts[J]. Circ Res, 2001, 89(8): 661-669.

