苦参碱对人髓母细胞瘤D341细胞凋亡及相关蛋白表达的影响*
周开宇, 毛天明, 陈 茜, 罗永康
(台州学院医学院附属台州市立医院,复旦大学附属华山医院台州分院神经外科, 浙江 台州318000)
髓母细胞瘤是一种高度恶性呈浸润性生长的颅内肿瘤,好发于儿童,偶见于成年,目前以显微手术切除为主辅以放疗、化疗等综合治疗[1];但3岁以下儿童患者放疗会严重影响发育,化疗毒副作用比较严重,仍有30%~50% 的患儿治疗效果极差,预后非常不良[2]。因此寻找一种对人髓母细胞瘤有效的抗瘤药物,有重要的现实意义。
恶性肿瘤的生长、发展与细胞凋亡密切相关,抗肿瘤药物诱导肿瘤细胞的凋亡是对肿瘤细胞作用的主要方面。苦参碱是苦参、苦豆子、广豆根等豆科槐属植物中生物碱的主要成分,具有良好的药理活性,能利尿解毒、清热利湿、退黄降酶、抗心律失常等作用,且无明显的毒副作用。近期的研究表明,苦参碱具有抗肿瘤的效应,能抑制胆囊癌、前列腺癌等恶性肿瘤细胞的增殖,诱导肿瘤细胞的凋亡[3-4]。但是对于苦参碱作用于人髓母细胞瘤细胞的研究却少有报道,目前也不清楚苦参碱是否会抑制该瘤细胞的增殖,以及分子作用机制。因此本研究主要通过体外实验来研究苦参碱对人髓母细胞瘤D341细胞的诱导凋亡作用,并探讨相关蛋白Bax、Bcl-2、丝氨酸/苏氨酸激酶Akt和磷酸化Akt(phosphorylated Akt, p-Akt)在苦参碱作用下表达的改变,为人髓母细胞瘤的发病及药物治疗提供重要的理论依据。
材 料 和 方 法
1 材料
本研究中苦参碱由宁波天衡制药有限公司提供,规格为 50 mg∶5 L。 D341细胞株由北京协和医院细胞库提供,Bax、 Bcl-2、Akt、p-Akt抗体、CCK-8和Annexin V-FITC试剂盒均由上海蓝基生物科技有限公司提供,透射电子显微镜(JEM-1011)。
2 方法
2.1细胞培养 将D341细胞置于含10%胎牛血清和1%青霉素-链霉素的RPMI-1640培养液中,并于37 ℃、5%CO2、饱和湿度的恒温培养箱中培养;每2~3 d换1次液、每7 d左右传代1次。
2.2CCK-8法检测细胞增殖 将细胞消化、计数、配制成浓度为5×107cells/L的细胞悬液,96孔细胞培养板中每孔加入100 μL细胞悬液;将培养板置于37 ℃、5%CO2培养箱中培养24 h;弃去培养基,PBS清洗2次,用培养基稀释苦参碱至所需浓度(0.5 g/L、1.0 g/L、1.5 g/L和2.0 g/L),每孔加入200 μL相应的含药培养基,同时设立阴性对照组;再将培养板置于37 ℃、5% CO2培养箱中培养24、48和72 h;向每孔中加入10 μL CCK-8,继续培养3 h;摇床10 min轻轻混匀;酶标仪在波长450 nm读出每孔的吸光度(A),计算抑制率。
2.3细胞超微结构观察 将经体外培养的D341细胞分为实验组和对照组。其中实验组加入苦参碱浓度为2.0 g/L,对照组不加苦参碱。苦参碱作用24、48和72 h后分别离心(1 000 r/min,5 min)收集细胞,冷PBS洗涤2次;2.5%戊二醛固定48 h、1%饿酸再固定90 min,乙醇-丙酮梯度脱水,包埋,烘箱内固化,切片,透射电镜下观察。
2.4Annexin V-FITC/PI双染法检测细胞凋亡 将对数生长期的细胞消化接种到6孔板中,次日,根据组别设置加入用完全培养基稀释药物至所需浓度(0.5 g/L、1.0 g/L、1.5 g/L和2.0 g/L),同时设立阴性对照组;药物作用24 h、48 h和72 h后,消化收集细胞;用PBS洗涤细胞2次(2 000 r/min离心5 min)收集5×105细胞;加入500 μL Binding Buffer悬浮细胞;然后再加入5 μL Annexin V-FITC混匀后,加入5 μL PI,混匀;室温、避光、反应5~15 min;用流式细胞术检测细胞的凋亡情况。
2.5Western blotting检测瘤细胞Bax、Bcl-2、Akt和p-Akt蛋白的表达 取对数生长期的D341细胞接种于24孔板中,每孔200 μL,细胞密度为2×108/L,待细胞贴壁生长后实验进行分4组。苦参碱组:加入苦参碱浓度分别为0.5 g/L、1.0 g/L、1.5 g/L和2.0 g/L;对照组除不加苦参碱,其余条件完全一致。各组分别再培养24 h、48 h和72 h,收集各组细胞。加入100 mL预冷的细胞裂解液,冰上裂解30 min,提取细胞总蛋白,以BCA法进行蛋白浓度的定量测定。常规制胶、上样,蛋白电泳,然后转膜,封闭。用Ⅰ抗稀释液 4 ℃孵育过夜:Bax (1∶5 000)、Bcl-2 (1∶1 000)、Akt(1∶1 000)、p-Akt(1∶500)和β-actin(鼠抗1∶1 000)。TBST洗膜 3次, 每次10 min。将膜与HRP结合的Ⅱ抗(辣根过氧化酶标记羊抗兔;1∶5 000)室温下摇荡孵育2 h, TBST充分洗膜,漂洗3次,每次10 min。化学发光显色,暗盒中曝光,再显影和定影,应用凝胶扫描仪对胶片进行光密度扫描,并以β-actin为内参照。
3 统计学处理
采用SPSS 17.0统计软件处理,数据以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,两两比较用LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1 苦参碱对D341细胞增殖的抑制作用
CCK-8法显示,在同一作用时间下,不同浓度的苦参碱对D341细胞增殖的抑制程度不同,单因素方差分析显示任意两组间的差异均有统计学意义(P<0.01),在此次检测的范围内,相同作用时间下D341细胞的增殖抑制率随药物浓度的增加而逐渐升高,并呈现一定的剂量依赖性;同一浓度的苦参碱对D341细胞增殖的抑制程度随着作用时间延长而增强,特别是苦参碱浓度在1.5 g/L和2.0 g/L时,其作用更明显,见图1。
2 苦参碱对D341细胞作用下细胞超微结构的观察
苦参碱(2.0 g/L)作用于人髓母细胞瘤细胞24 h、48 h和72 h后,在透射电镜下观察细胞的超微结构的改变。结果显示,苦参碱诱导后细胞凋亡变化明显,随着诱导时间增加,染色质趋边固缩,胞浆中空泡增多、变大,并且出现凋亡小体。阴性对照组细胞核及染色质分布正常,见图2。
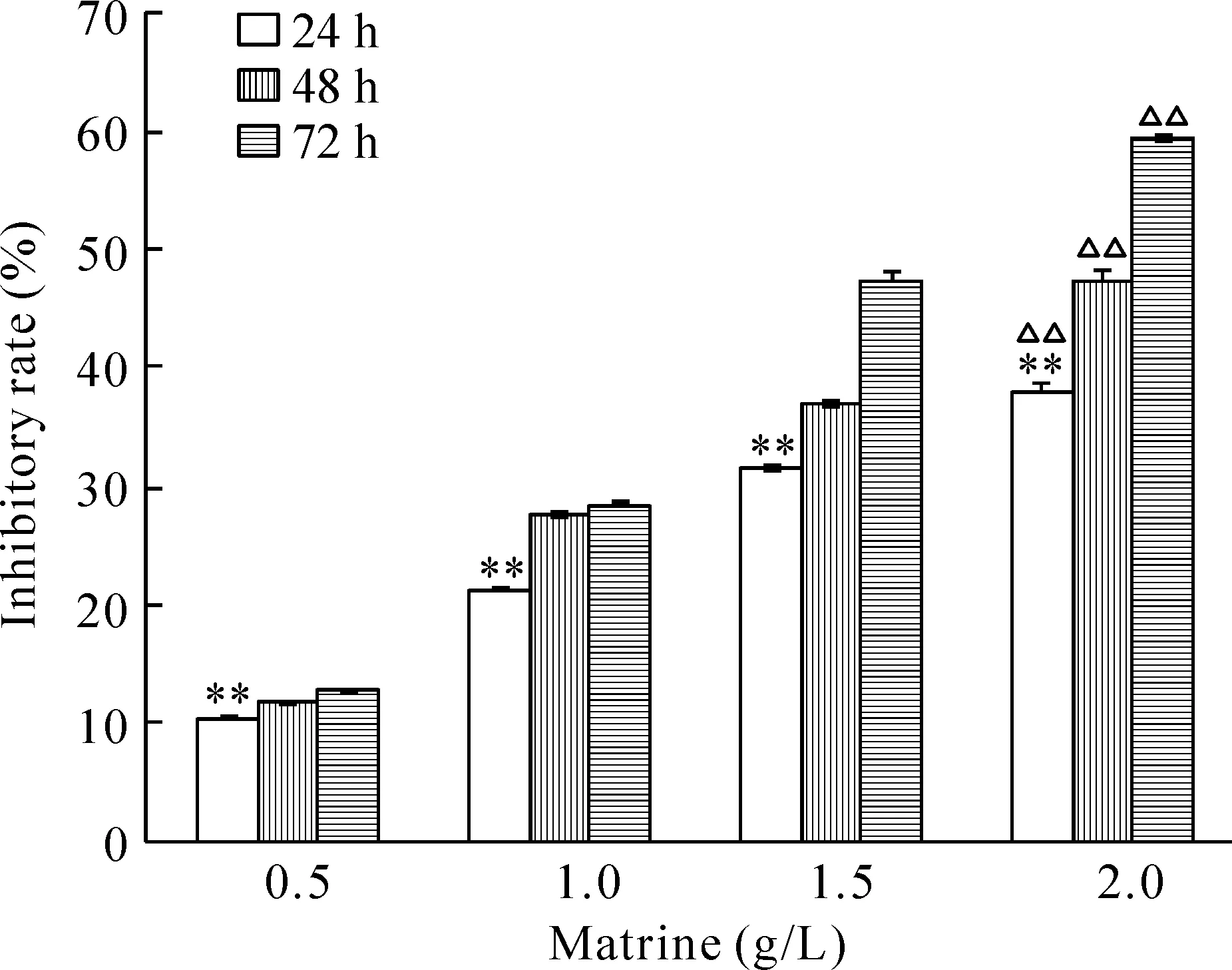
Figure 1. Inhibitory effect of matrine on the proliferation of D341 cells. Mean±SD.n=3. **P<0.01 vs 72 h; △△P<0.01 vs 0.5, 1.0 or 1.5 g/L matrine.
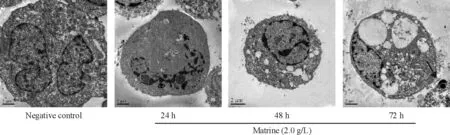
Figure 2. Cell ultrastructure observation under transmission electron microscope.
3 苦参碱对D341细胞的凋亡作用
苦参碱作用于D341细胞24 h、48 h和72 h后,对照组及各实验组细胞的凋亡率见图3。用Annexin V-FITC/PI双染流式细胞术检测:正常细胞(FITC-,PI-)在流式细胞分析图上为LL区;早期凋亡细胞(FITC+,PI-)在流式细胞分析图上为LR区;后期凋亡细胞(FITC+,PI+)在流式细胞分析图上为UR区。苦参碱能够明显诱导D341细胞凋亡,且随着苦参碱浓度的增加,D341细胞的凋亡率逐渐升高。方差分析显示,不同浓度的苦参碱作用下与阴性对照组间凋亡率的差异均有统计学意义(P<0.01)。
4 Bax、Bcl-2、Akt和 p-Akt表达水平的变化
不同浓度的苦参碱对D341细胞作用24 h、48 h和72 h后,随着药物浓度的增加,D341细胞Bax的表达逐渐增强,Bcl-2和p-Akt的表达逐渐下降,见图4。
讨 论
《神农本草经》曾注释:苦参,味苦寒,主心腹结气、瘕、积聚、黄疸。苦参碱是苦参、苦豆子、广豆根等豆科槐属植物中生物碱的主要成分,属于四环的喹嗪啶类,其化学式为C15H24N20,分子骨架可看作2个喹嗪啶环的杂体。近期的研究结果表明[5-6]:苦参碱对肿瘤的防治有很大的作用,它是一种很有前途具有抗肿瘤作用的药物。
在苦参碱众多的抗肿瘤活性功能中,抑制细胞增殖、诱导细胞凋亡的功能成为近年来各学者报道的热点。Yu等[7]提出,苦参碱能抑制多发性骨髓瘤细胞的增殖并诱导其凋亡,且与剂量呈量效关系,苦参碱诱导细胞凋亡和抑制自噬保护机制可能是苦参碱抗肿瘤潜力的一个主要方面。Shao等[8]发现,苦参碱能有效抑制乳腺癌细胞增殖,诱导癌细胞凋亡,可作为一种很有发展前景的抗乳腺癌药物。Liang等[9]在人骨肉瘤细胞的体内或体外实验研究中指出:苦参碱的增殖抑制和促进凋亡作用,主要是通过药物上调瘤细胞Bax的表达,下调Bcl-2蛋白的表达而起作用。关于苦参碱对人髓母细胞瘤细胞的抑制增殖、促进凋亡作用目前鲜有报道。本实验的结果显示,在同一作用时间下,不同浓度的苦参碱对D341细胞增殖的抑制程度不同,相同作用时间下增殖抑制率随药物浓度的增加而逐渐升高,并呈现一定的剂量依赖性;同一浓度的苦参碱对D341细胞增殖的抑制程度随着作用时间延长而增强,特别是苦参碱浓度比较高时,其作用更明显;苦参碱能够明显诱导D341细胞凋亡,且随着苦参碱浓度的增加,D341细胞的凋亡率逐渐升高。D341细胞经苦参碱作用后,细胞染色质趋边固缩,胞浆中空泡增多、变大,并且出现凋亡小体。这些均与文献报道相一致[10-11]。
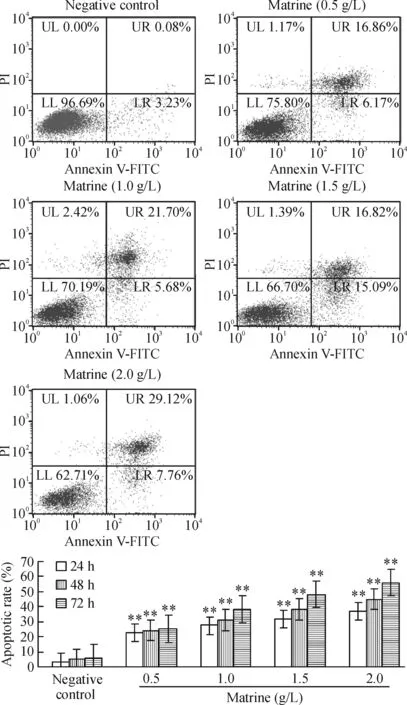
Figure 3. D341 cell apoptosis analysis detected by flow cytometry with matrine treatment for 24 h and apoptotic rates of D341 cells during 24, 48 and 72 h. Mean±SD.n=3. **P<0.01 vs negative control.
本实验研究了D341细胞在苦参碱作用下,凋亡相关蛋白如Bax和Bcl-2基因表达水平的变化。随着药物浓度的增加或者作用时间的延长,D341细胞Bax的表达逐渐增强,Bcl-2的表达逐渐下降。Bcl-2蛋白家族在诱导凋亡的线粒体信号传导途径中起着重要的作用,它主要抑制细胞的凋亡,在肿瘤细胞中呈高表达[12]。体外研究中发现高表达Bcl-2能抑制放疗或化疗诱导肿瘤细胞凋亡,是放化疗失败的主要原因[13]。细胞在凋亡过程中主要表现为Bcl-2蛋白表达减少,Bax蛋白表达增加,Bcl-2/Bax比例下降,Bcl-2与Bax的异源二聚体减少,Bax同源二聚体增多[14]。目前认为[15],Bcl-2抑制细胞凋亡的机制可能与凋亡促进蛋白Bax拮抗,抑制细胞色素C自线粒体释放到胞质,阻止细胞色素C对caspase蛋白酶激活。Bcl-2还能促进谷胱甘肽进入细胞核,从而改变核内的氧化还原反应,阻止caspase蛋白酶的活动和其它核改变,抑制细胞凋亡发生。本研究认为苦参碱正是通过调控Bcl-2与Bax的表达而诱导人髓母细胞瘤细胞凋亡、分化,抑制肿瘤细胞的增殖。
本实验进一步研究了D341细胞在苦参碱作用下,瘤细胞PI3K/Akt信号途径的变化,苦参碱作用48 h后,随着药物浓度的增加, p-Akt的表达水平显著降低。PI3K是一种细胞内磷脂酰肌醇激酶,具有丝氨酸/苏氨酸激酶的活性,PI3K介导的信号转导通路可以通过不同的方式调节细胞的分裂、分化、凋亡等活动[16]。蛋白激酶Akt是PI3K信号转导途径重要的信号分子,其可被PI3K激活成为具有磷酸激酶活性的p-Akt,p-Akt 可以增加NF-κB的转录活性,增加肿瘤细胞的增殖,促进肿瘤细胞的侵袭和转移[17]。PI3K/Akt信号途径的活化,即p-AKT一方面可以激活或抑制其多种下游靶蛋白,如可抑制促凋亡蛋白Bad的激活以及caspase激酶的活化, 增加转录因子NF-κB的活性以及上调凋亡拮抗蛋白Bcl-2的表达水平,另一方面可诱发下游一系列底物改变,诱导细胞死亡信号通路酶caspase-9的前体第196位Ser磷酸化,阻止caspase-9 对Apaf-1的结合与活化作用,使其失活,从而阻断内源性凋亡途径[18]。有文献报道[19],在多种白血病细胞中均有PI3K/Akt 信号途径的活化,而且PI3K/Akt的活性与白血病患者的化疗效果、临床预后等多种指标有关。我们的研究结果提示,苦参碱作用D341细胞,可能通过抑制PI3K/Akt的信号途径的活化,诱导细胞发生凋亡。
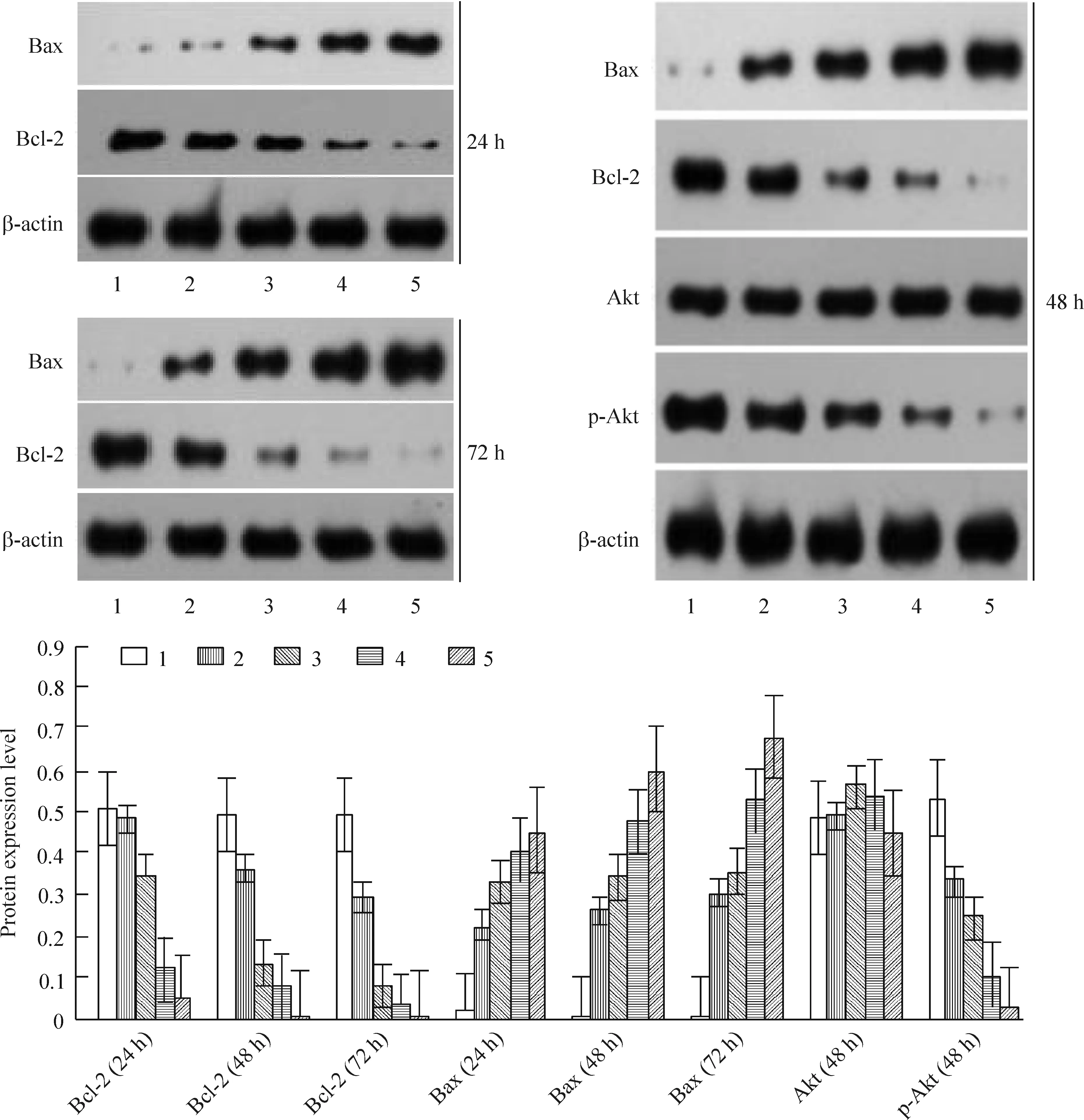
Figure 4. Analysis of Bax, Bcl-2, Akt, p-Akt expression by Western blotting. 1: negative control; 2: matrine 0.5 g/L; 3: matrine 1.0 g/L; 4: matrine 1.5 g/L; 5: matrine 2.0 g/L.Mean±SD.n=3.
因此,深入研究苦参碱对人髓母细胞瘤细胞增殖和凋亡的作用及其调节机制,通过干预肿瘤细胞凋亡活性,诱导肿瘤细胞的凋亡,在人髓母细胞瘤治疗领域具有广泛且深远的临床意义和应用前景。
[参 考 文 献]
[1] Bartlett F, Kortmann R, Saran F. Medulloblastoma[J]. Clin Oncol (R Coll Radiol),2013, 25(1): 36-45.
[2] Ryzhova MV, Zheludkova OG, Kumirova V, et al. Characteristics of medulloblastoma in children under age of three years[J]. Zh Vopr Neirokhir Im N N Burdenko, 2013,77(1):3-10.
[3] Zhang Z, Wang X, Wu W, et al. Effects of matrine on proliferation and apoptosis in gallbladder carcinoma cells (GBC-SD) [J]. Phytother Res, 2012,26(6):932-937.
[4] Zhang P, Wang Z, Chong T, et al. Matrine inhibits proliferation and induces apoptosis of the androgen-indepen-dent prostate cancer cell line PC-3 [J]. Mol Med Rep, 2012,5(3):783-787.
[5] Yang CL, Liu SS, Ma YG, et al. The influence of intraoperative pleural perfusion with matrine-cisplatin or cisplatin on stromal cell-derived factor-1 in non-small cell lung cancer patients with subclinical pleural metastasis[J]. Med Oncol, 2012 ,29(2):574-581.
[6] Wang L, You Y, Wang S, et al. Synthesis, characteri-zation andinvitroanti-tumor activities of matrine derivatives[J]. Bioorg Med Chem Lett, 2012 ,22(12):4100-4102.
[7] Yu Q, Chen B, Zhang X,et al. Arsenic trioxide-enhanced, matrine-induced apoptosis in multiple myeloma cell lines[J]. Planta Med, 2013,79(9):775-781.
[8] Shao H, Yang B, Hu R,et al. Matrine effectively inhibits the proliferation of breast cancer cells through a mechanism related to the NF-κB signaling pathway[J]. Oncol Lett, 2013 ,6(2):517-520.
[9] Liang CZ, Zhang JK, Shi Z, et al. Matrine induces caspase-dependent apoptosis in human osteosarcoma cellsinvitroandinvivothrough the upregulation of Bax and Fas/FasL and downregulation of Bcl-2[J]. Cancer Chemother Pharmacol, 2012,69(2):317-331.
[10] Chang C, Liu SP, Fang CH, et al.Effects of matrine on the proliferation of HT29 human colon cancer cells and its antitumor mechanism[J]. Oncol Lett, 2013,6(3):699-704.
[11] Luo C, Zhong HJ, Zhu LM, et al. Inhibition of matrine against gastric cancer cell line MNK45 growth and its anti-tumor mechanism[J]. Mol Biol Rep, 2012,39(5):5459-5464.
[12] Namba T, Tian F, Chu K, et al. CDIP1-BAP31 complex transduces apoptotic signals from endoplasmic reticulum to mitochondria under endoplasmic reticulum stress[J]. Cell Rep, 2013 ,5(2):331-339.
[13] Thomas S, Quinn BA, Das SK, et al. Targeting the Bcl-2 family for cancer therapy[J]. Expert Opin Ther Targets, 2013,17(1):61-75.
[14] Korkmaz D, Bastu E, Dural O, et al. Apoptosis through regulation of Bcl-2, Bax and Mcl-1 expressions in endometriotic cyst lesions and the endometrium of women with moderate to severe endometriosis[J]. J Obstet Gynaecol, 2013,33(7):725-728.
[16] 吴秀勤, 杨炼红, 钟健强,等. 米诺环素通过调控PI3K/Akt 通路抑制硝普钠诱导的PC12 细胞凋亡[J]. 中国病理生理杂志, 2013,29(4):660-663.
[17] Du CX, Wang Y. Expression of p-Akt, NFκB and their correlation with human papillomavirus infection in cervical carcinoma[J]. Eur J Gynaecol Oncol, 2012,33(3):274-277.
[18] Li SS, Tang QL, Wang SH, et al. Simultaneously targeting Bcl-2 and Akt pathways reverses resistance of nasopharyngeal carcinoma to TRAIL synergistically[J]. Tumori, 2011,97(6):762-770.
[19] Morishita N, Tsukahara H, Chayama K, et al. Activation of Akt is associated with poor prognosis and chemotherapeutic resistance in pediatric B-precursor acute lymphoblastic leukemia[J]. Pediatr Blood Cancer, 2012,59(1):83-89.

