MicroRNA-3666调节白血病细胞PTEN基因的表达*
倪 芳, 张玉侠, 汪心怡, 赵 华, 汪思应
(安徽医科大学病理生理学教研室,安徽 合肥 230032)
MicroRNA(miRNA,miR)是一类长度为19~25个核苷酸的内源性非编码RNA, 可以在转录水平或转录后水平调节基因的表达[1]。研究发现, miRNA不仅在细胞增殖、分化和凋亡等多种生理过程中发挥重要作用[2], 越来越多的研究表明, miRNA在包括恶性血液病在内的多种疾病发病中同样发挥着重要作用[3-4]。尽管目前miRNA在白血病中的研究取得了一些进展,但仍有大量miRNA的功能是未知的。本研究中的miR-3666,其在白血病细胞中的表达及其相关功能至今尚未见报道,我们利用TargetScan软件预测分析发现,miR-3666 与抑癌基因第10号染色体缺失的磷酸酶和张力蛋白同源基因(phosphatase and tensin homologue deleted on chromosome ten,PTEN)的mRNA 3’端非翻译区域(3’-untranslated region,3’UTR)存在3个结合位点,提示miR-3666 对PTEN的表达可能具有调控作用。本研究旨在进一步检测miR-3666在白血病细胞中的表达,并验证miR-3666对PTEN的靶向调控作用。
材 料 和 方 法
1 试剂
DMEM培养基、RPMI-1640培养基和热灭活的胎牛血清购自Gibco;脂质体Lipofectamine 2000购自 Invitrogen;Amaxa Cell Line Nucleofector Kit V 购自Amaxa Biosystems;氯仿、乙醇和异丙醇 (分析纯)均购自国药集团化学试剂有限公司;DEPC(分析纯)购自上海生工有限公司;Trizol购自Invitrogen;micro-RNA反转录试剂盒(miScript Reverse Transcription Kit)、hsa-miR-3666 及内参照RNU6B引物和microRNA定量PCR检测试剂盒(miScript SYBR Green PCR Kit)均购自Qiagen;双萤光素酶报告基因质粒psi-CHECK-2和双萤光素酶报告基因测定系统(Dual-Luciferase Reporter Assay System)购自Promega;PTEN鼠抗人单克隆抗体购自Santa Cruz; HRP 标记的山羊抗鼠II抗购自北京中杉金桥生物公司。
2 细胞系和原代细胞培养
人胚肾细胞株HEK293T采用DMEM 培养基和10%胎牛血清培养;慢性粒细胞白血病细胞系K562细胞用含10% 胎牛血清的RPMI-1640培养基培养。2种细胞系均由本实验室长期保存。人原代白血病细胞分离自临床初诊未治的白血病病人外周血。
3 方法
3.1miRNA的提取及qRT-PCR Trizol提取细胞总RNA(含miRNA),细胞的cDNA合成采用miScript Reverse Transcription Kit(含通用反向引物)(Qiagen);正向引物购自Qiagen公司miScript Primer Assays。 按照miScript SYBR Green PCR Kit(Qiagen)说明书配制PCR反应液,混匀后置于Rotor Gene 3000实时定量PCR仪,进行miRNA的定量PCR测定,按下列条件扩增: 95 ℃预变性10 s;95 ℃ 5 s, 60 ℃ 34 s,40个循环。反应结束后,由电脑自动分析计算出模板的拷贝数,并进行相对定量分析。
3.2miRNA 模拟体及抑制体的合成 hsa-miR-3666(miRBase accession No.MI0016067)的模拟体(mi-mic)及阴性对照(negative control, NC)、FAM标记的miR-3666抑制体(inhibitor, FAM-anti-miR-3666) 及阴性对照(inhibitor NC,FAM-anti-miR-C)均由上海吉玛生物公司设计合成。
3.3双萤光素酶报告基因质粒的构建 GenBank中查找miR-3666靶基因PTEN3′UTR序列,由上海生工合成PTEN-WT 3’UTR(包含了整段预测miR-3666结合序列的上、下游各100 bp左右的片段)和PTEN-mutant 3’UTR(相比PTEN-WT 3’UTR缺失了整段预测的miR-3666结合序列)基因,且两端具有XhoI 和NotI酶切位点;之后重组入双萤光素酶报告基因质粒psiCHECK-2多克隆位点,分别获得野生型及突变型克隆并测序鉴定正确性。
3.4细胞转染和双萤光素酶报告基因活性检测 将HEK293T细胞接种到96孔板中,每孔5×103细胞,DMEM培养基培养24 h后用无抗生素的DEME-洗涤2次,按照Lipofectamine 2000说明书配制转染试剂,将0.2 μg双萤光素酶报告质粒及20 nmol/L终浓度的miRNA mimic或阴性对照共转染HEK293T细胞,6 h后更换DMEM完全培养基,48 h后用Dual-Luciferase Reporter Assay System (Promega)检测萤光素酶的活性。
3.5核转染(nucleofection)实验 根据Amaxa Cell Line Nucleofector Kit V 试剂盒说明书,用核转染仪Nucleofector II (Amaxa Biosystems) 分别将FAM-anti-miR-3666 及阴性对照anti-miR-C转入K562 白血病细胞系,方法如下:血细胞计数仪计数细胞,台盼蓝拒染实验检测细胞存活率后将1×106细胞用1.5 mL RPMI-1640完全培养基接种于12 孔培养板, 37 ℃、5%CO2孵箱中预热。细胞移至1.5 mL Eppendorf管中,室温下200×g离心10 min,弃上清,细胞用100 μL预热到室温的Nueleofector Solution V混悬,并加入200 pmol/L (10 μL) FAM-anti-miR-3666或FAM-anti-miR-C,转移到Amaxa 核转染杯的底部,避免产生气泡,盖上杯盖。将核转染仪的程序设置为T-16,并将核转染杯放入杯孔中,按“X”键开始程序。结束后立即拿出转染杯,并用Amaxa 标准吸管将细移至含有0.5 mL完全培养基的12 孔板中。20 h 后流式细胞术检测FAM-anti-miR-3666 转染K562 的效率,并收集转染后的细胞,进行后续实验。
3.6Western blotting检测靶蛋白表达水平 收集上述不同转染组的K562 细胞,加入蛋白裂解液,BCA法测定蛋白浓度。取40 μg 样品蛋白质加入等体积上样缓冲液,经SDS-PAGE后,用水浴式电转仪转至硝酸纤维素膜上。室温封闭1 h,加入1∶500 稀释的小鼠抗人PTEN单克隆抗体,4 ℃孵育过夜,TBST振摇漂洗10 min×3次,然后加入HRP标记的II抗,室温孵育1 h,取出,TBST振摇漂洗10 min×4次,化学发光法检测后分析结果。
4 统计学处理
数据以均数±标准差(mean±SD)表示, 均数间的比较采用单因素方差分析或t检验。SPSS 15.0 统计软件分析,以P<0.05为差异有统计学意义。
结 果
1 miR-3666 在白血病细胞中高表达
qRT-PCR 结果表明,与正常人外周血单个核细胞相比,白血病细胞系中miR-3666的表达明显升高,尤其以K562细胞系中表达升高最为显著,见图1A;在临床初诊未治的人原代白血病细胞中,以慢性髓细胞性白血病(chronic myelognous leukemia, CML)细胞miR-3666表达升高最为显著,见图1B。
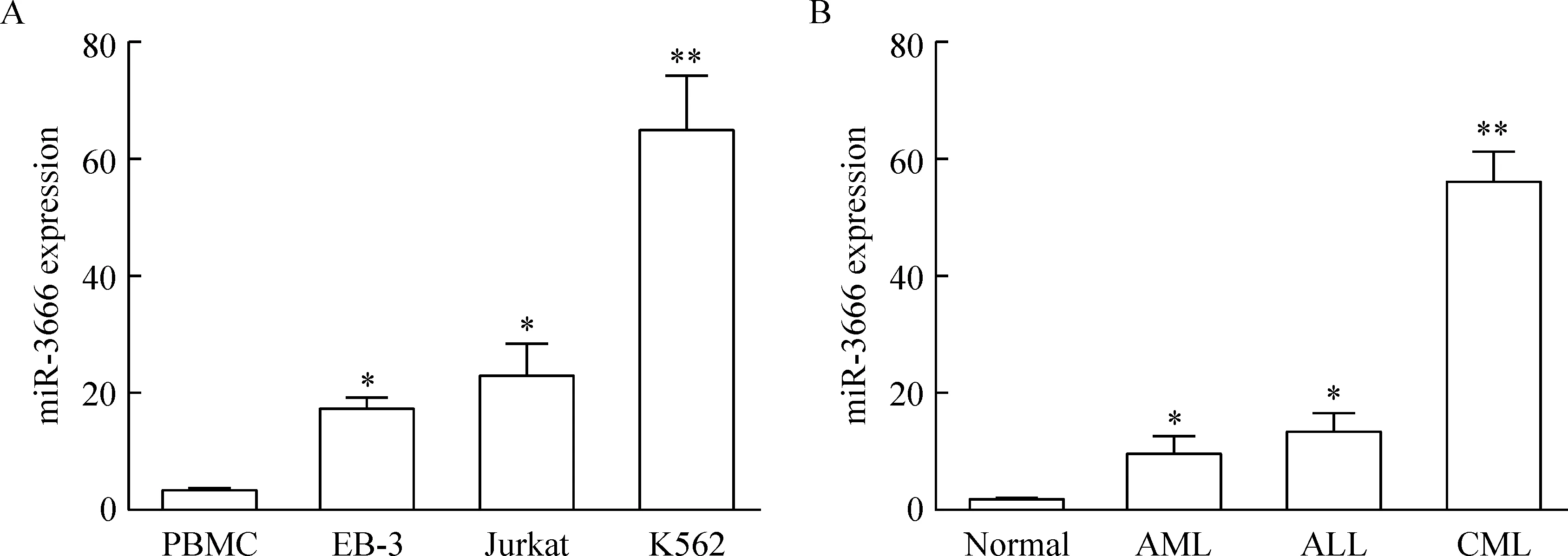
Figure 1. qRT-PCR analysis of miR-3666 expression in various leukemic cell lines (A) and human primary leukemic cells (B) compared to normal PBMC. Mean±SD. AML:n=6; ALL:n=8;CML:n=9.*P<0.05,**P<0.01 vs PBMC or normal.
2 生物信息学软件预测miR-3666靶向PTEN基因3’UTR 序列
为了更好地研究miR-3666的生物学功能,我们通过TargetScan在线分析软件(www.targetscan.org),将microRNA名称hsa-miR-3666输入检索框中,点击“Submit”,系统预测出hsa-miR-3666可能的靶基因。结果发现其靶点非常广泛,其中抑癌基因PTEN引起了我们的关注,PTEN3’UTR 含有3个miR-3666的结合位点,见图2。

Figure 2. Predicted interaction between miR-3666 and the three putative binding sites in the PTEN 3’UTR.
3 miR-3666对PTEN基因3’UTR的调控
为了进一步证明miR-3666对PTEN基因的3’UTR具有直接调控作用,我们采用双萤光素酶报告基因质粒psiCHECK-2,构建了包含靶基因 WT 3’UTR的野生型克隆(分别包含软件预测的整段miR-3666结合序列)及包含靶基因 mutant 3’UTR(分别缺失了整段预测的miR-3666结合位点)的突变型克隆,并通过测序鉴定正确。双萤光素酶报告基因实验结果初步表明PTEN是miR-3666的潜在靶基因,见图3A。此外我们发现:miR-3666能通过野生型PTEN3’UTR(binding site 1)抑制报告基因的活性,而且这种抑制作用是“miR-3666结合元件”依赖性的,在人为缺失突变该元件时(缺失了整段预测的miR-3666结合位点1),miR-3666即不能对报告基因的活性产生抑制效应,见图3B。以上结果表明PTEN是miR-3666的潜在靶基因之一。

Figure 3. Luciferase activity of various reporters in the presence or absence of miR-3666 mimic in HEK293T cells.A: dual-luciferase assay of HEK293T cells transfected with luciferase constructs containing the three putative miR-3666-binding sites (binding site 1, binding site 2 or binding site 3), synthetic mature miR-3666 (miR-3666) or synthetic control miRNA with a scrambled sequence (miR-C); B: dual-luciferase assay of HEK293T cells transfected with luciferase constructs containing wild-type 3’ UTR (WT 3’ UTR) or mutated 3’ UTR (mutant 3’UTR) (with deletion of the miR-3666-responsive element) from PTEN, plus miRNA (as in A).Mean±SD. n=3.**P<0.01 vs miR-C; ##P<0.01 vs miR-3666 in WT 3’UTR.
4 miR-3666调控K562白血病细胞中PTEN蛋白的表达
转染FAM-anti-miR-3666 组,PTEN蛋白水平明显上调,见图4。这表明PTEN的表达受miR-3666的调控。
讨 论
白血病的发生机制复杂,近年来研究发现很多功能基因(尤其是癌基因、抑癌基因或转录因子)的时空、量的表达差异或突变不仅参与白血病等肿瘤发病,还参与调控肿瘤细胞恶性生物学行为,如p53、PTEN及Her2等基因表达异常或突变与多种肿瘤的恶性生物学行为有关[5-7]。PTEN是1997年发现的编码具有脂质磷酸酶和蛋白磷酸酶活性的抑癌基因,具有双重肿瘤抑制功能。大量的研究显示,在多种实体瘤中存在PTEN基因的突变或低表达,从而影响其肿瘤抑制功能。近年来PTEN在白血病发病中的作用逐渐受到重视,PTEN蛋白可以通过其磷酸酶活性抑制多种信号通路,参与白血病的发生发展。多项研究表明,PTEN基因在白血病中突变罕见,但存在不同程度的缺失和低表达,然而,PTEN基因的表达调控的机制还很不清楚[7]。
近年来发现的miRNA参与多种功能基因的表达调控,它可通过识别靶基因mRNA 的 3’UTR,并与之结合,抑制翻译或导致mRNA 降解,从而抑制靶基因的表达[8-9]。目前,已有研究表明某些表达失调的miRNA与白血病的发生发展密切相关,也有与急性髓细胞白血病、慢性淋巴细胞白血病和霍奇金淋巴瘤的细胞遗传学以及临床治疗结果有关的miRNA表达标签的报道[10-14]。
本研究报道的miR-3666,我们首次发现其在人白血病细胞中显著高表达,并进一步通过双萤光素酶报告基因实验证实了PTEN是miR-3666的潜在靶基因,并且证明在白血病细胞中下调miR-3666后,可以促进PTEN蛋白的表达,表明在白血病细胞中,可能由于miR-3666的高表达,抑制了抑癌基因PTEN的表达,从而促进白血病的发生和发展。因此,miR-3666上调可能是白血病发生发展的机制之一, 也为白血病的治疗提供了新的思路。
[参 考 文 献]
[1] Bartel DP. MicroRNAs:genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[2] Cheng AM, Byrom MW, Shelton J, et al. Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis [J]. Nucleic Acids Res, 2005, 33(4):1290-1297.
[3] Zhou XX, Wang X. Role of microRNAs in chronic lymphocytic leukemia [J]. Mol Med Rep, 2013,8(3):719-725.
[4] So AY, Zhao JL, Baltimore D.The Yin and Yang of microRNAs: leukemia and immunity [J]. Immunol Rev, 2013, 253(1):129-145.
[5] Sanefuji K, Taketomi A, Iguchi T, et al.Significance of DNA polymerase delta catalytic subunit p125 induced by mutant p53 in the invasive potential of human hepatocellular carcinoma[J]. Oncology, 2010, 79(3-4):229-237.
[6] Scaltriti M, Eichhorn PJ, Cortés J, et al .Cyclin E amplification/overexpression is a mechanism of trastuzumab resistance in HER2+breast cancer patients[J].Proc Natl Acad Sci U S A, 2011,108(9):3761-3766.
[7] Wrighton KH.Cancer biology: role of nuclear PTEN revealed [J].Nat Rev Mol Cell Biol, 2011, 12(3):134.
[8] Ambros V. The functions of animal microRNAs[J]. Nature,2004,431(7006): 350-355.
[9] Carthew RW,Sontheimer EJ. Origins and mechanisms of miRNAs and siRNAs[J].Cell,2009,136(4): 642-655.
[10] Calin GA, Ferracin M, Cimmino A,et al. A microRNA signature associated with prognosis and progression in chronic lymphocytic leukemia [J]. N Engl J Med, 2005, 353(17):1793-1801.
[11] Garzon R, Volinia S, Liu CG, et al. MicroRNA signatures associated with cytogenetics and prognosis in acute myeloid leukemia [J]. Blood, 2008, 111(6): 3183-3189.
[12] Garzon R, Garofalo M, Martelli MP, et al. Distinctive microRNA signature of acute myeloid leukemia bearing cytoplasmic mutated nucleophosmin [J]. Proc Natl Acad Sci U S A, 2008, 105(10): 3945-3950.
[13] Navarro A, Gaya A, Martinez A, et al. MicroRNA expression profiling in classical Hodgkin lymphoma[J]. Blood, 2008, 111(5): 2825-2832.
[14] Zhu DX, Miao KR, Fang C, et al. Aberrant microRNA expression in Chinese patients with chronic lymphocytic leukemia [J]. Leuk Res, 2011, 35(6):730-734.

