内源性组胺减轻小鼠前脑缺血再灌注后期脑损伤*
范彦英, 马云鹏, 乔 圆, 何 萍, 张轩萍, Hiroshi OHTSU, 陈 忠
(1山西医科大学基础医学院药理教研室,山西 太原 030001; 2浙江大学医学部,浙江 杭州 310058;3浙江大学医学院附属第二医院,浙江 杭州 310009; 4东北大学医学院,日本 仙台 980-8775)
中枢组胺是脑内的一种神经递质或调质,其可由组氨酸经组氨酸脱羧酶(histidine decarboxylase, HDC)脱羧而成[1]。脑内组胺主要分布于组胺能神经元和肥大细胞中。组胺能神经元胞体位于下丘脑结节乳头核,该神经元在脑内有着广泛而弥散的投射。组胺在脑内通过作用于H1、H2和H3受体发挥着多种神经调节作用,如参与摄食、运动功能、学习记忆等生理过程。
近年来的研究发现,中枢组胺能神经系统对脑缺血早期的神经损伤发挥重要调节作用。Adachi 等[2]在大鼠全脑缺血模型上,观察到α-氟甲基组氨酸(α-fluromethylhistidine,α-FAM;一种选择性的HDC 抑制剂)可加重缺血72 h 海马CA1 区的神经元死亡,而外源性给予组胺则能减轻沙鼠前脑缺血再灌7 d后的神经元损伤[3]。进一步的研究表明,H2受体可能参与了组胺的这种神经保护作用。侧脑室内注射组胺H2受体拮抗剂ranitidine或cimetidine都会加重脑缺血再灌注损伤[3]。而给予组胺H2受体激动剂dimaprit则可减轻大鼠全脑缺血引起的神经元损伤[4]。课题组的前期研究发现,在培养的皮层神经元上,组胺预处理能对抗NMDA 急性处理诱发的兴奋性损伤,而这种作用是通过H2受体/cAMP/PKA通路介导的[5]。最近的研究还发现,组胺还可能通过激动组胺H1受体上调星形胶质细胞上的谷氨酸转运体1(glutamate transporter 1, GLT-1)和谷氨酰胺合成酶的表达来减轻脑缺血再灌急性期的神经损伤[6-7]。这些证据均提示,组胺在脑缺血早期具有脑保护作用。但是,目前关于组胺抗脑缺血的研究主要集中评价了其在脑缺血早期(7 d以内)所扮演的角色,且多采用药理学手段,即外源性给予组胺或α-FMH及组胺受体拮抗剂。而内源性组胺对脑缺血后期(数周)的学习记忆功能及神经元损伤的影响尚不明确。
为此,本实验利用C57BL/6野生型(wild-type,WT)小鼠和组氨酸脱羧酶基因敲除(HDC-KO)小鼠(该小鼠由于无法将组氨酸脱羧为组胺,体内长期缺乏组胺[8]),来探讨内源性组胺对前脑缺血再灌后期条件性恐惧记忆和神经元损伤的影响。
材 料 和 方 法
1 动物
雄性C57BL/6 WT小鼠(北京维通利华公司提供)和HDC-KO小鼠(从日本Ohtsu教授研究组引进),体重22~25 g,周龄为8~10周。从2种基因型小鼠中各随机抽取3只,提取小鼠尾部组织DNA,用PCR对动物的HDC基因和neomycin基因进行扩增鉴定。扩增HDC基因的引物序列为5′-AGTGAGGGACTGTGGCTCCACGTCGATGCT-3′ 和5′-TACAGTCAAAGTGTACCATCATCCACTTGG-3′ ,扩增产物为147 bp;扩增neomycin基因的引物序列为5′-AAACATCGCATCGAGCGAGCACGTACTCGG-3′和5′-ATGTCCTGATAGCGGTCCGCCACACCCAGC-3′,扩增产物为244 bp。所有的动物实验均遵照国家实验动物饲养和使用指南,动物饲养在温度控制的环境[(22±1)℃]下,12 h明暗循环,自由饮食。
2 方法
2.1前脑缺血模型制备 将WT和HDC-KO小鼠各随机分为对照组和缺血组,参照文献[9],以1%的戊巴比妥钠(45 mg/kg)腹腔注射麻醉,钝性分离小鼠双侧颈总动脉,并利用动脉瘤夹进行夹闭,缺血30 min后再灌,并缝合伤口。对照组仅分离但不夹闭双侧颈总动脉。动物在手术时和能自主活动前利用小动物保温毯保温,肛温均保持在36.5~37.5 ℃之间。
2.2体重监测 在缺血前以及缺血后第1天到第7天及第14天对小鼠进行称重,并做记录。
2.3条件性恐惧记忆的测定 在前脑缺血再灌14 d时,对小鼠进行条件性恐惧记忆的检测。将小鼠放入训练盒内,经过120 s的适应后,给予30 s的2.8 kHz,84 dB的声音刺激(条件刺激),在声音刺激的最后2 s,同时给予1 mA的电流刺激(非条件刺激),刺激结束30 s后将小鼠从训练盒内拿出。在训练后24 h,分别对每只小鼠进行背景和线索记忆的测试,按照训练时的顺序,依次将每只小鼠放入训练盒内,不给予任何刺激,观察300 s内出现恐惧反应(free-zing;即一种除呼吸运动外,全身其它躯体运动全部停止的状态)的次数。之后再依次将小鼠放入一个新的盒子,适应120 s后,给予300 s的声音刺激(2.8 kHz,84 dB),但不给予电流刺激,观察后300 s内出现恐惧反应的次数。恐惧反应的次数通过计数300 s内每5 s恐惧反应的出现与否而得到。动物恐惧反应的程度最终以恐惧反应出现的次数与观察次数60的百分比来表示。
2.4病理切片及甲苯胺蓝染色 前脑缺血再灌3 d及15 d,各组小鼠于1%戊巴比妥钠(45 mg/kg)腹腔麻醉下经左心室插管灌流。灌流液依次采用生理盐水及4%多聚甲醛固定液。取出固定后的大脑置于同一固定液中进行后固定24 h,后以30%蔗糖溶液脱水1周。使用冰冻切片机制备厚度为10 μm的海马冠状切片。切片室温放置过夜晾干,0.01 mol/L PBS洗5 min,重复3次;1%甲苯胺蓝染色20 min;1%盐酸乙醇分化3~10 s;以95%、100%乙醇脱水各2 min,二甲苯透明,封片,对海马CA1区的正常神经元进行计数。
3 统计学处理
数据用均数±标准误(mean±SEM)表示。采用SPSS 15.0软件处理,组间均数比较采用单因素方差分析(One-way ANOVA)或t检验,动物死亡率的比较采用似然比2检验。以P<0.05为差异有统计学意义。
结 果
1 实验动物的HDC基因和neomycin基因的PCR扩增鉴定结果
如图1所示,WT小鼠在147 bp处出现较强的HDC基因PCR扩增条带,而在244 bp附近则没有出现条带。相反,HDC-KO小鼠在WT小鼠应出现HDC基因PCR扩增条带的相应位置(147 bp处)并没有出现任何条带,而在244 bp附近出现neomycin替代基因的PCR扩增条带,证明我们所用的HDC-KO小鼠的HDC基因确实已被敲除,取而代之的是插入的neomycin基因,且为纯合子。

Figure 1. Genotype identification of the mice by PCR. WT mice tested displayed a 147-bp band corresponding to the HDC gene fragment, whereas all HDC-KO mice tested showed a 244-bp band corresponding to the neomycin gene fragment.
2 WT与HDC-KO小鼠在前脑缺血再灌后不同时点的死亡率
小鼠前脑缺血再灌后的1~7 d,WT与HDC-KO小鼠均出现了死亡情况,但死亡率并无明显差异;再灌后的8~14 d,剩余的8只WT小鼠均存活,而剩余的9只HDC-KO小鼠中的3只死亡,其死亡率显著高于WT小鼠(P<0.05),见表1。
3 WT与HDC-KO小鼠在前脑缺血再灌后不同时点的体重变化
对再灌14 d 时仍存活的动物的体重进行统计分析,结果发现,前脑缺血再灌1 d 后,WT和HDC-KO小鼠的体重,与造模前相比均出现了明显下降,但2组间的体重变化程度尚无明显差异。再灌2 d 后,WT小鼠的体重开始逐渐恢复,而HDC-KO小鼠体重在再灌 4 d 后开始恢复。HDC-KO小鼠的体重恢复程度(即测量当天与造模前体重的差值)在再灌4 d、5 d、6 d 及7 d 后均显著低于WT小鼠,在再灌14 d 后仍有低于WT小鼠的趋势,但无显著差异,见图2。

表1 WT与HDC-KO小鼠在前脑缺血再灌后不同时点的死亡率
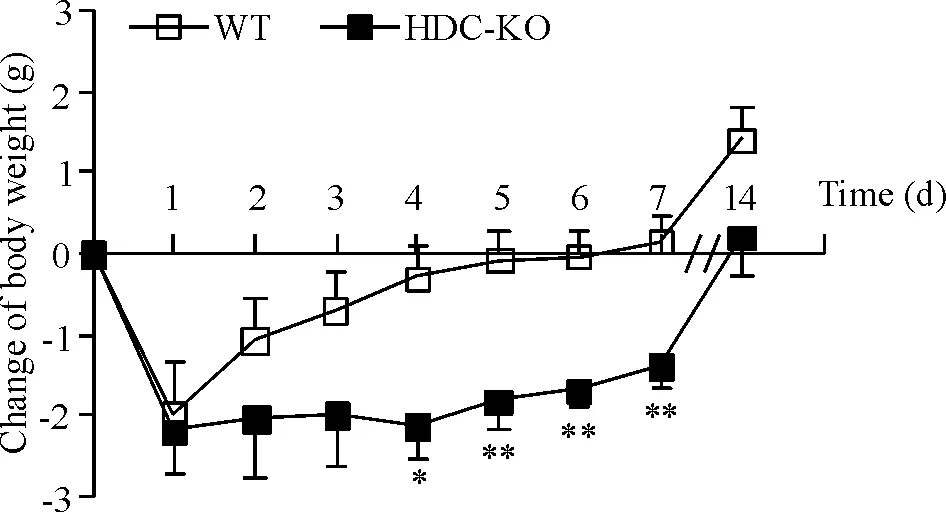
Figure 2. The changes of body weight at different time points after forebrain ischemia/reperfusion in WT and HDC-KO mice. The animals were applied with 30 min of bila-teral common carotid artery occlusion, and the body weight was observed at 1, 2, 3, 4, 5, 6, 7 and 14 d after reperfusion. The change of body weight is equal to the current body weight minus the body weight before ischemia.Mean±SEM. WT, n=8; HDC-KO, n=6. *P<0.05, ** P<0.01 vs WT.
4 WT与HDC-KO小鼠在前脑缺血再灌14 d的条件性恐惧记忆变化
在前脑缺血再灌14 d 时,对WT与HDC-KO小鼠进行了条件性恐惧记忆的检测,结果如图3所示,WT和HDC-KO小鼠的对照组,其背景和线索记忆能力并无明显差异。与相应的对照组相比,WT和HDC-KO缺血组小鼠的背景和线索记忆能力均出现明显下降,但HDC-KO小鼠的背景和线索记忆能力均显著低于与WT小鼠(P<0.05)。
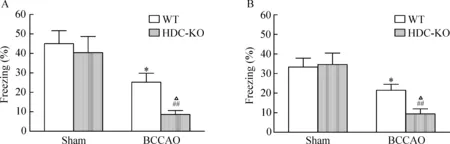
Figure 3. Fear conditioning at 14 d after forebrain ischemia/reperfusion in HDC-KO and WT mice. The animals were applied with 30 min of bilateral common carotid artery occlusion (BCCAO). A: contextual memory; B: cue memory. Mean±SEM. WT sham, n=6; HDC-KO sham, n=6; WT BCCAO, n=8; HDC-KO BCCAO, n=6. *P<0.05 vs WT sham; ##P<0.01 vs HDC-KO sham; △P<0.05 vs WT BCCAO.
5 WT与HDC-KO小鼠在前脑缺血再灌3 d 及15 d 的海马CA1区神经元密度变化
在前脑缺血再灌 3 d 及 15 d 后WT与HDC-KO组小鼠脑片的甲苯胺蓝染色结果见图4,对照组的WT与HDC-KO小鼠的海马CA1区神经元密度无明显差异。前脑缺血再灌 3 d 后,与对照组相比,WT和HDC-KO小鼠的的缺血组均出现明显的海马CA1区神经元丢失,但两缺血组小鼠的神经元密度未见显著差异,而再灌15 d 后,HDC-KO组神经元的缺失更为严重,神经元计数统计结果显示其神经元密度,明显低于WT小鼠(P<0.05)。
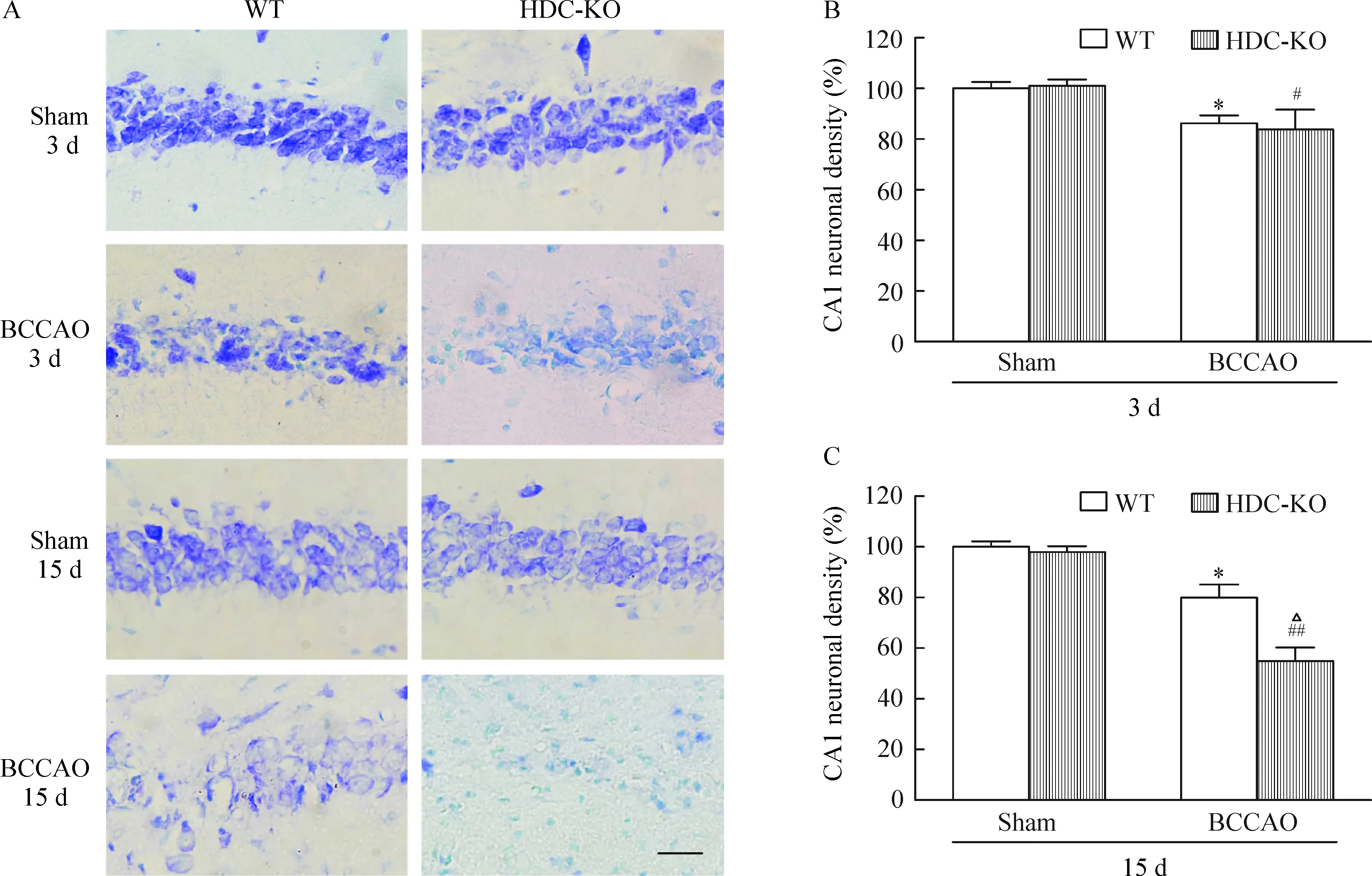
Figure 4. The hippocampal CA1 neuronal density at 3 d and 15 d after forebrain ischemia/reperfusion in HDC-KO and WT mice. The animals were applied with 30 min of bilateral common carotid artery occlusion (BCCAO). A:the representative images of CA1 sector stained with toluidine blue. Scale bar=50 μm. B: quantitative evaluation of CA1 neuronal density at 3 d (n=6). C: quantitative evaluation of CA1 neuronal density at 15 d (WT sham, n=6; HDC-KO sham, n=6; WT BCCAO, n=8; HDC-KO BCCAO, n=6). Each value is expressed as percentages of the cell numbers in WT sham group. Mean±SEM. *P<0.05 vs WT sham; #P<0.05, ## P<0.01 vs HDC-KO sham; △P<0.05 vs WT BCCAO.
讨 论
本实验利用HDC-KO小鼠研究了内源性组胺对前脑缺血再灌后期脑损伤的调节作用,实验结果表明,内源性组胺对前脑缺血再灌注损伤后期的学习记忆能力及神经元损伤具有明显改善作用。
组胺在脑缺血再灌早期的保护作用已经被证实[2-4]。脑缺血后动物体重下降的程度可以部分反映脑缺血损伤的严重程度[10-11]。已有的研究表明,中枢组胺可抑制小鼠摄食并降低体重,该作用可被H1受体拮抗剂所逆转[12-13]。相似地,在H1受体敲除小鼠会表现为摄食过量和肥胖[14]。此外,组胺H3受体拮抗剂可通过反向调节H3受体增加组胺的合成与释放,进而抑制体重增加[15]。在本研究中,缺乏内源性组胺的HDC-KO小鼠在脑缺血再灌2 d后的体重恢复程度低于WT小鼠,到4 d后出现显著差异,提示内源性组胺在脑缺血再灌早期可能通过其神经保护作用间接加速了体重的恢复,而非直接增加动物体重。然而,WT和HDC-KO小鼠在再灌3 d后的海马CA1区的神经元密度及再灌1~7 d 内的死亡率并未见显著差异。本课题组在前期研究中也发现,WT和HDC-KO小鼠在短暂性或永久性局灶性脑缺血 1 d 后的脑梗死体积没有显著差异[16-17]。这些与以往研究相矛盾的结果可能是由于HDC-KO小鼠脑内长期缺乏组胺,体内出现的代偿机制能够部分代偿脑缺血急性期内源性组胺对神经损伤的调节作用所造成的。
在脑缺血再灌后期,HDC-KO小鼠仍有33%的动物死亡,而WT小鼠未出现动物死亡,与此同时,在再灌 15 d 后,HDC-KO小鼠的海马CA1区神经元缺失比WT小鼠更为严重,提示内源性组胺对脑缺血再灌后期的神经元损伤具有抑制作用。脑缺血再灌注引发神经元损伤的同时往往伴随着学习记忆功能的下降[18-20]。尽管HDC-KO小鼠的学习记忆功能在多种不同的学习记忆模型中都发生了改变[21],但在本实验中,WT和HDC-KO小鼠对照组的条件恐惧记忆能力并未见显著差异,而前脑缺血再灌14 d后,HDC-KO小鼠条件恐惧记忆能力的下降比WT小鼠更为严重,提示内源性组胺对脑缺血后期的学习记忆能力有明显改善作用。
内源性组胺改善脑缺血后期神经损伤及学习记忆功能的作用可能与其在缺血早期发挥的抑制兴奋性神经毒性作用有关。在局灶性脑缺血中发现,组胺可通过H2受体抑制谷氨酸的释放[4, 22]。本课题组在培养的皮层神经元上发现,组胺能保护NMDA诱发的兴奋性损伤作用,而这种作用通过组胺H2受体所介导[5]。另外,组胺还可通过组胺H1受体促进星形胶质细胞上的谷氨酸转运体GLT-1和谷氨酰胺合成酶的表达,进而减少细胞外的谷氨酸浓度,从而减轻脑缺血早期发生的兴奋性毒性损伤[6-7]。另外,本课题组最近的研究发现,低氧预处理诱导释放的内源性组胺可促进血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达[17]。而VEGF对脑缺血后期的神经损伤和修复具有重要调节作用[23-25]。我们推测,组胺在脑缺血再灌后期还可能通过调节VEGF表达,减轻神经损伤并促进脑功能恢复。因此,内源性组胺调节脑缺血再灌注损伤的保护机制可能是多方面的。
综上所述,本研究利用HDC-KO小鼠发现内源性组胺可改善脑缺血长期再灌注后的学习记忆功能,并减少神经元损伤,但其具体机制还有待更深入的研究。
[参 考 文 献]
[1] Haas H, Panula P. The role of histamine and the tuberomamillary nucleus in the nervous system[J]. Nat Rev Neurosci, 2003, 4(2):121-130.
[2] Adachi N, Oishi R, Itano Y, et al. Aggravation of ischemic neuronal damage in the rat hippocampus by impairment of histaminergic neurotransmission[J]. Brain Res, 1993, 602(1):165-168.
[3] Fujitani T, Adachi N, Nagaro T, et al. Histaminergic H2action protects hippocampal CA1 neurons by prolonging the onset of the anoxic depolarization in gerbils[J]. J Neurochem, 1996, 67(6):2613-2615.
[4] Hamami G, Adachi N, Liu K, et al. Alleviation of ischemic neuronal damage by histamine H2receptor stimulation in the rat striatum[J]. Eur J Pharmacol, 2004, 484(2-3):167-173.
[5] Dai H, Zhang Z, Zhu Y, et al. Histamine protects against NMDA-induced necrosis in cultured cortical neurons through H2receptor/cyclic AMP/protein kinase A and H3receptor/GABA release pathways[J]. J Neurochem, 2006, 96(5):1390-1400.
[6] Fang Q, Hu WW, Wang XF, et al. Histamine up-regulates astrocytic glutamate transporter 1 and protects neurons against ischemic injury[J]. Neuropharmacology, 2014, 77:156-166.
[7] Wang XF, Hu WW, Yan HJ, et al. Modulation of astrocytic glutamine synthetase expression and cell viability by histamine in cultured cortical astrocytes exposed to OGD insults[J]. Neurosci Lett, 2013, 549:69-73.
[8] Ohtsu H, Tanaka S, Terui T, et al. Mice lacking histidine decarboxylase exhibit abnormal mast cells[J]. FEBS Lett, 2001, 502(1-2):53-56.
[9] 陈远寿, 潘贵书, 秦 伟,等. 促红细胞生成素上调海马pCREB表达和改善脑缺血小鼠认知功能[J]. 中国病理生理杂志, 2011, 27(4):722-726.
[10] Papas S, Crepel V, Hasboun D, et al. Cycloheximide reduces the effects of anoxic insultinvivoandinvitro[J]. Eur J Neurosci, 1992, 4(8):758-765.
[11] Zhang F, Wang S, Signore AP, et al. Neuroprotective effects of leptin against ischemic injury induced by oxygen-glucose deprivation and transient cerebral ischemia[J]. Stroke, 2007, 38(8):2329-2336.
[12] Sakata T, Yoshimatsu H, Kurokawa M. Hypothalamic neuronal histamine: implications of its homeostatic control of energy metabolism[J]. Nutrition, 1997, 13(5):403- 411.
[13] Han M, Deng C, Burne TH, et al. Short- and long-term effects of antipsychotic drug treatment on weight gain and H1 receptor expression[J]. Psychoneuroendocrinology, 2008, 33(5):569-580.
[14] Masaki T, Chiba S, Yasuda T, et al. Involvement of hypothalamic histamine H1receptor in the regulation of feeding rhythm and obesity[J]. Diabetes, 2004, 53(9):2250-2260.
[15] Malmlöf K, Zaragoza F, Golozoubova V, et al. Influence of a selective histamine H3receptor antagonist on hypothalamic neural activity, food intake and body weight[J]. Int J Obes (Lond), 2005, 29(12):1402-1412.
[16] Shen Y, He P, Fan YY, et al. Carnosine protects against permanent cerebral ischemia in histidine decarboxylase knockout mice by reducing glutamate excitotoxicity[J]. Free Radic Biol Med, 2010, 48(5):727-735.
[17] Fan YY, Hu WW, Dai HB, et al. Activation of the central histaminergic system is involved in hypoxia-induced stroke tolerance in adult mice[J]. J Cereb Blood Flow Metab, 2011, 31(1):305-314.
[18] 刘 旭, 程玉芳, 张汉霆,等. 咯利普兰对局灶性脑缺血-再灌注损伤大鼠学习记忆及海马PDE4活性的影响[J]. 中国病理生理杂志, 2008, 24(6):1096-1100.
[19] Henrich-Noack P, Krautwald K, Reymann KG, et al. Effects of transient global ischaemia on freezing behaviour and activity in a context-dependent fear conditioning task:implications for memory investigations[J]. Brain Res Bull, 2011, 85(6):346-353.
[20] Chin Y, Kishi M, Sekino M, et al. Involvement of glial P2Y1receptors in cognitive deficit after focal cerebral stroke in a rodent model[J]. J Neuroinflammation, 2013, 10:95.
[21] Köhler CA, da Silva WC, Benetti F, et al. Histaminergic mechanisms for modulation of memory systems[J]. Neural Plast, 2011, 2011:328602.
[22] Adachi N, Itoh Y, Oishi R, et al. Direct evidence for increased continuous histamine release in the striatum of conscious freely moving rats produced by middle cerebral artery occlusion[J]. J Cereb Blood Flow Metab, 1992, 12(3):477- 483.
[23] Dzietko M, Derugin N, Wendland MF, et al. Delayed VEGF treatment enhances angiogenesis and recovery after neonatal focal rodent stroke[J]. Transl Stroke Res, 2013, 4(2):189-200.
[24] Greenberg DA, Jin K. Vascular endothelial growth factors (VEGFs) and stroke[J]. Cell Mol Life Sci, 2013, 70(10):1753-1761.
[25] 郭 英, 石德金, 梁朝峰,等. VEGF对大鼠海马回神经干细胞体外增殖和分化的影响[J]. 中国病理生理杂志, 2007, 23(10):1914-1918.

