越桔原花青素调控脑胶质瘤细胞生长的机制研究*
钟 越, 齐 玲, 沈 楠, 王玮瑶, 田 晶, 王艳春
(吉林医药学院,吉林 吉林 132013)
笃斯越桔(VacciniumuliginosumLinn.)是我国野生越桔的主要品种,在吉林省长白山地区分布最广。笃斯越桔以富含原花青素(procyanidin,PC)著称。研究发现原花青素具有抗压力、抗氧化、抗炎症、抗动脉硬化、抗衰老、抗肿瘤及增强免疫功能等多种生物学作用,且不良反应低[1-3]。越桔原花青素抗肿瘤作用的研究较少,在脑胶质瘤中的作用尚未见报道。本实验从多方面来研究越桔原花青素对脑胶质瘤C6细胞生长的作用,并探讨其可能的机制。
材 料 和 方 法
1 材料
1.1细胞株 大鼠脑胶质瘤C6细胞株由吉林大学基础医学院提供。
1.2主要试剂 越桔原花青素(南京苏朗医药科技开发有限公司);RPMI-1640细胞培养基 (HyClone);小牛血清和0.25%胰酶(Gibco); MTT和DMSO(Sigma);Bcl-2、Bax、caspase-3和β-actin抗体(北京中杉公司)。
1.3仪器 J-26XP超低温高速离心机(贝克曼公司);超低温冰箱(MDF-U53V);PLUS 384全自动酶标仪(MDC);IX-70型倒置式显微镜(Olympus);DNA蛋白电泳系统(Bio-Rad);Image-Pro Plus 图像分析管理系统 (Media Cybernetics)。
2 方法
2.1C6细胞的培养 将C6脑胶质瘤细胞接种于含10%小牛血清的RPMI-1640培养基中,37 ℃、5%CO2及饱和湿度条件下进行培养,隔日换液1次。
2.2越桔原花青素对C6细胞生长的影响 取对数生长期的C6细胞制成单细胞悬液,按6 000 cells/well密度将细胞接种于96孔板,置入37 ℃、5% CO2培养箱中培养。加入不同浓度越桔原花青素(0、10、20和40 μg/L),每个药物浓度设5个复孔,分别作用24、48和72 h后弃上清,再加入MTT 20 μL继续孵育4 h,弃上清后每孔加DMSO 150 μL并振荡。同时设空白对照组,测定各孔570 nm处的吸光度(A570) 值,细胞存活率(%)=A实验/A对照×100%。
2.3观察C6细胞凋亡形态 按5 000 cells/well密度将C6细胞接种于24 孔板中,培养24 h待细胞贴壁,加入不同浓度的越桔原花青素(0、10、20和40 μg/L),设空白对照组。培养72 h,倒置显微镜下观察并拍照。
2.4凋亡率检测 取对数生长期的C6细胞,按细胞浓度2×108/L接种于6 孔板,每孔2 mL。3个实验组均加入越桔原花青素,使其终浓度分别为10、20和40 μg/L,空白对照组加入等体积的基础培养液,置于37 ℃、5%CO2培养箱中培养,72 h 离心收集细胞。PBS 洗涤2 次,按照说明书操作,用1∶4 binding buffer 缓冲液190 μL 重悬细胞,调整细胞浓度为(2~5)×108/L,然后加入FITC标记的Annexin V-FITC 5 μL和20 mg/L PI 10 μL,置冰上10 min,流式细胞术检测各样品中每10 000 个细胞中细胞的凋亡率。
2.5免疫细胞化学法检测Bcl-2和Bax蛋白的表达 将C6细胞按1×104cells/well密度接种于置有玻片的24孔板中,实验设未加药物的对照组和越桔原花青素(10、20和40 μg/L)组,分别作用72 h后,10%甲醛溶液固定,灭活封闭,Bcl-2和Bax抗体孵育过夜,Ⅱ抗室温孵育1 h,显色、脱水、透明后封片,选择5个不同视野,采用Image-Pro Plus分析软件分析蛋白阳性产物的积分吸光度值,取平均值进行统计分析。
2.6Western blotting法检测Bcl-2、Bax和caspase-3蛋白的表达 取对数生长期的C6细胞,按细胞浓度1×108/L接种于6孔板中,每孔5 mL。实验组加入越桔原花青素,使其终浓度为10、20和40 μg/L,作用72 h,每组设3个复孔,空白对照组加入基础培养基。将细胞收至1.5 mL离心管中,离心后弃上清,PBS洗涤细胞,50 μL细胞裂解液充分裂解细胞。12 000×g、4 ℃ 离心15 min,留上清,测定样品蛋白浓度,SDS-PAGE跑胶分离样品,转膜封闭,加入β-actin、Bcl-2、Bax和caspase-3 抗体,4 ℃孵育过夜。Ⅱ抗室温孵育1 h,胶片曝光拍照。结果采用Image-Pro Plus图像分析管理系统分析,以特异性条带平均吸光度与面积的乘积为有效值,反映蛋白表达的水平。
3 统计学处理
应用SPSS 17. 0 统计软件处理,数据以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 越桔原花青素对C6胶质瘤细胞生长的抑制作用
MTT结果显示,10、20和40 μg/L越桔原花青素作用于C6胶质瘤细胞24、48和72 h,均可以明显地抑制细胞的生长。当越桔原花青素作用于C6细胞24和48 h,40 μg/L浓度组胶质瘤细胞的生长明显地受到抑制,与空白对照组比较,差异有统计学意义(P<0.01);越桔原花青素作用于C6细胞72 h,20和40 μg/L浓度组胶质瘤细胞的生长亦明显受抑制,与空白对照组比较,差异有统计学意义(均P<0.01) ,并且药物作用具有浓度依赖性,见图1。
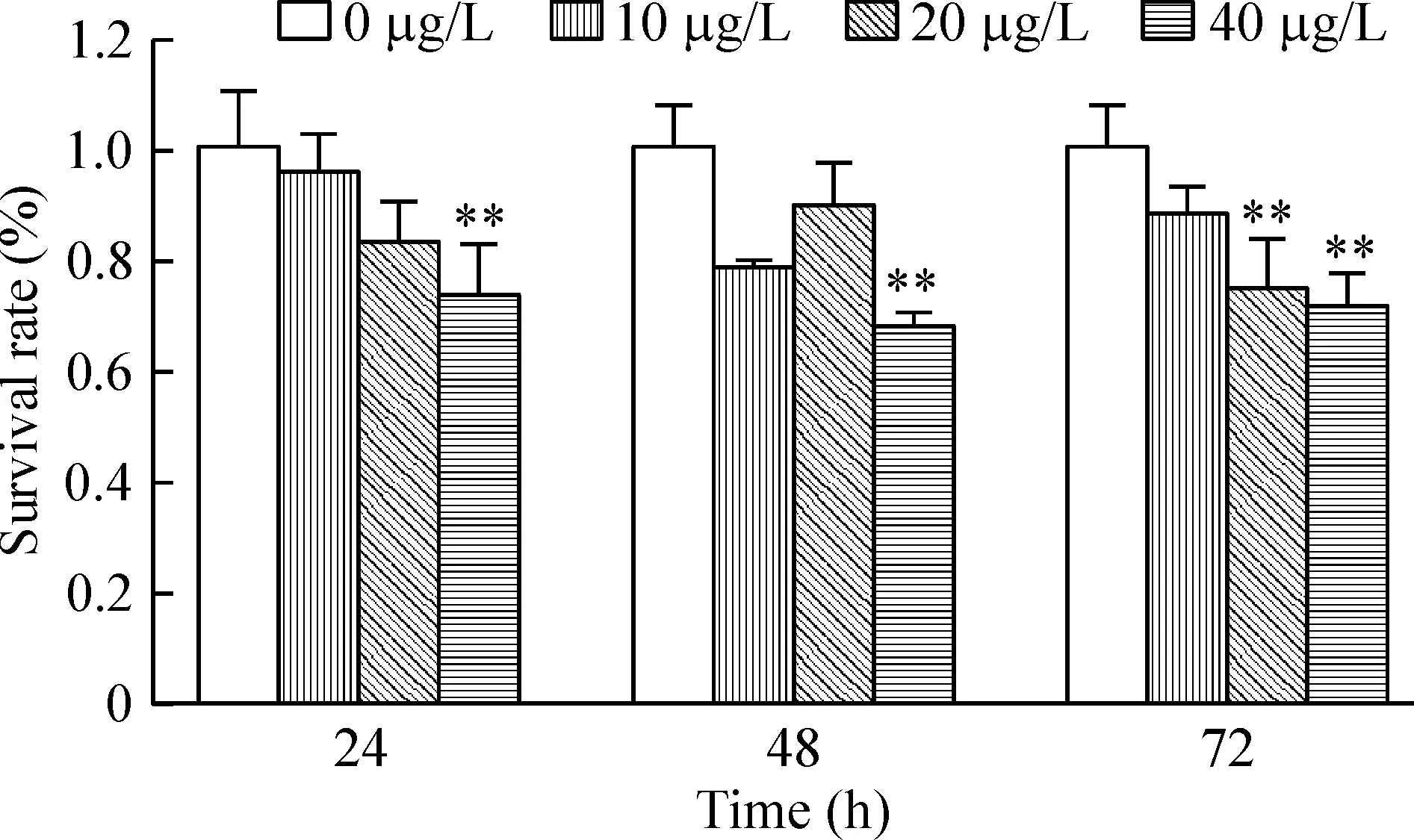
Figure 1. Effects of Vaccinium vitis procyanidin on the survival rate of C6 glioma cells. Mean±SD.n=5.**P<0.01 vs control group.
2 越桔原花青素抑制C6细胞生长的形态学观察
倒置显微镜下观察,10、20和40 μg/L越桔原花青素作用于C6细胞72 h,与空白对照组比较,各浓度组培养瓶内贴壁细胞明显减少,并且随着药物浓度的增高,细胞密度呈下降趋势,见图2。
3 越桔原花青素对C6细胞的诱导凋亡作用
10、20和40 μg/L越桔原花青素作用于C6细胞72 h后,Annexin V/PI分析各用药组凋亡率分别为(9.98±2.75)%、(16.57±3.43)%和(17.32±3.15)%,各组凋亡率均明显高于同期空白对照组(3.25±1.08)%,20和40 μg/L浓度组差异有统计学意义(P<0. 05),且各用药组的凋亡率随着药物剂量的增加而显著升高,见图3。

Figure 2. Vaccinium vitis procyanidin inhibited the growth of C6 cells observed under inverted microscope (×200).A:control group; B:10 μg/L group; C:20 μg/L group; D: 40 μg/L group.

Figure 3. Effects of Vaccinium vitis procyanidin on apoptosis of C6 glioma cells.
4 C6细胞凋亡相关蛋白的表达
免疫细胞化学结果显示,10、20和40 μg/L越桔原花青素作用于C6细胞72 h后,C6胶质瘤细胞表达Bcl-2蛋白随着药物浓度升高而减少,而表达Bax蛋白增加,但均无明显差异。计算Bax/Bcl-2比值发现,随着药物浓度升高,两者的比值明显升高,与空白对照组比较,差异有统计学意义(P<0.05或P<0.01),且具有明显的剂量依赖性,见图4。
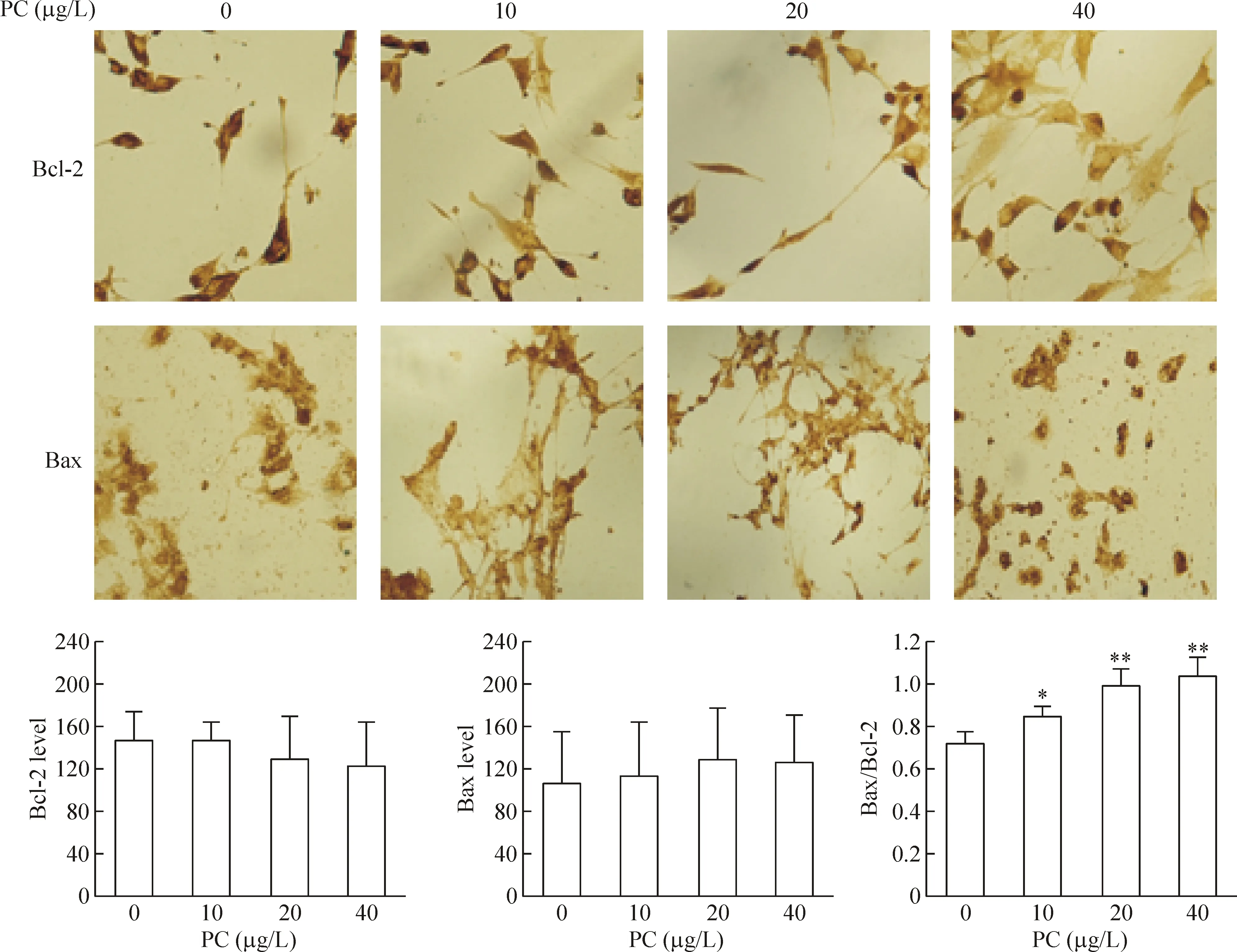
Figure 4. The changes of Bcl-2 and Bax protein expression in C6 cells after treated with Vaccinium vitis procyanidin (PC)(×200). Mean±SD.n=3.*P<0.05, **P<0.01 vs 0 μg/L group.
5 Western blotting结果
Western blotting结果显示,10、20和40 μg/L越桔原花青素作用于C6胶质瘤细胞72 h后,细胞表达Bcl-2蛋白减少,与空白对照组比较,差异具有统计学意义(P<0.01),并随着药物浓度升高,表达量逐渐减少;细胞表达Bax蛋白也增加,与对照组比较,各药物组差异均有统计学意义(均P<0.01)。检测细胞表达caspase-3蛋白发现,各药物组细胞表达均增加,与空白对照组比较,20 μg/L越桔原花青素组差异有统计学意义(P<0.01)。计算Bax/Bcl-2结果发现,与空白对照组比较,各药物组细胞的Bax/Bcl-2均明显增加(P<0.01),见图5。
讨 论
2007年北京市首次发布《全市健康状况白皮书》指出,恶性肿瘤第1次位居疾病死亡原因首位。而脑肿瘤由于其地位的特殊性,成为严重威胁人类健康的重大疾病之一。脑肿瘤大多数为胶质瘤,且以恶性居多[4],包括替莫唑胺在内的多种疗法对于患者生存期延长的意义不大[5]。有研究表明,这是由于在肿瘤发生过程中激活了肿瘤细胞的生长途径和/或抑制了肿瘤细胞的凋亡途径[6-8]。
肿瘤细胞在生长过程中由于凋亡信号转导通路出现障碍,使它具有极强的生长能力。Bcl-2家族成员是肿瘤凋亡研究的热点,研究表明,在线粒体膜上Bcl-2蛋白增多就会阻断Bax等促凋亡蛋白的诱导凋亡作用,当降低Bcl-2蛋白表达时就会消除这种阻遏作用,使Bax等激活,线粒体膜上大孔通道开放,从而线粒体内细胞色素C等蛋白释放,促使凋亡发生[9-10]。在肿瘤细胞内,当Bax/Bcl-2的比值增加也会引起肿瘤细胞凋亡[11]。在凋亡途径中,caspase-3是效应因子,是凋亡的执行者,当线粒体蛋白释放后就会使caspase-3活化裂解,使凋亡得以进行[12]。
本实验研究了不同浓度的越桔原花青素对脑胶质瘤细胞生长的作用,MTT结果显示,10、20和40 μg/L越桔原花青素作用24、48和72 h,均可以明显地抑制C6细胞的生长,并且随着药物浓度的升高,细胞生长受抑制更加明显;如果增加药物作用的时间,也可以增加细胞生长的抑制作用(图1)。当在倒置显微镜下观察10、20和40 μg/L越桔原花青素作用于C6细胞72 h,与空白对照组比较,各药物组细胞的密度随着药物浓度的升高而降低(图2)。以上这些结果提示,越桔原花青素可以抑制胶质瘤细胞的生长,且这种作用具有剂量依赖性。流式分析术分析其凋亡率发现,神经球的凋亡率亦随着药物浓度的增加而明显增加,也呈现明显的剂量效应(图3)。这说明越桔原花青素可能诱导C6细胞凋亡而抑制胶质瘤细胞的生长,但机制不清。
为了研究诱导胶质瘤细胞凋亡使生长受抑制的机制,本实验继续研究Bcl-2、Bax和caspase-3等相关凋亡蛋白的表达,细胞免疫组化和Western blotting结果表明,10、20和40 μg/L越桔原花青素作用于C6细胞72 h后,细胞表达Bcl-2蛋白减少而表达Bax蛋白增加,Bax/Bcl-2的比值随着药物浓度升高而升高,并且细胞表达Bcl-2蛋白减少呈现浓度依赖性(图4、5)。进一步检测细胞表达caspase-3蛋白发现,各药物组细胞表达caspase-3蛋白均增加,与空白对照组比较,20 μg/L越桔原花青素组差异有统计学意义(P<0.01)。并且由于越桔原花青素作用于C6胶质瘤细胞后,通过线粒体路径促使凋亡发生过程中,caspase-3活化是凋亡的下游事件,所以可能导致Bax/Bcl-2的结果与之不完全平行。
以上实验结果说明,越桔原花青素可以抑制胶质瘤细胞的生长,并且通过上调促凋亡蛋白Bax表达、下调Bcl-2表达,使Bax/Bcl-2的比值升高,增加促凋亡因素,最后促进下游效应因子caspase-3的活化增加,从而使肿瘤细胞凋亡。有研究显示,从葡萄籽中提取出来的原花青素低聚物虽可以使U87胶质瘤细胞死亡,但其主要不是通过凋亡途径来实现的[13],所以在越桔原花青素抑制胶质瘤细胞生长中是否有其它作用机制还需进一步研究。
[参 考 文 献]
[1] Zhao BX, Sun YB, Wang SQ, et al. Grape seed procyanidin reversal of p-glycoprotein associated multi-drug resistance via down-regulation of NF-κB and MAPK/ERK mediated YB-1 activity in A2780/T cells[J]. PLoS One, 2013, 8(8):e71071.
[2] 范红艳, 王艳春, 任 旷, 等. 越桔原花青素对大鼠心肌纤维化作用的影响[J]. 中国药理学通报, 2009, 25(5): 626-630.
[3] 范红艳, 王艳春, 任 旷, 等. 越桔原花青素对异丙肾上腺素诱导的大鼠心肌纤维化的抑制作用及机制[J]. 中国中药杂志, 2012, 37(3):344-347.
[4] Stupp R, Warren P, Martin J, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J]. N Engl J Med, 2005, 352(10): 987-996.
[5] Sathornsumetee S, Reardon DA, Desjardins A, et al. Molecularly targeted therapy for malignant glioma[J]. Can-cer, 2007, 110(1): 13-24.
[6] Giese A, Bjerkvig R, Berens ME, et al. Cost of migration: invasion of malignant gliomas and implications for treatment[J]. J Clin Oncol, 2003, 21(8): 1624-1636.
[7] Lefranc F, Brotchi J, Kiss R. Possible future issues in the treatment of glioblastomas: special emphasis on cell migration and the resistance of migrating glioblastoma cells to apoptosis[J]. J Clin Oncol, 2005, 23(10): 2411-2422.
[8] Qi L, Bellail AC, Rossi MR, et al. Heterogeneity of primary glioblastoma cells in the expression of caspase-8 and the response to TRAIL-induced apoptosis[J]. Apoptosis, 2011, 16(11): 1150-1164.
[9] Bellail AC, Qi L, Mulligan P, et al. TRAIL agonists on clinical trials for cancer therapy: the promises and the challenges[J]. Rev Recent Clin Trials, 2009, 4(1):34-41.
[10] 李 军, 王国荣, 张秀芹, 等. 二苯乙烯苷对同型半胱氨酸诱导血管内皮细胞凋亡及bcl-2、bax、caspase-3 表达的影响[J]. 中国病理生理杂志, 2013,29(4):743-747.
[11] 焦俊霞, 高维娟, 李玉明, 等. 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元Bcl-2 和Bax 表达的影响[J]. 中国病理生理杂志, 2011,27(5):905-910.
[12] Deng Y, Lin Y, Wu X. TRAIL-induced apoptosis requires Bax-dependent mitochondrial release of Smac/DIABLO[J]. Genes Dev, 2002, 16(1): 33-45.
[13] Zhang FJ, Yang JY, Mou YH, et al. Oligomer procyanidins from grape seeds induce a paraptosis-like programmed cell death in human glioblastoma U-87 cells[J]. Pharm Biol, 2010, 48(8):883-890.

