P53对蛋白激酶R和宫颈癌HeLa细胞生物学行为的影响
罗远材 郭 路
P53对蛋白激酶R和宫颈癌HeLa细胞生物学行为的影响
罗远材 郭 路
目的 探讨P53蛋白对蛋白激酶R(PKR)表达和活性以及对宫颈癌HeLa细胞生物学行为的影响。方法构建过表达p53基因的重组质粒pEGFP-C1/p53,转染HeLa细胞,采用逆转录-聚合酶链反应(RT-PCR)法检测pEGFP-C1/p53转染组、空质粒pEGFP-C1转染组及空白对照组(仅加入转染试剂)p53及PKR mRNA的表达;采用Western Blot法检测上述3组中P53、PKR、磷酸化型PKR(p-PKR),PKR下游底物真核细胞翻译启始因子2α (eIF2α)的磷酸化型p-eIF2α的表达;采用四甲基偶氮唑蓝(MTT)法检测HeLa细胞增殖活性变化,Transwell侵袭实验检测HeLa细胞侵袭能力变化。结果pEGFP-C1/p53转染组p53及PKR mRNA的相对表达量高于pEGFP-C1转染组和空白对照组(均P<0.05),pEGFP-C1转染组和空白对照组比较,差异无统计学意义;pEGFP-C1/p53转染组P53、PKR、p-PKR及p-eIF2α蛋白的相对表达量高于pEGFP-C1转染组和空白对照组(均P<0.05),pEGFP-C1转染组和空白对照组比较,差异无统计学意义;pEGFP-C1/p53转染组HeLa细胞增殖活性及侵袭能力均显著低于pEGFP-C1转染组和空白对照组(均P<0.05),pEGFP-C1转染组和空白对照组比较,差异无统计学意义。结论P53能上调PKR的表达及活性,激活PKR/eIF2α信号通路,抑制宫颈癌HeLa细胞增殖及侵袭。
基因,p53;蛋白激酶类;细胞增殖;肿瘤侵润;真核细胞翻译启始因子2α
高危型人乳头状瘤病毒(high-risk human papilloma virus,hsHPV)感染宫颈上皮细胞在宫颈癌的成因中起重要作用。蛋白激酶R(PKR)是机体抗病毒防御机制中的重要分子,在抵御病毒感染、抗肿瘤方面均发挥重要的生物学效应。本研究小组前期工作发现,在宫颈癌HeLa细胞中,PKR的表达及活性均受到明显的抑制[1]。因此,寻找能够上调PKR表达及活性的调控因子对于抵御宫颈hsHPV感染、预防及治疗宫颈癌均具有重要意义。p53基因是机体重要的抑瘤基因,其在诱导细胞周期阻滞、调节细胞的分化与衰老等方面发挥重要作用,并参与多种基因的调控[2]。本研究采用使宫颈癌HeLa细胞过表达p53的方法来观察其对PKR表达及活性、HeLa细胞生物学行为的影响,现报告如下。
1 材料与方法
1.1 材料 人宫颈癌HeLa细胞由天津医科大学基础医学院细胞形态学实验室提供;pEGFP-C1质粒载体、大肠杆菌菌株XL1-Blue感受态细胞、内切酶KpnⅠ和BamHⅠ、T4DNA连接酶,购自天津赛尔生物技术有限公司;新生胎牛血清(FBS)、DMEM高糖培养基,购自美国Hyclone生物科技发展公司;质粒转染试剂LipofectamineTM2000购自美国Invitrogen公司;RNA提取及逆转录和扩增试剂盒均购自北京全式金生物公司;小鼠抗人管家基因甘油醛-3-磷酸脱氢酶(GAPDH)内参单克隆抗体、兔抗人PKR、磷酸化型PKR(p-PKR)(Thr446)、磷酸化型真核细胞翻译启始因子2α(peIF2α)(Ser51)、突变型p53多克隆抗体购自美国Santa Cruz生物公司;HRP-标记山羊抗小鼠IgG、HRP-标记山羊抗兔IgG购自北京中杉金桥生物公司;噻唑蓝(MTT)粉末购自Sigma公司;Transwell侵袭小室购自美国BD公司。
1.2 方法
1.2.1 细胞培养条件及生长特点 人宫颈癌HeLa细胞培养于含10%FBS的DMEM高糖培养基中,培养条件为37℃、5% CO2、相对湿度90%,置于细胞培养箱中培养。细胞呈单层贴壁生长,铺满培养瓶后用胰蛋白酶消化后进行传代。
1.2.2 载体构建及转染 设计含有KpnⅠ、BamHⅠ酶切位点并能扩增p53基因(序列号:NC_000017)的引物序列,上游5′-CGGGGTACCATGGAGGAGCCGCAGTCAGATCC-3′,下游5′-CGCGGATCC TCAGTCTGAGTCAGGCCCTTCTG-3′,扩增片段长度1 182 bp。PCR法扩增p53基因序列,反应程序:94℃预变性4 min;94℃变性45 s,58℃退火40 s,72℃延伸90 s,30个循环;72℃附加延伸10 min。扩增产物经KpnⅠ和BamHⅠ双酶切后连入线性化的pEGFP-C1质粒载体,连接产物转化大肠杆菌菌株XL1-Blue感受态细胞进行扩增,然后回收、纯化重组质粒进行酶切鉴定,获得重组质粒pEGFP-C1/p53;转染前1 d将2×105的HeLa细胞接种至6孔板中,用2 mL的DMEM高糖培养基(含10%FBS)培养24 h后,将p53过表达质粒pEGFP-C1/p53载体及其对应空载体pEGFP-C1转染HeLa细胞,转染步骤严格按照转染试剂LipofectamineTM2000的操作说明进行。实验分3组:pEGFPC1/p53转染组、pEGFP-C1转染组及空白对照组(仅加入转染试剂),转染6 h后更换为含10%FBS的完全培养液,在37℃、5%CO2、相对湿度90%的细胞培养箱中继续培养48 h,进行下列实验,mRNA及蛋白提取所用细胞数量级相同,每种实验至少重复3次。
1.2.3 逆转录-聚合酶链反应(RT-PCR)法检测p53及PKR mRNA的表达 转染48 h后收集细胞,Trizol法提取细胞总RNA,检测RNA纯度:吸光度(A)260/A280在1.8~2.0之间,琼脂糖凝胶电泳鉴定总RNA的完整性。取4 μL总RNA,加入到20 μL逆转录反应体系中,逆转录获得cDNA,然后以p53及PKR对应的PCR引物以及GAPDH作内参进行PCR检测。RNA提取及逆转录和扩增的实验步骤严格按照试剂盒说明进行。引物序列:GAPDH上游5′-AGCCACATCGCTCAGACAC-3′,下游5′-CCATCACGCCACAGTTTCC-3′,扩增片段长616 bp;p53上游5′-AGAATCTCCGCAAGAAAGG-3′,下游5′-GCTGGTATGTCCTACTCCC-3′,扩增片段长度539 bp;PKR上游5′-AAGAAGAGGCGAGAAACTAG-3′,下游5′-TTCAGAAGGGCTCTAACATG-3′,扩增片段长度529 bp。PCR反应程序:94℃预变性4 min;94℃变性30 s,56℃退火1 min,72℃延伸40 s,40个循环;72℃附加延伸6 min。PCR产物进行2%琼脂糖凝胶电泳,经凝胶成像分析系统扫描、成像,用Bio-Rad成像分析软件Quantity One分析结果。
1.2.4 Western Blot检测P53、PKR、p-PKR、p-eIF2α及GAPDH蛋白的表达 转染48 h后收集细胞,提取细胞总蛋白,BCA法测定蛋白浓度后进行12%SDS-PAGE变性胶电泳、转膜、5%脱脂奶粉溶液封闭2 h后加入一抗工作液于4℃过夜,TBST洗膜、加入二抗工作液室温孵育2 h、TBST洗膜后加入化学发光底物,感光胶片显影,经凝胶成像分析系统扫描、成像,用Bio-Rad成像分析软件Quantity One分析结果。目的条带相对含量=目的条带灰度值/标准内参灰度值。
1.2.5 MTT法检测HeLa细胞增殖活性 于96孔板中,用p53过表达质粒pEGFP-C1/p53载体及其对应空载体pEGFP-C1转染HeLa细胞,每组设6个复孔,每孔分别加入新鲜配制的5 g/L MTT溶液20 μL,同时设置调零孔。培养箱内温育4 h,分别于转染后12、24和48 h各检测1次。检测前每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,酶标仪波长490 nm处检测各孔的A值,以此间接代表每组细胞的增殖状态。
1.2.6 Transwell侵袭实验检测HeLa细胞侵袭能力 于24孔板中,每组设4个复孔,将Matrigel基质胶稀释1倍后均匀铺于Transwell小室的上室微孔膜上,37℃孵育4 h。收集转染48 h后的HeLa细胞制成单细胞悬液,调整细胞密度至2×105/mL,在37℃、5%CO2培养箱中饥饿培养24 h。Transwell小室的上室加入不含血清的饥饿培养细胞悬液200 μL 及0.1%BSA,下室加入500 μL含15%FBS的DMEM培养基,常规培养36 h,棉签擦去上室上面的非侵袭细胞及基质胶,4%多聚甲醛室温固定30 min,0.01%伊红染液37℃染色30 min,将小室晾干,正置于载玻片上,在倒置显微镜下随机读取10个200×视野,计数穿膜细胞数目并取均值。
1.3 统计学方法 采用SPSS 13.0软件对所得数据进行统计分析。计量资料多组间比较用单因素方差分析,多重比较采用Newman-Keuls-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组p53、PKR mRNA的表达水平 p53及PKR mRNA的相对表达量在pEGFP-C1/p53转染组均高于pEGFP-C1转染组和空白对照组(P<0.05),而pEGFP-C1转染组与空白对照组比较差异无统计学意义,见图1、表1。

Fig.1 Transcription level of p53 and PKR in every group图1 各组p53、PKR mRNA的表达
2.2 各组P53、PKR、p-PKR、p-eIF2α蛋白的表达水平 P53、PKR、p-PKR、p-eIF2α蛋白的相对表达量在pEGFP-C1/p53转染组均高于pEGFP-C1转染组和空白对照组(P<0.05),而pEGFP-C1转染组与空白对照组比较差异无统计学意义(P>0.05),见图2、表1。
2.3 各组HeLa细胞增殖活性 转染后12 h,细胞增殖活性A值3组间差异无统计学意义(P>0.05);转染后24 h和48 h,pEGFP-C1/p53转染组细胞增殖活性A值均低于pEGFP-C1转染组和空白对照组(P<0.05),而pEGFP-C1转染组与空白对照组比较差异无统计学意义(P>0.05),见表2。
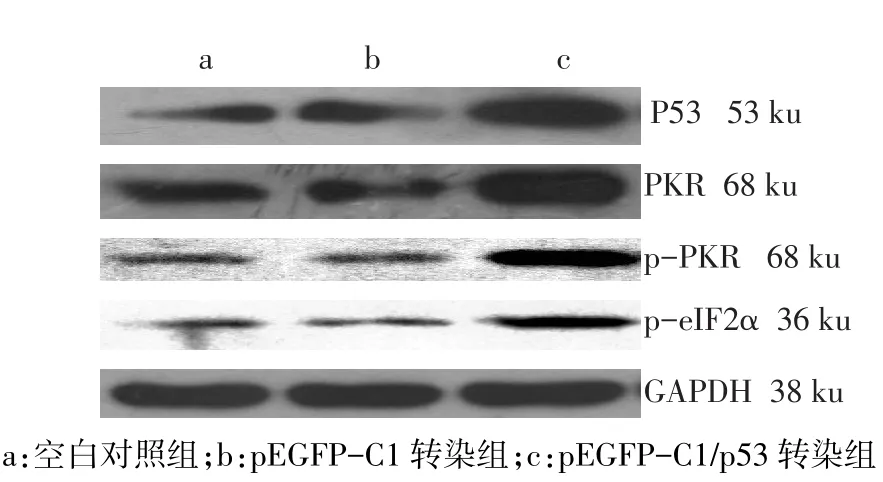
Fig.2 Protein expression of p53,PKR,p-PKR and p-eIF2α in every group图2 各组P53、PKR、p-PKR、p-eIF2α蛋白的表达
Tab.1 Transcription levels of of p53,PKR mRNA and protein expression levels of P53,PKR,p-PKR and p-eIF2α in every group表1 各组p53、PKR mRNA及P53、PKR、p-PKR、p-eIF2α蛋白的表达水平 (n=6,±s)
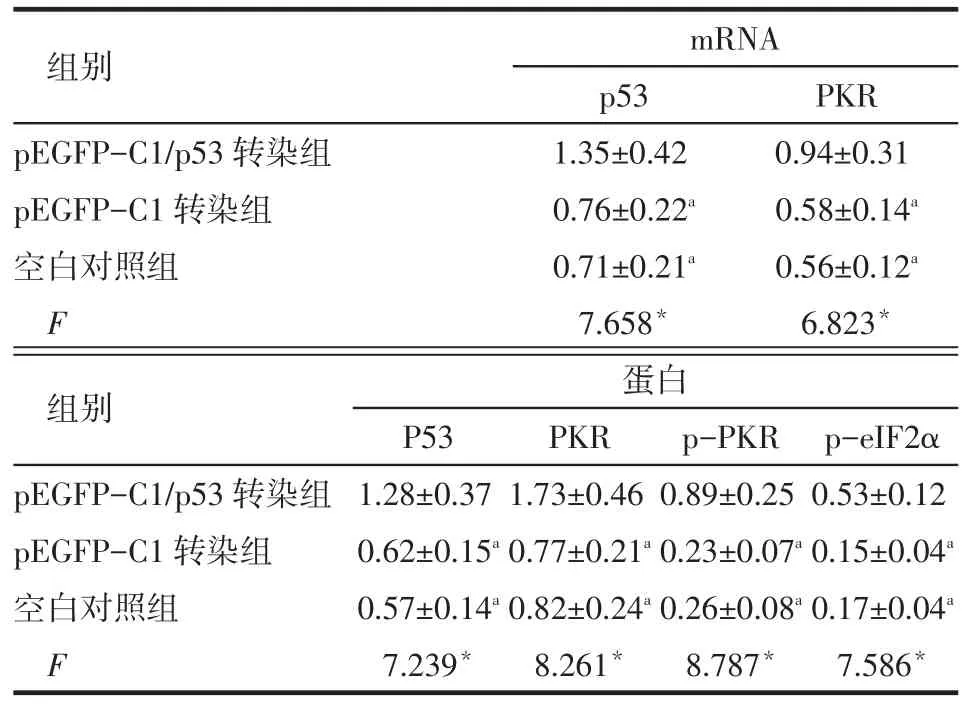
Tab.1 Transcription levels of of p53,PKR mRNA and protein expression levels of P53,PKR,p-PKR and p-eIF2α in every group表1 各组p53、PKR mRNA及P53、PKR、p-PKR、p-eIF2α蛋白的表达水平 (n=6,±s)
*P<0.05;a与pEGFP-C1/p53转染组比较,P<0.05,表2同
组别pEGFP-C1/p53转染组pEGFP-C1转染组空白对照组F mRNA p53 1.35±0.42 0.76±0.22a0.71±0.21a7.658*PKR 0.94±0.31 0.58±0.14a0.56±0.12a6.823*组别pEGFP-C1/p53转染组pEGFP-C1转染组空白对照组F蛋白P53 1.28±0.37 0.62±0.15a0.57±0.14a7.239*PKR 1.73±0.46 0.77±0.21a0.82±0.24a8.261*p-PKR 0.89±0.25 0.23±0.07a0.26±0.08a8.787*p-eIF2α 0.53±0.12 0.15±0.04a0.17±0.04a7.586*
Tab.2 Comparison of absorbance value and transmembrane cell number in every group表2 各组细胞增殖活性及穿膜细胞数比较(n=6,±s)

Tab.2 Comparison of absorbance value and transmembrane cell number in every group表2 各组细胞增殖活性及穿膜细胞数比较(n=6,±s)
组别pEGFP-C1/p53转染组pEGFP-C1转染组空白对照组F转染后细胞增殖活性(A值) 12 h 0.47±0.12 0.56±0.14 0.58±0.14 2.496 24 h 0.52±0.13 0.77±0.18a0.79±0.19a6.709*48 h 0.35±0.09 0.86±0.21a0.88±0.21a7.596*穿膜细胞数(个)22.7±4.6 41.8±7.3a45.2±7.9a18.515**
2.4 各组HeLa细胞侵袭能力 pEGFP-C1/p53转染组穿膜细胞数均低于pEGFP-C1转染组和空白对照组(P<0.05),而pEGFP-C1转染组与空白对照组比较差异无统计学意义(P>0.05),见表2。
3 讨论
p53基因编码393个氨基酸组成的53 ku的核内磷酸化蛋白,被称为P53蛋白。P53蛋白控制着细胞周期的启动,与细胞周期的调控、DNA修复、细胞分化、细胞凋亡等重要的生物学功能有关[3]。目前研究认为,hsHPV E6蛋白能使P53蛋白灭活,而hsHPV感染恰恰是宫颈癌发生的重要因素,因此,p53基因在宫颈癌细胞的表达及活性被抑制[4]。笔者在前期工作中发现,通过RNA干扰的办法沉默宫颈癌HeLa细胞HPV18 E6基因的表达,PKR的表达及磷酸化水平均显著升高[1]。究其原因,除了HPV18 E6蛋白对PKR的直接抑制作用外,还可能与HPV18 E6蛋白表达降低,部分恢复P53蛋白的表达及活性,增强了其对PKR的正调节作用有关。
PKR是一种丝氨酸-苏氨酸蛋白激酶,在病毒复制过程中产生的双链RNA能与PKR结合,诱使PKR分子构型发生改变,导致其多个丝氨酸、苏氨酸位点自动磷酸化而被激活,其中以第446位苏氨酸残基磷酸化最为重要[5-7]。PKR的底物主要是真核细胞翻译启动因子2α(eIF2α),激活的PKR能使eIF2α第51位丝氨酸残基磷酸化,磷酸化的eIF2α再通过其下游一系列级联反应,最终导致宿主细胞蛋白合成完全受到抑制而凋亡[7]。通过抑制蛋白合成、诱导感染细胞凋亡是PKR抑制病毒复制及传播、及时清除病变细胞的主要机制。因此,PKR是宿主防御机制中发动细胞死亡来对抗病毒感染和肿瘤形成的重要靶点,而PKR/eIF2α信号通路的活性维持对控制HPV感染、及时清除肿瘤前体细胞具有重要意义。相关研究认为,P53蛋白能直接作用于干扰素调节因子9(IRF9),其为干扰素激活PKR途径中的重要因子,亦能直接作用于PKR的启动子,对PKR的表达及激活起重要作用[8-9]。
为进一步验证宫颈癌HeLa细胞中p53对PKR的调节作用,本研究成功构建了过表达p53基因的重组质粒载体pEGFP-C1/p53,将其转染宫颈癌HeLa细胞后发现,PKR的表达及活性(磷酸化水平)均显著升高,表明p53确实对PKR的表达及活性具有升调节作用。PKR是一个重要的凋亡效应因子,本研究结果显示,在PKR表达及活性升高的情况下,其下游底物p-eIF2α水平亦明显升高,在此情况下HeLa细胞蛋白合成将受到显著地抑制而发生凋亡,导致其增殖活性下降,而穿膜细胞数的显著降低亦表明HeLa细胞的侵袭能力同样受到了明显的抑制。以上结果表明,P53蛋白通过上调PKR的表达及活性激活了PKR/eIF2α信号传导通路,间接导致HeLa细胞的增殖及侵袭能力受到了明显的抑制,故P53可作为PKR/eIF2α信号通路的有效调节者。
有研究指出,p53与PKR共表达对调控细胞周期阻滞有协同作用,PKR还可促进P53蛋白磷酸化、增强其稳定性及活性[10],对阻断HPV感染及诱导病变细胞凋亡无疑具有重要意义。但如何持久保持两者在宫颈病变细胞中的活性还有待更深入的研究。
[1]Luo YC,Qu QX,Mi RR,et al.Effect on expression and activation of PKR and eIF2α and biological characters of cervical carcinoma HeLa cell by HPV18 E6 oncogene[J].Chin J Obstet Gynecol,2011,46(2):138-140.[罗远材,瞿全新,糜若然,等.HPV18E6基因对HeLa细胞PKR、eIF2α表达、激活及其生物学行为的影响[J].中华妇产科杂志 ,2011,46(2):138-140.]doi:10.3760/cma.j.issn.0529-567x.2011.02.014.
[2]Huang YX,Mo WY,Zong LL,et al.Relationship between tumor suppressor p53 gene rs1042522 polymorphisms and the risk of endometriosis:A systematic review[J].Med J Chin PLA,2014,39(8): 618-623.[黄郁馨,莫雯驭,宗利丽,等.p53基因rs1042522多态性与子宫内膜异位症发病风险相关性的Meta分析[J].解放军医学 杂 志,2014,39(8):618-623.]doi:10.11855/j.issn.0577-7402.2014.08.05.
[3]Ozaki T,Nakagawara A,Nagase H.RUNX Family Participates in the Regulation of p53-Dependent DNA Damage Response[J].Int J Genomics,2013,2013:271347.doi:10.1155/2013/271347.
[4]Ruttkay-Nedecky B,Jimenez Jimenez AM,Nejdl L,et al.Relevance of infection with human papillomavirus:The role of the p53 tumor suppressor protein and E6/E7 zinc finger proteins[J].Int J Oncol,2013,43(6):1754-1762.doi:10.3892/ijo.2013.2105.
[5]Nallagatla SR,Toroney R,Bevilacqua PC.Regulation of innate immunity through RNA structure and the protein kinase PKR[J].Curr Opin Struct Biol, 2011,21(1):119- 127. doi: 10.1016/j. sbi.2010.11.003.
[6]Su QZ,Wang S,Baltzis D,et al.Tyrosine phosphorylation acts as a molecular switch to full-scale activation of the eIF2a RNA-dependent protein Kinase[J].PNAS,2006,103(1):63-68.doi:10.1073/ pnas.0508207103.
[7]Kazemi S,Papadopoulou S,Li SY,et al.Control of alpha subunit of eukaryotic translation initiation factor 2(eIF2 alpha)phosphorylation by the human papillomavirus type 18 E6 oncoprotein:implications for eIF2 alpha-dependent gene expression and cell death[J]. MolCellBiol,2004,24(8):3415-3429.doi:10.1128/ MCB.24.8.3415-3429.2004.
[8]Dharel N,Kato N,Muroyama R,et al.Potential contribution of tumor suppressor p53 in the host defense against hepatitis C virus[J]. Hepatology,2008,47(4):1136-1149.doi:10.1002/hep.22176.
[9]Yoona CH,Lee DS,Limb DS,et al.PKR,a p53 target gene,plays a crucial role in the tumor-suppressor function of p53[J].PNAS, 2009,106(19):7852-7857.doi:10.1073/pnas.0812148106.
[10]Bennett RL,Pan Y,Christian J,et al.The RAX/PACT-PKR stress response pathway promotes p53 sumoylation and activation,leading to G1 arrest[J].Cell Cycle,2012,11(2):407-417.doi:10.4161/ cc.11.2.18999.
(2014-02-13收稿 2014-09-05修回)
(本文编辑 魏杰)
Effect of p53 on Protein Kinase R and Biological Behavior of Cervical Cancer HeLa Cells
LUO Yuancai,GUO Lu
Department of Gynecology and Obstetrics,Tianjin First Central Hospital,Tianjin 300192,China
ObjectiveTo investigate the effects of p53 on expression and activity of protein kinase R(PKR)as well as biological characters of HeLa cells from cervical carcinoma patients.MethodsRecombinant plasmid vector pEGFPC1/p53 was constructed to over-express p53 then it was transfected into HeLa cells.Transcription levels of p53 and PKR mRNA were detected by reverse transcriptase polymerase chain reaction(RT-PCR)among pEGFP-C1/p53 transfection group,pEGFP-C1 transfection group and blank control group(only transfection reagent was added);Protein expression levels of p53,PKR,phosphated PKR(p-PKR)and phosphated α subunit of eukaryotic initiation factor 2(p-eIF2α)which is the downstream substrate of PKR were detected by Western Blot among three groups;Proliferation of HeLa cell were determined by methyl thiazolyl tetrazolium(MTT)assay;Invasion of HeLa cell were determined by Transwell cell assay.ResultsRecombinant plasmid vector pEGFP-C1/p53 was successfully constructed to overexpress p53;Transcription level of p53 and PKR mRNA in pEGFP-C1/p53 transfection group were higher than those in pEGFP-C1 transfection group and in blank control group(P<0.05),and there were no significant difference between their levels in pEGFP-C1 transfection group and in blank control group;Protein expression levels of p53,PKR,p-PKR andp-eIF2α in pEGFP-C1/p53 transfection group were higher than those in pEGFP-C1 transfection group and in blank control group(P<0.05),and there were no significant difference between those expression levels in pEGFP-C1 transfection group and in blank control group;MTT and Transwell cell results showed that proliferation and invasion of HeLa cells in pEGFP-C1/p53 transfection group were weaker than those in pEGFP-C1 transfection group and in blank control group(P<0.05),and there were no significant difference between proliferation and invasion of HeLa cells in pEGFP-C1 transfection group and in blank control group.Conclusionp53 can up-regulate the expression and activity of PKR,promote activation of PKR/eIF2α signal transduction passage and restrain cell proliferation and invasion of HeLa cells.
genes,p53;protein kinases;cell proliferation;neoplasm invasiveness;α subunit of eukaryotic initiation factor 2
R737.33
A
10.3969/j.issn.0253-9896.2014.12.005
天津市卫生局科技基金重点项目(2012KR05)
天津市第一中心医院妇产科(邮编300192)

