子宫内膜异位症中子宫内膜间质细胞侵袭、转移能力的研究
苏晓华宋殿荣 张 崴郭 洁王雅楠赵 琳
子宫内膜异位症中子宫内膜间质细胞侵袭、转移能力的研究
苏晓华1宋殿荣2△张 崴2郭 洁2王雅楠2赵 琳2
目的 检测子宫内膜异位症(EMs)患者子宫内膜间质细胞中环氧化酶-2(COX-2)、前列腺素E2(PGE2)、锌指转录因子(Snail)和E-钙黏蛋白(E-cadherin)mRNA表达情况,分析EMs中子宫内膜间质细胞的侵袭、转移能力。方法收集EMs患者的在位及异位病灶子宫内膜组织和子宫肌瘤患者的在位内膜组织,原代消化培养子宫内膜细胞,取纯化的第4代子宫内膜间质细胞进行研究,RT-PCR法检测细胞COX-2、PGE2、Snail和E-cadherin mRNA的表达。结果EMs和子宫肌瘤患者分泌期在位子宫内膜间质细胞COX-2、PGE2、Snail和E-cadherin mRNA表达与增殖期比较差异均无统计学意义;EMs患者在位及异位的子宫内膜间质细胞COX-2、PGE2、Snail mRNA表达比肌瘤患者在位细胞均明显升高,而E-cadherin mRNA表达降低(P<0.05或P<0.01);EMs患者异位的子宫内膜间质细胞COX-2、PGE2、Snail mRNA表达比在位间质细胞升高,而E-cadherin mRNA表达降低(P<0.05或P<0.01)。结论EMs患者的子宫内膜间质细胞侵袭、转移能力强于非EMs患者,且在EMs发病中异位病灶子宫内膜间质细胞的侵袭、转移能力更强。
子宫内膜异位症;环氧化酶-2;前列腺素E2;锌指转录因子;E-钙黏蛋白
子宫内膜异位症(EMs)是妇科常见疾病,可引起10%~15%的育龄期妇女不孕和盆腔痛,其虽为良性疾病,却具有无限生长、生成新生血管、浸润并破坏周围组织和局部或远处转移等恶性肿瘤的一些特性。子宫内膜间质细胞具有持续增殖、抗凋亡、促进血管生成、侵袭、转移和调节局部免疫系统等作用。本研究利用子宫内膜细胞体外培养技术,采用RTPCR法研究体外培养的EMs患者在位及异位子宫内膜间质细胞中环氧化酶-2(COX-2)、前列腺素E2(PGE2)、锌指转录因子(Snail)和E-钙黏蛋白(E-cadherin)mRNA的表达,探讨EMs中在位及异位子宫内膜间质细胞的侵袭、转移能力。
1 材料与方法
1.1 标本采集 标本取自2012年10月—2013年12月在天津中医药大学第二附属医院妇科因子宫肌瘤、卵巢巧克力囊肿行手术治疗的已婚妇女,患者年龄23~49岁,平均(32.56±7.42)岁,既往均月经规律,未放置宫内节育器,术前6个月内未服用抗炎、激素类等药物治疗。在位子宫内膜组织取自术前行诊断性刮宫术的内膜,病理证实子宫内膜无病理性改变;异位内膜组织取自手术切除的卵巢异位病灶,术后病理证实符合EMs。共收集子宫肌瘤患者在位子宫内膜组织30例,其中增殖期内膜18例,分泌期12例;EMs患者在位内膜组织35例,其中增殖期内膜25例,分泌期10例;卵巢异位病灶35例。所有标本的采集均得到患者本人或家属知情授权,并经医院伦理委员会批准。
1.2 主要试剂 培基(HyCloneSH30023.01B)、胎牛血清(HyCloneSV30087.02)、胰酶(Invitrogen)、双抗(GIBCO 15140-122)、Ⅰ型胶原酶(SIGMA)、无酶水(QIAGEN 129115)、抗波形蛋白抗体(Abcam ab8069)、抗角蛋白抗体(Abcam ab7754)、藻红蛋白抗体(VECTOR EI-2007)、总RNA提取试剂盒(天根,DP419)、Quant一步法RT-PCR试剂盒(天根,KR113)。
1.3 主要仪器 二氧化碳培养箱(CH9-80)、倒置显微镜(37XB)、低速台式离心机(L-500)、微型高速台式冷冻离心机(H-1600W)、PCR仪(9700)、电泳仪(MiniSC)、凝胶电泳成像仪(ChampGel-5000)、紫外可见分光光度计(UV7804)。
1.4 实验方法
1.4.1 取材 将标本迅速放入装有冰全培基(含有1%双抗、10%胎牛血清、89%DMEM/F12)的离心管中,30 min内移入实验室于紫外线消毒后的超净台中进行操作。
1.4.2 子宫内膜细胞原代培养 取材后将无菌离心管中的标本倒入消毒后的无菌培养皿中,用无菌冰Hanks漂洗3~5次,去除血块,至组织变白净。用眼科剪将组织剪成约1 mm3的碎块,放入15 mL无菌离心管中,加入3倍体积消化酶,用移液器轻柔吹打混合均匀后,置于37℃恒温箱中消化40 min,同时轻轻摇晃,使细胞和消化酶充分接触,彻底消化,直至组织呈云雾状。加入含10%胎牛血清的DMEM/F12全培基终止消化,吹打混匀,400 r/min的速度离心3 min,使组织沉淀,将上清液移入15 mL离心管中,1 000 r/min速度离心7 min,弃上清液,加入全培基悬浮细胞,进行细胞计数,以1× 105/mL密度接种于25 cm2培养瓶中,置37℃、5%CO2的培养箱内培养,24 h后观察细胞贴壁情况并换液,隔48 h换液1次。
1.4.3 子宫内膜细胞传代培养 倒置显微镜下观察,当原代细胞长满瓶壁约80%时进行传代,弃去培养瓶中的培养液,无菌PBS洗涤3次,加入0.25%含EDTA的胰酶3 mL,于37℃培养箱中消化,每3 min轻摇培养瓶1次,显微镜下观察,当细胞收缩变圆即将离开培养瓶时加入全培基终止消化,用移液管反复吹打瓶壁细胞,将细胞悬液移入15 mL离心管中,1 000 r/min离心7 min,弃上清,加入全培基混匀,进行细胞计数,以1∶2或1∶3比例传代,置37℃、5%CO2的培养箱内培养,隔48 h换液1次。
1.4.4 子宫内膜间质细胞分离纯化 参考Beliard等[1]用差速沉降法结合筛网过滤法将子宫内膜间质细胞与腺上皮细胞分离、纯化,具体方法是将胰酶消化后的第2代子宫内膜细胞悬液经250 μm筛网过滤去除黏液和未消化的组织,加10 mL全培基混匀,静置30 min,吸取顶部8 mL细胞悬液移入新的15 mL离心管中,1 000 r/min离心7 min,弃上清,再加入10 mL全培基混匀,静置30 min,将顶部8 mL细胞悬液经400 μm筛网过滤去除残留的腺上皮细胞团,收集过滤后的间质细胞加入全培基混匀,进行细胞计数,以1×105/mL密度接种于25 cm2培养瓶中,置37℃、5%CO2的培养箱内培养,24 h后观察细胞贴壁情况并换液,隔48 h换液1次。
1.4.5 子宫内膜间质细胞鉴定 (1)吉姆萨染色形态学鉴定。将纯化后的第4代子宫内膜间质细胞接种到6孔板内,待细胞长满40%时进行形态学鉴定。4%甲醛固定3 min,PBS洗涤2 min×3遍,吉姆萨染色液室温染色15 min,PBS洗涤2 min×3遍,晾干后于显微镜下观察。(2)免疫荧光鉴定。将纯化后的第4代子宫内膜间质细胞接种到6孔板内,待细胞长满40%时进行免疫荧光鉴定。4%甲醛固定10 min,PBS洗涤2 min×3遍,0.1%Triton×100室温透化5 min,PBS清洗2 min×3遍,2%BSA室温封闭1 h,吸去BSA,加入一抗(鼠抗人波形蛋白和鼠抗人角蛋白,1∶200浓度),PBS作阴性对照组,封闭孔板,4℃避光过夜。PBS清洗2 min×3遍,10 mg/L藻红蛋白室温孵育1 h,吸弃,PBS清洗2 min×3遍,避光,5 mg/L Hoechst室温复染核3 min,PBS清洗2 min×6遍,荧光显微镜下观察。
1.4.6 子宫内膜间质细胞COX-2、PGE2、Snail和E-cadherin mRNA表达检测 将第4代子宫内膜间质细胞接种到75 cm2培养瓶,待细胞长满后消化,采用RT-PCR法检测COX-2、PGE2、Snail、E-cadherin mRNA表达。(1)子宫内膜间质细胞总RNA提取。严格按试剂盒说明操作,测定光密度(OD)260及OD280以估算总RNA的浓度及纯度,并用1%琼脂糖凝胶电泳鉴定总RNA完整性,提取的总RNA于-80℃保存。(2)引物序列。见表1。(3)RT-PCR扩增反应。取1 μg总RNA,分别扩增COX-2、PGE2、Snail、E-cadherin及β-actin基因,反应体系为25 μL,反应条件:50℃30 min,94℃预变性2 min;94℃变性45 s,53~56℃退火45 s(根据不同目的基因选择相应的退火温度),65℃延伸1 min,共35次循环;65℃终延伸10 min,4℃保存。取各组PCR产物7 μL加入样本孔中行1.5%琼脂糖凝胶电泳,在200 mA电流下电泳15 min,紫外灯下观察电泳条带,每个样本经PCR扩增后以Marker作为参照。(4)PCR产物半定量分析。PCR产物电泳后经Gel-PRO ANALYZER凝胶定量分析软件对电泳条带进行灰度分析,目的基因相对表达强度=目的基因电泳条带灰度值/β-actin内参照条带灰度值。每个样本重复4次实验。

Tab.1 Primer sequences of COX-2,PGE2,Snail,E-cadherin and β-actin for RT-PCR表1 COX-2、PGE2、Snail、E-cadherin、β-actin的引物序列
1.5 统计学方法 采用SPSS 11.5统计软件进行分析处理,数据以±s表示,2组间比较采用两独立样本t检验。3组间比较采用单因素方差分析,多重比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1 细胞培养情况及鉴定 30例子宫肌瘤患者在位子宫内膜中29例成功培养出子宫内膜细胞,1例染菌;35例巧克力囊肿患者在位内膜中33例成功培养出子宫内膜细胞,2例染菌,异位病灶中25例成功培养出子宫内膜细胞,10例因病灶过小未培养出细胞,无染菌标本。经差速沉降法结合筛网过滤法获得的子宫内膜间质细胞纯度可达95%,第4代间质细胞经吉姆萨染色可见细胞呈梭形,胞核呈椭圆形,未见多角形的腺上皮细胞;免疫荧光鉴定结果鼠抗人角蛋白(Cytokeratin)染色阴性,而鼠抗人波形蛋白(Vimentin)染色阳性,见图1,证实研究的子宫内膜细胞中以间质细胞为主。
2.2 子宫内膜间质细胞COX-2、PGE2、Snail、E-cadherin mRNA表达水平比较
2.2.1 子宫内膜细胞总RNA提取结果 所提取的细胞总RNA OD260/OD280介于1.8~2.0,电泳可见清晰的18 S和28 S 2个条带,且2条带的OD比值为28 S∶18 S>2∶1,说明所提取的总RNA纯度较高且较完整,无DNA、酚、蛋白的污染,见图2。
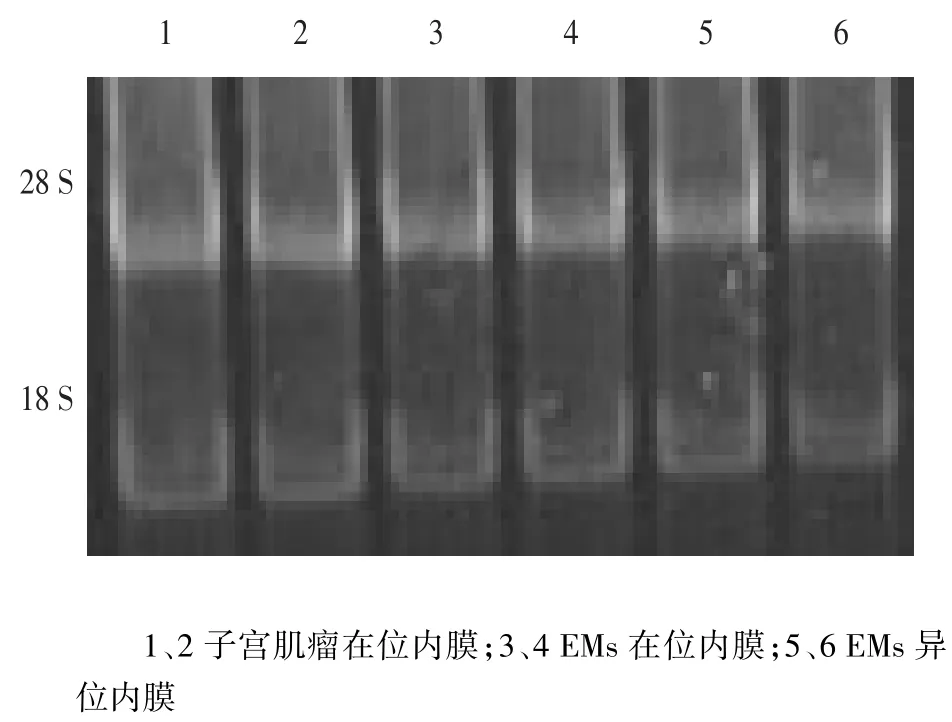
Fig.2 Agarose gel electrophoresis to identify RNA integrity图2 RNA完整性琼脂糖凝胶电泳图
2.2.2 半定量RT-PCR结果 (1)增殖期、分泌期在位子宫内膜间质细胞半定量RT-PCR电泳灰度值比较。子宫肌瘤及EMs患者分泌期子宫内膜间质细胞COX-2、PGE2、Snail、E-cadherin mRNA表达与增殖期间质细胞比较差异无统计学意义(P>0.05),见图3、4,表2。(2)EMs在位及异位子宫内膜间质细胞半定量RT-PCR电泳灰度值比较。各组患者异位子宫内膜间质细胞COX-2、PGE2、Snail、E-cadherin mRNA表达差异均有统计学意义,其中COX-2、PGE2、Snail在EMs患者异位子宫内膜间质细胞表达最高,EMs在位间质细胞表达次之,子宫肌瘤患者在位间质细胞表达最低;而E-cadherin表达情况相反,见图5、表3。

Fig.3 Amplification products of target gene from eutopic endometrial stromal cells of patients with uterine fibroids图3 子宫肌瘤患者在位子宫内膜间质细胞目的基因扩增产物
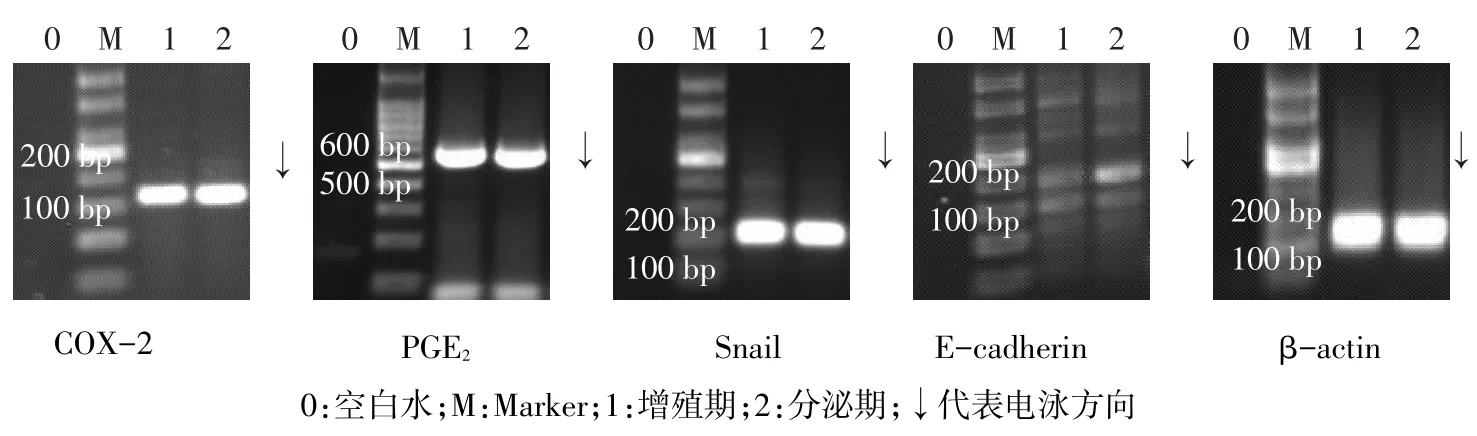
Fig.4 Amplification of target gene in eutopic endometrial stromal cells from patients with EMS图4 EMs患者在位子宫内膜间质细胞目的基因扩增产物
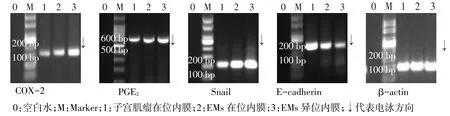
Fig.5 Amplification of target gene in eutopic and ectopic endometrial stromal cells图5 子宫肌瘤位内膜、EMs在位及异位子宫内膜间质细胞目的基因扩增产物
Tab.2 Comparison of transcription levels of COX-2,PGE2,Snail and E-cadherin between proliferative stage and secretory stage of eutopic endometrial stromal cells表2 增殖期、分泌期在位子宫内膜间质细胞COX-2、PGE2、Snail、E-cadherin mRNA表达量比较(±s)
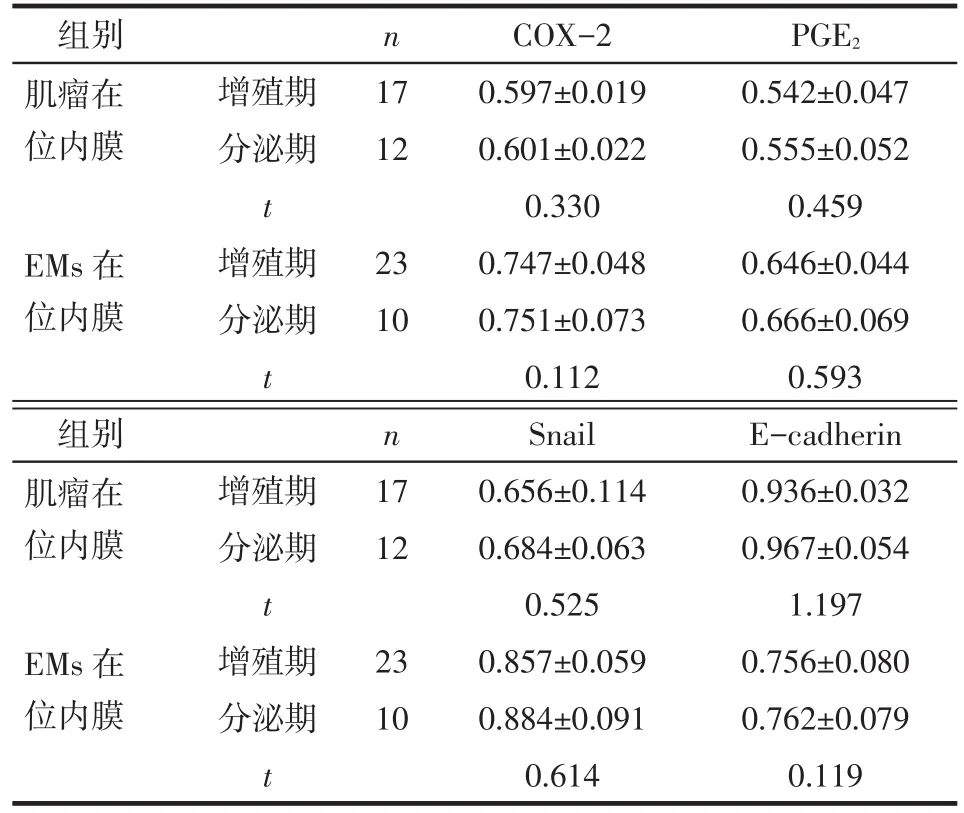
Tab.2 Comparison of transcription levels of COX-2,PGE2,Snail and E-cadherin between proliferative stage and secretory stage of eutopic endometrial stromal cells表2 增殖期、分泌期在位子宫内膜间质细胞COX-2、PGE2、Snail、E-cadherin mRNA表达量比较(±s)
均P>0.05
组别肌瘤在位内膜n 17 12 EMs在位内膜增殖期分泌期t增殖期分泌期t 23 10 COX-2 0.597±0.019 0.601±0.022 0.330 0.747±0.048 0.751±0.073 0.112 PGE20.542±0.047 0.555±0.052 0.459 0.646±0.044 0.666±0.069 0.593组别肌瘤在位内膜n 17 12 EMs在位内膜增殖期分泌期t增殖期分泌期t 23 10 Snail 0.656±0.114 0.684±0.063 0.525 0.857±0.059 0.884±0.091 0.614 E-cadherin 0.936±0.032 0.967±0.054 1.197 0.756±0.080 0.762±0.079 0.119
Tab.3 Comparison of transcription levels of COX-2, PGE2,Snail and E-cadherin in endometrial stromal cells between each group表3 各组子宫内膜间质细胞COX-2、PGE2、Snail、E-cadherin mRNA表达量比较 (±s)
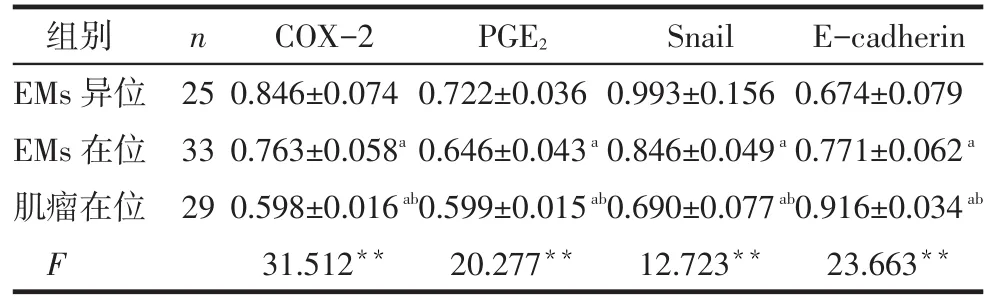
Tab.3 Comparison of transcription levels of COX-2, PGE2,Snail and E-cadherin in endometrial stromal cells between each group表3 各组子宫内膜间质细胞COX-2、PGE2、Snail、E-cadherin mRNA表达量比较 (±s)
**P<0.01,a与EMs异位组比较,b与EMs在位组比较,P<0.05
组别EMs异位EMs在位肌瘤在位F n 25 33 29 COX-2 0.846±0.074 0.763±0.058a0.598±0.016ab31.512**PGE20.722±0.036 0.646±0.043a0.599±0.015ab20.277**Snail 0.993±0.156 0.846±0.049a0.690±0.077ab12.723**E-cadherin 0.674±0.079 0.771±0.062a0.916±0.034ab23.663**
3 讨论
3.1 子宫内膜间质细胞的选择 细胞的侵袭和转移包括细胞通过细胞外基质的主动运动和蔓延到远处器官。EMs形成过程中经期脱落的子宫内膜细胞通过输卵管后需经过腹水或腹腔液、腹腔细胞和腹腔细胞外基质这三道防线进入腹腔,然后在盆腹腔腹膜、器官等部位种植生长,形成异位病灶[2]。子宫内膜细胞主要包括子宫内膜腺上皮细胞和间质细胞,在EMs形成过程中腺上皮细胞参与异位病灶的生长,间质细胞参与异位病灶的黏附过程[3-4]。子宫内膜间质细胞的黏附作用是EMs形成的第一步[4],之后通过重组腺上皮和间质细胞形成子宫内膜腺体而进一步促进异位病灶的生长[3]。因此,本实验以原代培养的子宫内膜间质细胞为对象,研究EMs中与细胞侵袭、转移相关基因的表达。
3.2 COX-2作用途径与细胞侵袭、转移可能的关系 细胞外基质和细胞间的黏附作用是防止细胞转移的基础,破坏正常细胞间的黏附作用可增强肿瘤细胞的迁移和增殖能力,从而引起细胞的侵袭和转移。COX-2是催化花生四烯酸转化为PGE2的诱导酶,与肠癌[5]、卵巢上皮性癌[6]、胃癌[7]、肺癌[8]等恶性肿瘤的发生、发展有关,具有刺激细胞增殖、抑制凋亡、参与细胞侵袭、远处转移和促进血管生成的作用。Snail作为E-cadherin的抑制因子,在小细胞肺癌[9]、膀胱癌[10]、乳腺癌[11]等多种恶性肿瘤中表达明显升高,其主要功能是调控细胞的转移和生存能力,使肿瘤细胞从原始病灶分离并转移到身体的其他部位,从而促进细胞的侵袭和转移。E-cadherin是细胞间黏附和维持正常组织结构的必需蛋白,其降低与肿瘤的侵袭、转移和不良预后有关。在肺癌中过表达的COX-2诱导产生的PGE2通过促进Snail的表达而抑制E-cadherin的表达,从而使癌细胞的侵袭、转移能力增加[12]。
3.3 EMs子宫内膜间质细胞的侵袭、转移能力 本实验以原代培养的子宫内膜间质细胞为研究对象,可代表患者体内细胞的特征,研究结果显示子宫肌瘤和EMs患者增殖期在位子宫内膜分离培养的间质细胞COX-2、PGE2、Snail和E-cadherin mRNA表达与分泌期培养的间质细胞比较均无显著差异,提示体外培养的子宫内膜间质细胞的侵袭、转移能力不受子宫内膜周期性变化的影响。郎景和教授关于EMs的发病提出了“在位内膜决定论”[2],即患者的在位内膜本身在黏附、种植、侵袭能力上要强于非EMs妇女,更容易形成异位病灶。该实验结果显示EMs患者的子宫内膜间质细胞COX-2、PGE2和Snail mRNA表达比非EMs患者均升高,而E-cadherin mRNA表达降低,提示EMs患者的子宫内膜间质细胞侵袭、转移能力强于非EMs患者。有学者指出EMs患者在位子宫内膜细胞要在盆腔内种植形成异位病灶,还要通过腹水、腹腔内细胞、腹膜外细胞基质这三道防线的筛选作用,最后留下最强的克隆细胞系在腹腔内种植形成异位病灶,因此提出子宫内膜异位病灶是单克隆起源学说[13]。对于EMs患者而言,异位病灶子宫内膜间质细胞COX-2、PGE2和Snail mRNA表达比在位内膜细胞均升高,而E-cadherin mRNA表达降低,提示异位子宫内膜间质细胞的功能有所改变,侵袭、转移能力强于在位子宫内膜间质细胞。
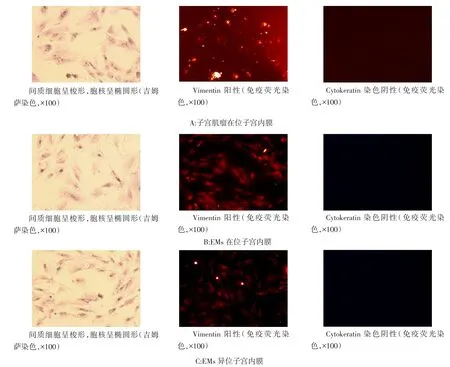
Fig.1 Identification of endometrial cells图1 子宫内膜间质细胞鉴定
[1]Beliard A,Noël A,Goffin F,et al.Role of endocrine status and cell type in adhesion of human endometrial cells to the peritoneum in nude mice[J].Fertil Steril,2002,78(5):973-978.
[2]Chinese Medical Association.The eighth national academic conference proceedings of obstetrics and gynecology[C].Nanjing,2005: 81-82.[中华医学会.第八次全国妇产科学学术会议论文汇编[C].南京,2005:81-82.]
[3]Nisolle M,Casanas-Roux F,Donnez J.Early-stage endometriosis: adhesion andgrowth of human menstrual endometrium in nude mice [J].Fertil Steril,2000,74(2):306-312.
[4]Witz CA,Monotoya-Rodriguez IA,Schenken RS.Whole explants of peritoneum and endometrium:a novel model of the early endometriosis lesion[J].Fertil Steril,1999,71(1):56-60.
[5]Peng Q,Yang S,Lao X,et al.Meta-analysis of the association between COX-2 polymorphisms and risk of colorectal cancer based on case-control studies[J].PLoS One,2014,9(4):e94790.doi: 10.1371/journal.pone.0094790.
[6]Agachan Cakmakoglu B,Attar R,Kahraman OT,et al.Cyclooxygenase-2 gene and epithelial ovarian carcinoma risk[J].Mol Biol Rep,2011,38(5):3481-3486.doi:10.1007/s11033-010-0458-7.
[7]Yan WF,Sun PC,Nie CF,et al.Cyclooxygenase-2 polymorphisms were associated with the risk of gastric cancer:evidence from a meta-analysis based on case-control studies[J].Tumour Biol,2013,34 (6):3323-3330.doi:10.1007/s13277-013-0901-1.
[8]Coskunpinar E,Eraltan IY,Turna A,et al.Cyclooxygenase-2 gene and lung carcinoma risk[J].Med Oncol,2011,28(4):1436-1440. doi:10.1007/s12032-010-9627-8.
[9]Argast GM,Krueger JS,Thomson S,et al.Inducible expression of TGFβ,Snail and ZEBI recapitulates EMT in vitro and in vivo in a NSCLC model[J].Clin Exp Metastasis,2011,28(7):593-614.doi: 10.1007/s10585-011-9394-8.
[10]Shan Y,Zhang L,Bao Y,et al.Epithelial-mesenchymal transition, a novel target of sulforaphane via COX-2/MMP2,9/Snail,ZEB1 and miR-200c/ZEB1 pathways in human bladder cancer cells[J].J NutrBiochem,2013,24(6):1062-1069. doi:10.1016/j.jnutbio.2012.08.004.
[11]Li W,Liu C,Tang Y,et al.Overexpression of Snail accelerates adriamycin induction of multidrug resistance in breast cancer cells[J]. Asian Pac J Cancer Prev,2011,12(10):2575-2580.
[12]Dohadwala M,Yang SC,Luo J,et al.Cyclooxygenase-2-dependent regulation of E-cadherin:Prostaglandin E2 induces transcriptional repressors ZEB1 and Snail in non-small cell lung cancer[J].Cancer Res,2006,66(10):5338-5345.
[13]Varma R,Rollason T,Gupta JK,et al.Endometriosis and the neoplastic process[J].Reproduction,2004,127(3):293-304.
(2014-06-10收稿 2014-08-03修回)
(本文编辑 李鹏)
Invasion and Metastasis Ability of Endometrial Stromal Cells in Endometriosis
SU Xiaohua1,SONG Dianrong2△,ZHANG Wei2,Guo Jie2,WANG Yanan2,ZHAO Lin2
1 Tianjin University of Traditional Chinese Medicine,Tianjin 300073,China;2 The Second Affiliated Hospital,Tianjin University of Traditional Chinese Medicine
△
E-mail:songdr58@126.com
ObjectiveTo analyze the invasion and metastasis of endometrial stromal cells in endometriosis through assessing the transcription levels of COX-2,PGE2,Snail and E-cadherin mRNA.MethodsEctopic and eutopic endometrial tissues from patients with EMs(endometriosis)or uterine fibroids were collected and cultured.The fourth generation of purified endometrial stromal cells were used for research,and the transcription levels of COX-2,PGE2,Snail and E-cadherin mRNA were analyzed by RT-PCR.ResultsThere were no statistical differences in transcription levels of COX-2,PGE2, Snail and E-cadherin mRNA in eutopic endometrial stromal cells from patients with EMs or uterine fibroids between secration stage and proliferation stage(P>0.05).The transcription levels of COX-2,PGE2and Snail mRNA were significantly increased while transcription level of E-cadherin mRNA was decreased in eutopic and ectopic endometrial stromal cells in patients with EM compared with those in patients with uterine fibroid.And the difference was statistically significant(P<0.05 or P<0.01).The transcription levels of COX-2,PGE2and Snail mRNA were obviously higher while transcription level of E-cadherin mRNA was lower in ectopic endometrial stromal cells than those in eutopic endometrial stromal cells from patients with EMs.And the difference was statistically significant(P<0.05 or P<0.01).ConclusionThe invasion and metastasis of endometrial stromal cells of patients with EMs were remarkable than those cell of patients without EMs.What’s more,the invasion and metastasis in ectopic endometrial stromal cells were more obvious than those cells in the pathogenesis of EMs.
endometriosis;COX-2;PGE2;Snail;E-cadherin
R711.7
A
10.3969/j.issn.0253-9896.2014.12.004
国家自然科学基金资助项目(81102613)
1天津中医药大学(邮编300073);2天津中医药大学第二附属医院
△通讯作者 E-mail:songdr58@126.com

