替米沙坦对非酒精性脂肪性肝炎大鼠胰岛素抵抗及氧化应激的影响
刘应莉 张秋瓒 王艳荣 杨 倩 付丽娜 张 静
替米沙坦对非酒精性脂肪性肝炎大鼠胰岛素抵抗及氧化应激的影响
刘应莉 张秋瓒△王艳荣 杨 倩 付丽娜 张 静
目的 探讨替米沙坦对非酒精性脂肪性肝炎(NASH)大鼠血脂及氧化应激及胰岛素抵抗的影响。方法采用随机数字表法将50只雄性SD大鼠随机分为对照组、模型组、多烯磷脂酰胆碱组、替米沙坦低剂量组和替米沙坦高剂量组,每组10只。对照组以普通饲料喂养,模型组和干预组给予高脂饲料喂养诱发NASH,12周后,分别给予生理盐水1.0 mL/(kg·d)、生理盐水1.0 mL/(kg·d)、多烯磷脂胆碱8.4 mg/(kg·d)、替米沙坦4 mg/(kg·d)和替米沙坦8 mg/(kg·d)灌胃4周。所有大鼠在第16周末处死,测肝酶、血脂、氧化应激、胰岛素抵抗指数(HOMA-IR)等及肝组织NAS评分。结果与模型组比较,多烯磷脂酰胆碱组丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)减低,NAS评分改善;替米沙坦低剂量组AST减低,血清总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)、肝组织SOD和GSH-PX提高,血清及肝组织MDA减低,HOMA-IR减低,NAS评分改善;替米沙坦高剂量组ALT减低,余指标变化同替米沙坦低剂量组。结论高剂量的替米沙坦可降低NASH大鼠肝酶、氧化应激、胰岛素抵抗和肝脏脂质沉积,且作用优于多烯磷脂酰胆碱及低剂量替米沙坦。
氧化性应激;大鼠,Sprague-Dawley;替米沙坦;多烯磷脂酰胆碱;非酒精性脂肪性肝炎;胰岛素抵抗
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)是一类配体激活的转录因子,在调节糖脂代谢中具有重要作用,与肥胖、糖尿病、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)等多种疾病的发病相关,PPARs可促进脂质沉积于脂肪组织内,并在脂肪细胞的分化和成熟中起到举足轻重的作用[1]。替米沙坦与PPARs激动剂吡格列酮化学结构相似,是PPARs部分激动药,在脂质代谢中具有一定的作用。现普遍观点认为,NASH发病中的第1次打击为肝脏脂质沉积,进一步引起氧化应激和炎症反应,故通过阻断以上病理过程来治疗NASH具有理论可行性。本研究通过高脂饮食建立大鼠NASH动物模型,并用替米沙坦干预,探讨替米沙坦对NASH大鼠的治疗作用。
1 材料与方法
1.1 实验动物 雄性SPF级SD大鼠50只,6周龄,体质量(200±20)g,购自中国医学科学院放射医学研究所,并饲养于SPF级动物实验室。
1.2 主要试剂 替米沙坦(美卡素,勃林格殷格翰公司),多烯磷脂酰胆碱(易善复,赛诺菲安万特制药有限公司)。丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、总抗氧化能力(total anti-oxidation competence, T-AOC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPX)试剂盒购自南京建成生物公司。
1.3 方法 实验动物采用完全随机数字表法分为5组,每组10只。对照组以普通混合饲料喂养,12周后以生理盐水1.0 mL/(kg·d)灌胃4周;模型组、多烯磷脂酰胆碱组、替米沙坦低剂量组及替米沙坦高剂量组采用高脂饲料喂养12周,此后模型组以1.0 mL/(kg·d)生理盐水灌胃,多烯磷脂酰胆碱组以8.4 mg/(kg·d)多烯磷脂酰胆碱灌胃,替米沙坦低剂量组以4 mg/(kg·d)替米沙坦灌胃,高剂量组以8 mg/(kg·d)替米沙坦灌胃,并继续高脂饲料喂养4周。
1.4 肝组织病理 显微镜下观察各组大鼠肝组织病理切片中肝细胞脂肪变程度、小叶内炎症程度及肝细胞气球样变程度,并随机记20个高倍镜下非酒精性脂肪性肝病活动度积分(nonalcoholic fatty liver disease activity score,NAS)[2]。
1.5 标本采集与检测 第12、16周测量大鼠体质量,16周末禁食不禁水12 h,麻醉后处死,心脏采血。全自动生化分析仪检测丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、三酰甘油(TG)和胆固醇(TC)水平。按照试剂盒说明书操作检测血清MDA、SOD、T-AOC、GSH-PX、空腹血糖及胰岛素水平,计算胰岛素抵抗指数(insulin resistance index,HOMA-IR), HOMA-IR=空腹血糖×空腹胰岛素/22.5。取肝脏并观察其表面及切口情况,称肝湿质量计算肝脏指数(肝指数=肝脏湿质量/体质量×100%)。4%中性甲醛固定部分肝脏标本以制作病理切片,-80℃冰箱冻存肝组织以制作肝匀浆,检测MDA、SOD、GSH-PX水平。
1.6 统计学方法 数据采用SPSS 17.0软件分析,以均数±标准差(±s)表示,多组间数据比较采用单因素方差分析,多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 动物一般情况 所有大鼠均存活。12周及16周时,模型组大鼠体质量均显著高于对照组。对照组大鼠肝脏正常,模型组大鼠肝脏体积增大,切面带有油腻感,符合NASH大鼠模型特点。16周时,多烯磷脂酰胆碱及高剂量替米沙坦可显著减缓高脂饮食引起的大鼠体质量增长并降低肝指数(P<0.05),低剂量替米沙坦无显著减缓NASH大鼠体质量增长及降低肝指数作用(P>0.05),见表1。
2.2 肝组织病理学 对照组肝组织结构正常。模型组肝组织的肝小叶结构尚正常,可见重度肝细胞脂肪变性、气球样变及小叶内炎症,符合NASH肝脏病理表现,造模成功。多烯磷脂酰胆碱及低剂量替米沙坦可显著减低NASH大鼠肝组织NAS评分,高剂量替米沙坦可改善肝组织脂肪变和NAS评分,见表2、图1。
Tab.1 The weight of rats in each group表1 各组大鼠体质量 (n=10,±s)

Tab.1 The weight of rats in each group表1 各组大鼠体质量 (n=10,±s)
*P<0.05,**P<0.01;a与对照比较,b与模型组比较,c与多烯磷脂酰胆碱组比较,P<0.05;表2~4同
组别对照组模型组多烯磷脂酰胆碱组替米沙坦低剂量组替米沙坦高剂量组F体质量(g)12周457.21±34.41 528.84±32.85a526.31±46.25a528.10±40.93a530.68±39.05a6.670**16周484.80±33.69 582.65±33.59a538.53±39.46ab570.46±34.72a532.72±40.85ab10.903**肝指数(%)2.98±0.29 4.01±0.15a3.54±0.12ab3.89±0.14a3.75±0.03ab54.157**
Tab.2 The liver issue steatosis and NAS score表2 肝组织脂肪变及NAS评分 (n=10,±s)
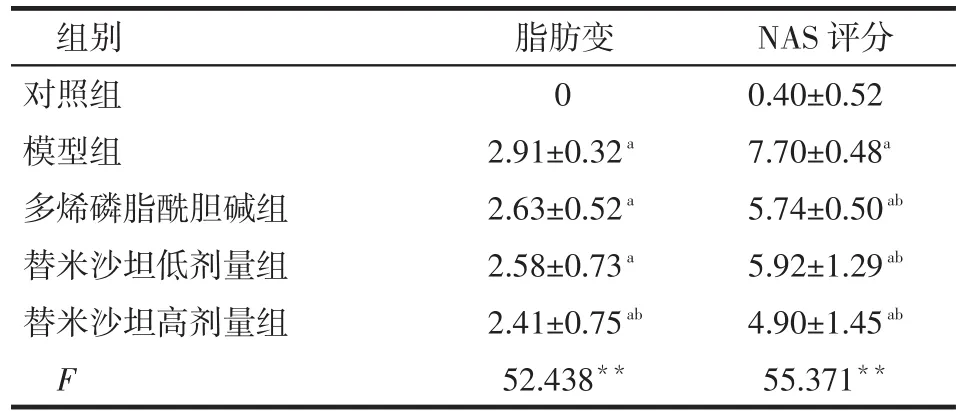
Tab.2 The liver issue steatosis and NAS score表2 肝组织脂肪变及NAS评分 (n=10,±s)
组别对照组模型组多烯磷脂酰胆碱组替米沙坦低剂量组替米沙坦高剂量组F脂肪变0 2.91±0.32a2.63±0.52a2.58±0.73a2.41±0.75ab52.438**NAS评分0.40±0.52 7.70±0.48a5.74±0.50ab5.92±1.29ab4.90±1.45ab55.371**
2.3 生化指标 模型组大鼠血清ALT、AST、TG、TC均高于对照组(P<0.05),符合NASH模型特点。药物干预后,与模型组比,低剂量替米沙坦可显著降低NASH大鼠的AST水平,高剂量替米沙坦可以显著降低NASH大鼠ALT和AST水平。多烯磷脂酰胆碱组的AST较替米沙坦高剂量组和替米沙坦低剂量组更低。3组药物均无降低NASH大鼠TG的作用,见表3。
2.4 HOMA-IR 模型组大鼠HOMA-IR显著高于对照组(P<0.05)。低、高剂量的替米沙坦均可显著改善NASH大鼠HOMA-IR,多烯磷脂胆碱无此作用,见表3。
Tab.3 Biochemical indexs of rats in each group表3 各组大鼠生化指标 (n=10,±s)
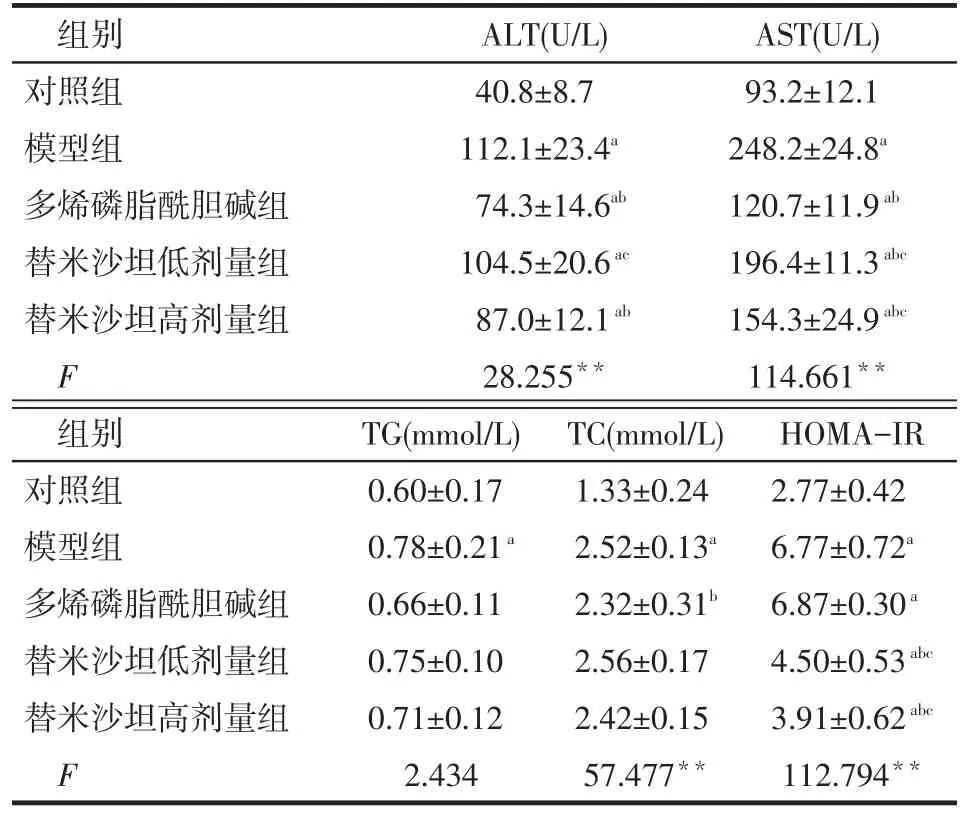
Tab.3 Biochemical indexs of rats in each group表3 各组大鼠生化指标 (n=10,±s)
组别对照组模型组多烯磷脂酰胆碱组替米沙坦低剂量组替米沙坦高剂量组F ALT(U/L) 40.8±8.7 112.1±23.4a74.3±14.6ab104.5±20.6ac87.0±12.1ab28.255**AST(U/L) 93.2±12.1 248.2±24.8a120.7±11.9ab196.4±11.3abc154.3±24.9abc114.661**组别对照组模型组多烯磷脂酰胆碱组替米沙坦低剂量组替米沙坦高剂量组F TG(mmol/L) 0.60±0.17 0.78±0.21a0.66±0.11 0.75±0.10 0.71±0.12 2.434 TC(mmol/L) 1.33±0.24 2.52±0.13a2.32±0.31b2.56±0.17 2.42±0.15 57.477**HOMA-IR 2.77±0.42 6.77±0.72a6.87±0.30a4.50±0.53abc3.91±0.62abc112.794**
2.5 血清和肝组织匀浆氧化应激指标 低、高剂量的替米沙坦均可提高血清T-AOC、SOD、GSH-PX、肝组织SOD和GSH-PX等抗氧化应激指标,减低血清及肝组织氧化应激指标MDA水平,而多烯磷脂酰胆碱只能降低NASH大鼠血清及肝组织MDA水平,提高血清T-AOC、GSH-PX水平,见表4。
3 讨论
高脂血症是NASH发病的首要环节,替米沙坦作为血管紧张素Ⅱ受体拮抗剂(angiotensinⅡreceptor,ARB)类药物,理论上无直接降低血脂合成作用,本研究结果证实替米沙坦无减低NASH大鼠血脂作用。而作为PPARs受体部分激动剂,替米沙坦可以促进脂质沉积于脂肪组织内,减少肝组织脂质沉积[3-4]。本研究显示高剂量替米沙坦可显著改善NASH大鼠肝指数和肝组织脂肪变性,提示替米沙坦可能具有减少肝脏脂质沉积作用。
NASH肝脏摄取过多脂肪酸引起脂肪酸超载,诱发肝脏线粒体功能和超微结构病变,使线粒体内呼吸链复合物的活性下降,引起活性氧积聚,引起机体氧化应激并氧化脂肪,直接破坏线粒体DNA、呼吸链多肽,诱导核因子(NF)-κB的活化及肝脏合成肿瘤坏死因子(TNF)-α,引起脂肪性肝炎、坏死、炎症和纤维化[5]。正常情况下,生物体内清除活性氧的体系包括T-AOC、SOD、CAT、GSH等。T-AOC能分解代谢活性氧,SOD能特异清除超氧阴离子自由基,减少脂质过氧化,过氧化氢酶(CAT)能分解氢氧自由基,GSH-PX可减少羟自由基和单线态氧的产生,保护机体细胞的稳定的内环境。生物膜中的多不饱和脂肪酸在活性氧族的攻击下形成脂质过氧化物产物MDA,进一步激活体内多种免疫反应。研究显示,ARB类药物可减低NASH肝脏活性氧、一氧化氮合酶(NOS)水平,增加GSH等抗氧化剂水平[6-7]。此外,替米沙坦作为唯一一个能在治疗剂量激活PPARs的ARB类药物,可通过激活PPARs,引起脂肪细胞线粒体氧化脂肪的能力增加[8],减少氧化应激产物的生成,提示其抗氧化应激作用优于其他ARB类。本研究亦证实,替米沙坦能显著提高NASH大鼠体内抗氧化物T-AOC、SOD、GSH-PX水平,降低氧化产物MDA,减低氧化应激,且高剂量抗氧化应激作用优于低剂量。多烯磷脂酰胆碱作为细胞膜稳定剂,无全面改善NASH大鼠氧化应激的作用。
Tab.4 Indicators of oxidative stress in rats表4 各组大鼠氧化应激指标 (n=10,±s)
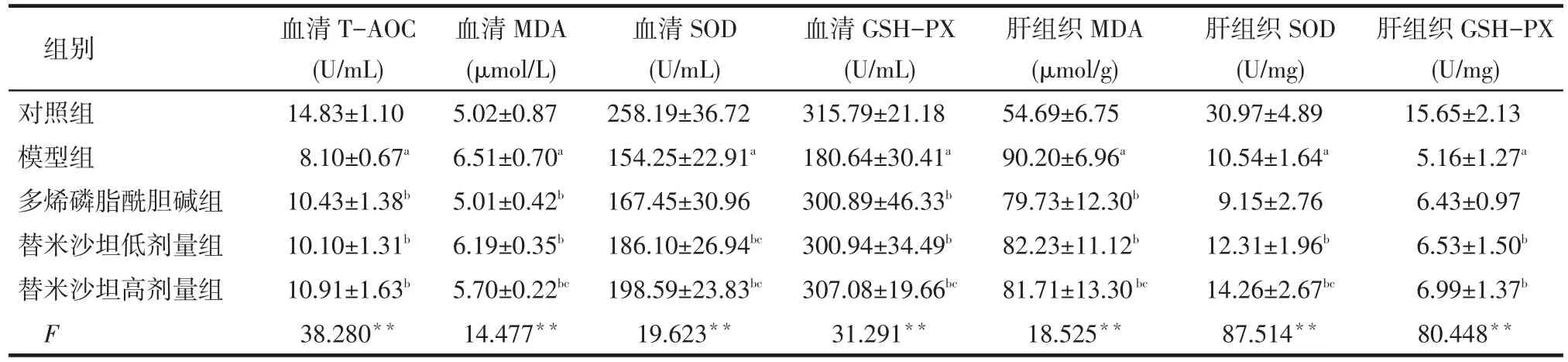
Tab.4 Indicators of oxidative stress in rats表4 各组大鼠氧化应激指标 (n=10,±s)
组别对照组模型组多烯磷脂酰胆碱组替米沙坦低剂量组替米沙坦高剂量组F血清T-AOC (U/mL) 14.83±1.10 8.10±0.67a10.43±1.38b10.10±1.31b10.91±1.63b38.280**血清MDA (μmol/L) 5.02±0.87 6.51±0.70a5.01±0.42b6.19±0.35b5.70±0.22bc14.477**血清SOD (U/mL) 258.19±36.72 154.25±22.91a167.45±30.96 186.10±26.94bc198.59±23.83bc19.623**血清GSH-PX (U/mL) 315.79±21.18 180.64±30.41a300.89±46.33b300.94±34.49b307.08±19.66bc31.291**肝组织MDA (μmol/g) 54.69±6.75 90.20±6.96a79.73±12.30b82.23±11.12b81.71±13.30bc18.525**肝组织SOD (U/mg) 30.97±4.89 10.54±1.64a9.15±2.76 12.31±1.96b14.26±2.67bc87.514**肝组织GSH-PX (U/mg) 15.65±2.13 5.16±1.27a6.43±0.97 6.53±1.50b6.99±1.37b80.448**
胰岛素抵抗被认为是NASH发生的最基本病理生理改变。高脂血症和氧化应激通过促进TNF-α的释放,抑制胰岛素信号通路[9],引起胰岛素抵抗,增加糖尿病发生的风险[10]。胰岛素抵抗可引起外周脂肪动员作用增加,血清游离脂肪酸(FFA)水平进一步增高,肝脏摄取增多,同时肝内脂肪酸的氧化利用减少,酯化作用增强,TG增多,肝细胞内脂肪堆积形成脂肪肝[11]。临床试验证实,替米沙坦可改善代谢综合征患者的胰岛素抵抗[12],与本研究结论一致。Georgescu等[13]在一项长达20个月的临床研究中证实替米沙坦降低NASH患者胰岛素抵抗作用强于其他ARB药物,故推测替米沙坦还可能通过激活PPARs发挥改善胰岛素抵抗作用。
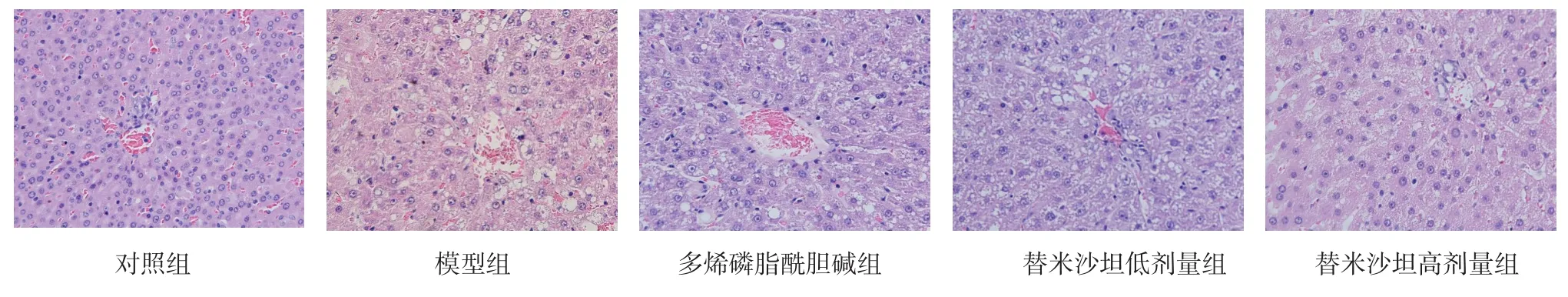
Fig.1 Liver tissues of rats(HE,×400)图1 各组大鼠肝组织(HE,×400)
[1]Monsalve FA,Pyarasani RD,Delgado-Lopez F,et al.Peroxisome proliferator-activated receptor targets for the treatment of metabolic diseases[J].Mediators Inflamm,2013,2013:549-627.doi:10.1155/ 2013/549627.
[2]Chalasani N,Younossi Z,Lavine JE,et al.The diagnosis and management of non-alcoholic fatty liver disease:practice Guideline by the American Association for the Study of Liver Diseases,American College of Gastroenterology,and the American Gastroenterological Association[J].Hepatology,2012,55(6):2005-2023.doi:10.1002/ hep.25762.
[3]Kuwashiro S,Terai S,Oishi T,et al.Telmisartan improves nonalcoholic steatohepatitis in medaka(Oryzias latipes)by reducing macrophage infiltration and fat accumulation[J].Cell Tissue Res,2011, 344(1):125-134.doi:10.1007/s00441-011-1132-7.
[4]Hirata T,Tomita K,Kawai T,et al.Effect of telmisartan or losartan for treatment of nonalcoholic fatty liver disease:fatty liver protection trial by telmisartan or losartan study(FANTASY)[J].Int J Endocrinol,2013,2013:587140.doi:10.1155/2013/587140.
[5]Cusi K.Role of obesity and lipotoxicity in the development of nonalcoholic steatohepatitis:pathophysiology and clinical implications[J]. Gastroenterology,2012,142(4):711-725.doi:10.1053/j.gastro.2012.02.003.
[6]Wei Y,Clark SE,Morris EM,et al.Angiotensin II-induced nonalcoholic fatty 1iver disease is mediated by oxidative stress in transgenic TG(mRen2)27(Ren2)rats[J].J Hepatol,2008,49:417-428. doi:10.1016/j.jhep.2008.03.018.
[7]Hirose A,Ono M,Saibara T,et al.AngiotensinⅡtype 1 receptor blocker inhibits fibrosis in rat nonalcoholic steatohepatitis[J].Hepatology,2007,45:1375-1381.doi:10.1002/hep.21638.
[8]Yin SN,Liu M,Jing DQ,et al.Telmisartan increases lipoprotein lipase expression via peroxisome proliferator-activated receptor-alpha in HepG2 cells[J].Endocr Res,2014,39(2):66-72.doi: 10.3109/07435800.2013.828741.
[9]Zhang X,Xu A,Chung SK,et al.Selective inactivation of c-Jun NH2-terminal kinase in adipose tissue protects against dietinduced obesity and improves insulin sensitivity in both liver and skeletal muscle in mice[J].Diabetes,2011,60:486-495.doi:10.2337/ db10-0650.
[10]雷永富,李敏.299例非酒精性脂肪肝病患者糖尿病发病情况5年随访[J].天津医药,2013,41(2):166-168.doi:10.3969/j. issn.0253-9896.2013.02.021.
[11]常彬霞,霍丹丹,孙颖,等.206例非酒精性脂肪性肝炎患者的临床特点分析[J].解放军医学杂志,2013,38(9):743-746.
[12]De Ciuceis C,Flati V,Rossini C,et al.Effect of antihypertensive treatments on insulin signalling in lympho-monocytes of essential hypertensive patients:A pilot study[J].Blood Press,2014 May 1. [Epub ahead of print]
[13]Georgescu EF,Ionescu R,Niculescu M,et al.Angiotensin-receptor blockers as therapy for mild-to-moderate hypertension-associated non-alcoholic steatohepatitis[J].World J Gastroenterol,2009,15: 942-954.doi:10.3748/wjg.15.942.
(2014-04-28收稿 2014-07-21修回)
(本文编辑 魏杰)
Effects of Telmisartan on Insulin Resistance and Oxidative Stress in Nonalcoholic Steatohepatitis Rats
LIU Yingli,ZHANG Qiuzan△,WANG Yanrong,YANG Qian,FU Lina,ZHANG Jing
Department of Gastroenterology,Tianjin Fourth Central Hospital,Tianjin 300140,China
△
E-mail:qiuzan_zh@sina.com
ObjectiveTo investigate the effects of telmisartan on insulin resistance and oxidative stress in nonalcoholic steatohepatitis(NASH)rats.MethodsFifty male SD rats were randomly divided into five groups:control group,model group,polyene phosphatidylcholine group,low-dose telmisartan group and high-dose telmisartan group by using random number table(n=10 in each group).Control group was given standard food,the other groups were given high fat diet for 12weeks to establish NASH rat model.Then intervention groups were given either normal saline 1.0 mL/(kg·d)or polyene phosphatidylcholine 8.4 mg/(kg·d),or telmisartan 4 mg/(kg·d)or telmisartan 8 mg/(kg·d)for 4 weeks by intragastric adminstration.All rats were sacrificed at the end of the 16th week,the lever of plasma insulin resistance index(HOMA-IR),ALT, AST,TG,TC,MDA,SOD,T-AOC,CAT,GSH-PX and liver homogenate MDA,SOD,GSH-PX and liver NAS scores were tested.ResultsIn polyene phosphatidylcholine treated group,the lever of plasma ALT,AST,HOMA-IR and liver NAS scores were degreased significantly compared with model group.The lever of plasma AST,SOD,T-AOC,CAT,GSH-PX and liver homogenate SOD,GSH-PX,liver NAS scores were improved in both low-dose and high-dose telmisartan groups compared with model group while plasma and liver homogenate MDA,HOMA-IR were reduced significantly in these two groups compared with model group.Besides,plasma ALT was significantly improved in high-dose telmisartan group compared with model group.ConclusionTelmisartan reduce plasma ALT,AST,oxidative stress,HOMA-IR and liver NAS scores in NASH rats.And high-does telmisartan is better than low-dose telmisartan and polyene phosphatidylcholine in treatment effect.
oxidative stress;rats,Sprague-Dawley;telmisartan;polyene phosphatidylcholine;nonalcoholic steatohepatitis;insulin resistance
R575.5
A
10.3969/j.issn.0253-9896.2014.12.011
天津市卫生局科技基金资助项目(2012KR04)
天津市第四中心医院消化科(邮编300140)
△通讯作者 E-mail:qiuzan_zh@sina.com

