Hedgehog信号通路在肾透明细胞癌中的表达及作用
李晓明杨春雨关有良
Hedgehog信号通路在肾透明细胞癌中的表达及作用
李晓明1杨春雨2关有良3
目的 研究人肾透明细胞癌(RCCC)中Hedgehog信号通路相关因子Shh、Ptch、Smo和Gli1蛋白的表达,探讨Hedgehog信号转导通路的异常激活与RCCC的关系。方法应用免疫组织化学方法检测76例RCCC标本及12例癌旁正常肾组织,应用蛋白免疫印迹技术检测10例新鲜癌组织及癌旁正常肾组织中Shh、Ptch、Smo和Gli1蛋白的表达。结果Shh、Ptch、Smo和Gli1蛋白在RCCC中的异常表达率(分别为52.6%、63.2%、44.7%、60.5%)高于正常肾组织(分别为8.3%、16.7%、8.3%、25.0%)。且其表达与患者的年龄、性别和肿瘤大小无显著相关,而与肿瘤临床分期有关,随肿瘤的恶性程度加重,表达率增加。结论Hedgehog信号转导通路在RCCC中呈现高度激活状态,此通路的激活可能与RCCC的发生、发展密切相关,有望成为治疗RCCC的靶点。
肾透明细胞癌;Hedgehog信号通路;免疫组织化学;印迹法,蛋白质
肾细胞癌(renal cell carcinoma,RCC)是起源于肾实质泌尿小管上皮的恶性肿瘤。肾透明细胞癌(renal clear cell carcinoma,RCCC)是最常见的成人肾肿瘤,约占RCC的80%。Hedgehog(Hh)信号传导通路是一个高度保守的调控胚胎发育的信号通路,对胚胎发育及细胞的生长和分化都有重要调控作用[1]。此信号通路的功能异常会导致各种先天性畸形和肿瘤[2]。有学者认为Hh信号通路的分子蛋白可以作为特异性治疗癌症的靶点[3]。Hh信号通路正逐渐成为信号转导领域新的研究热点,但目前国内外关于Hh信号转导通路与RCCC发生关系的研究相对较少。本研究通过免疫组化及蛋白免疫印迹技术检测Hh信号通路相关因子Shh、Ptch、Smo和Gli1蛋白的表达,旨在探讨Hh信号转导通路的异常激活与RCCC之间的关系及临床意义。
1 材料与方法
1.1 材料 收集辽宁医学院附属第一医院2005年1月—2013年12月手术治疗、资料完整的肾透明细胞癌石蜡组织标本76例及12例癌旁正常肾组织标本。术前所有患者均未经放疗和化疗。其中男46例,女30例;年龄45~76岁,平均(60.24±4.31)岁。肿瘤分期依据美国癌症联合会(2002AJCC)的分期标准,Ⅰ期38例,Ⅱ期22例,Ⅲ期~Ⅳ期16例。10例新鲜肾透明细胞癌及癌旁组织来自同一医院2011年1月—2013年12月手术切除标本。
1.2 实验试剂 Shh兔多克隆抗体,Ptch羊多克隆抗体,Smo兔多克隆抗体和Gli1兔多克隆抗体购自美国Santa Cruz公司,β-actin鼠单克隆抗体购自北京中杉金桥生物制品有限公司,SABC试剂盒购自武汉博士德生物制品有限公司。
1.3 方法
1.3.1 免疫组化染色 石蜡切片厚5 μm,脱蜡水化,3%H2O2孵育,微波修复,于BSA室温孵育,分别滴加兔多克隆抗体Shh(1∶50)、羊多克隆抗体Ptch(1∶50)、兔多克隆抗体Smo (1∶50)和兔多克隆抗体Gli1(1∶50)湿盒中4℃过夜。二抗37℃温箱20 min,SABC 37℃温箱30 min,DAB显色,苏木素复染细胞核。
1.3.2 Western Blotting测定 在10例新鲜肾透明细胞癌及癌旁组织中加入裂解液,剪碎、离心,考马斯亮蓝法蛋白质定量,上样,电泳,转膜,封闭,分别滴加一抗Shh(1∶300),Ptch (1∶300)、Smo(1∶300)、Gli1(1∶300)和β-actin(1∶400)4℃过夜,与二抗室温下孵育1 h,ECL显色。应用FluorchemⅤ2.0系统进行吸光度测定。
1.3.3 结果判定 以阳性细胞数百分比结合染色强度计分做定性分析[4]。任意选取10个高倍视野,计数200个细胞。(1)计数阳性细胞百分比。0级:0~5%;1级:>5%~25%;2级:>25%~50%;3级:>50%。(2)根据阳性细胞的染色强度。0级:阴性;1级:浅黄色;2级:棕色;3级:深棕色。两项评分结果相加。0分、1~2分、3~4分和5~6分分别对应阴性、+(低表达)、++(中度表达)和+++(强表达)。本研究将++/+++判定为异常表达。
2 结果
2.1 免疫组化染色结果 Shh、Ptch和Smo蛋白主要表达在细胞的胞质或胞膜,Gli1蛋白主要表达在胞核。Shh、Ptch、Smo和Gli1蛋白在RCCC组织中的异常表达率高于癌旁正常肾组织(P<0.05),见图1、表1。
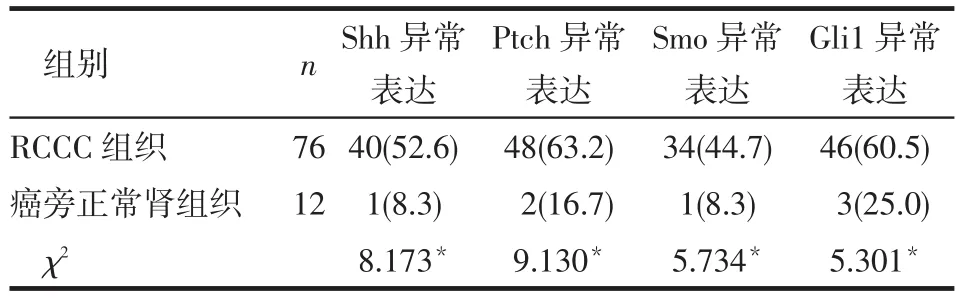
Tab.1 Expression of Hedgehog signaling pathway in RCCC and normal kidney tissues表1 Hedgehog信号通路相关因子在肾透明细胞癌及正常肾组织中的表达 例(%)
2.2 Hedgehog信号通路相关因子的表达与临床病理特征的关系 不同年龄、性别、肿瘤大小RCCC患者的Shh、Ptch、Smo和Gli1蛋白异常表达率差异无统计学意义,Ⅲ~Ⅳ期患者的Shh、Ptch、Smo、Gli1蛋白异常表达率高于Ⅰ~Ⅱ期者(P<0.05),见表2。
2.3 Western Blotting结果 Shh、Ptch、Smo和Gli1在肾透明细胞癌中的表达均明显高于正常肾组织(P<0.05),见图2。
3 讨论
Hh信号通路是人类胚胎发育过程中调控细胞增殖和分化的重要信号通路。研究显示,Hh基因过度表达或者靶基因突变,可通过诱导细胞增殖、阻断细胞凋亡等参与肿瘤的发生和发展[5]。此外,Hh信号通路在肿瘤干细胞自我更新、细胞持续分化以及肿瘤侵袭转移等方面同样发挥重要作用。
Hh信号通路主要包括配体Shh、跨膜蛋白受体Ptch和Smo组成的受体复合物以及下游转录因子Gli。Hh信号通路的效应串联始于靶细胞中配体Shh与Ptch的结合。在机体处于正常状态时,Ptch可以抑制Smo的活性。反之,当Shh配体过度表达,与Ptch结合,就可以使Ptch快速分解,解除其对Smo的抑制,释放Smo进入细胞内。活化的Smo促使在细胞质微管上附着的Hh复合物(HSC)发生超磷酸化,Gli与HSC脱离,进入细胞核,导致其下游核转录因子Gli1激活,从而进一步激活下游靶基因的转录[6]。Gli蛋白家族是Hh信号转导通路下游末端的重要转录因子,其表达水平的高低是Hh通路激活程度的标志[7]。
国内外文献报道,经典的Hh信号传导通路与肿瘤有关,如在胰腺癌、小细胞肺癌、前列腺癌、肝癌、基底细胞癌、髓母细胞瘤和神经胶质瘤等多种肿瘤中均有异常表达[8]。本研究结果显示,RCCC组织中的Shh、Ptch、Smo及Gli 1蛋白异常表达率分别为52.6%、63.2%、44.7%及60.5%,明显高于正常肾组织,提示在RCCC中确实存在Hh信号通路的异常激活,推测Hh信号通路参与了RCCC的发生和发展。此外,结果表明Shh、Ptch、Smo和Gli1蛋白的表达与患者的年龄,性别和肿瘤大小无关,与肿瘤临床分期有关,随肿瘤的恶性程度加重,其表达率增加,提示Hh信号通路相关因子可能会作为一种诊断RCCC的生物学标志物。Hh信号通路与许多调控细胞增殖分化的其他信号通路如Notch、Wnt、Ras/ ERK等都有交叉作用。因此当Hh传导通路被激活,可能与多基因、多信号系统、多因素共同作用,参与了肾细胞癌的发生和发展。

Fig.1 Expression of Hedgehog signaling pathway in RCCC(×400)图1 Hedgehog信号通路相关因子在肾透明细胞癌中的表达(×400)
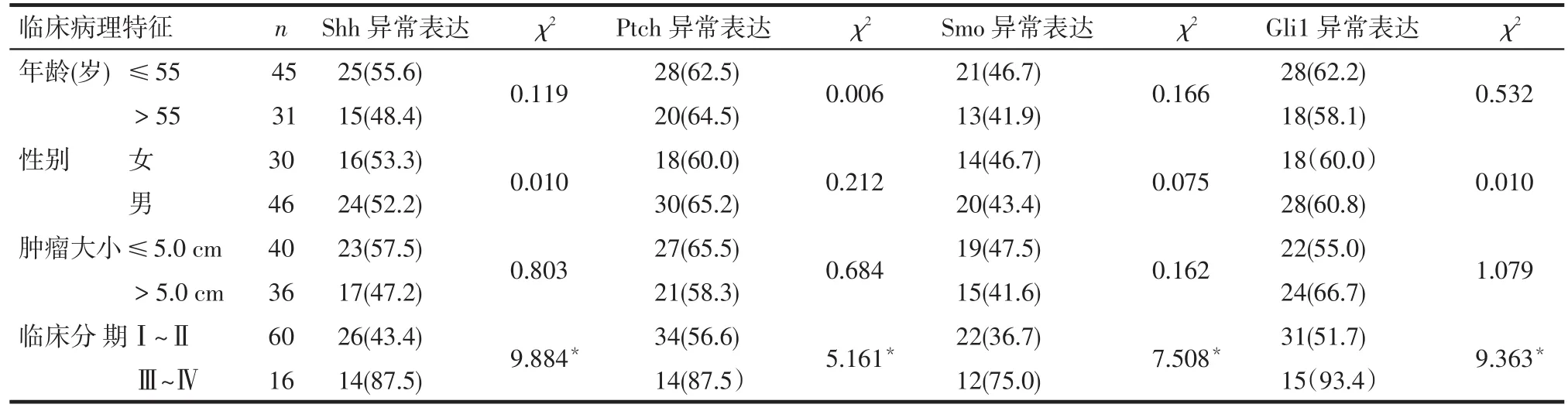
Tab.2 Expression of Hedgehog signaling pathway in RCCC and their relationship with clinicaopathologic factors表2 Hedgehog信号通路在肾透明细胞癌中的表达与临床病理特征的关系 例(%)
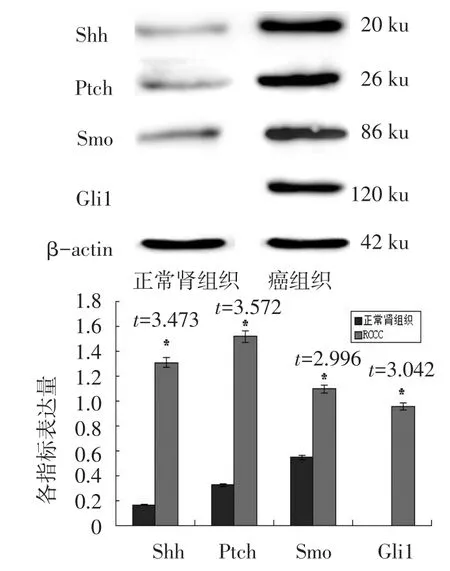
Fig.2 Western blotting analysis of Shh,Ptch,Smo and Gli1 in RCCC图2 Shh、Ptch、Smo和Gli1在肾透明细胞癌中的Western Blotting分析
[1]Barakat MT,Humke EW,Scott MP.Learning from Jekyll to control Hyde:Hedgehog signaling in development and cancer[J].Trends Mol Med,2010,16(8):337-348.doi:10.1016/j.molmed.2010.05.003.
[2]Marini KD,Payne BJ,Watkins DN,et al.Mechanisms of Hedgehog signalling in cancer[J].Growth Factors,2011,29(6):221-234.doi: 10.3109/08977194.2011.610756.
[3]An SM,Ding QP,Li LS.Stem cell signaling as a target for novel drug discovery:recent progress in the WNT and Hedgehog pathways[J].Acta Pharmacol Sin,2013,34(6):777-783.doi:10.1038/aps.2013.64.
[4]Liao X,Siu MK,Au CW,et al.Aberrant activation of hedgehog signaling pathway in ovarian cancers:effect on prognosis,cell invasion and differentiation[J].Carcinogenesis,2009,30(1):131-140.doi: 10.1093/carcin/bgn230.
[5]Samarzija I,Beard P.Hedgehog pathway regulators influence cervical cancer cell proliferation,survival and migration[J].Biochem Biophys Res Commun,2012,425(1):64-69.doi:10.1016/j.bbrc.2012.07.051. [6]Atwood SX,Chang AL,Oro AE.Hedgehog pathway inhibition and the race against tumor evolution[J].J Cell Biol,2012,199(2):193-197.doi:10.1083/jcb.201207140.
[7]Yu D,Shin HS,Lee YS,et al.Genistein attenuates cancer stem cell characteristics in gastric cancer through the downregulation of Gli1 [J].Oncol Rep,2014,31(2):673-678.doi:10.3892/or.2013.2893.
[8]Szkandera J,Kiesslich T,Haybaeck J,et al.Hedgehog signaling pathway in ovarian cancer[J].Int J Mol Sci,2013,14(1):1179-1196. doi:10.3390/ijms14011179.
(2014-06-02收稿 2014-07-25修回)
(本文编辑 闫娟)
Expression and Role of Hedgehog Signaling Pathway in Renal Clear Cell Carcinoma
LI Xiaoming1,YANG Chunyu2,GUAN Youliang3
1 Department of Histology and Embryology,Liaoning Medical College,Jinzhou 121001,China;2 Department of Pathology of the First Affiliated Hospital;3 Department of Urinary Surgery of the First Affiliated Hospital
ObjectiveTo investigate the expression of Shh,Ptch,Smo and Gli1 proteins who belongs to components of Hedgehog signaling pathway,and to explore the relationship between the abnormal activated of Hedgehog signaling pathway with renal clear cell carcinoma(RCCC).MethodsProtein expressions were examined by immunohistochemistry in 76 cases of human RCCC and 12 pericarcinomatous tissues.And 10 fresh specimens from cancer tissues and pericarcinomatous tissues were used to examine expressions of Shh,Ptch,Smo and Gli1 by Western blotting.ResultsThe expressions of examined proteins were higher in RCCC than that in pericarcinomatous tissue.Shh(52.6%vs 8.3%),Ptch(63.2%vs 16.7%), Smo(44.7%vs 8.3%)and Gli1(60.5%vs 25.0%).The increased proteins levels were disassociated with age,gender,and tumorous size in RCCC.But it was significantly correlated with TNM stage of RCCC.The expressions were gradually increased with higher TNM stage of RCCC or more invasive malignancy.ConclusionHedgehog signaling pathway is highly activated in RCCC.It might be involved in initiation,progression of RCCC,and it might be used as the target for RCCC treatment.
renal clear cell carcinoma;Hedgehog signaling pathway;immunohistochemistry;blotting,Western
R737.11
A
10.3969/j.issn.0253-9896.2014.12.014
辽宁省自然科学基金项目(20120141);辽宁省高等学校优秀人才支持计划(LJQ2013092);辽宁医学院博士启动(Y2011B02)
1辽宁医学院组织胚胎学教研室(邮编121001);2辽宁医学院附属第一医院病理科,3泌尿外科

