血浆sCD36与2型糖尿病非酒精性脂肪肝的关系
杨 玲贾国瑜王 璐李 强张 洁谢春晓邸阜生△
血浆sCD36与2型糖尿病非酒精性脂肪肝的关系
杨 玲1贾国瑜2王 璐2李 强2张 洁2谢春晓1邸阜生2△
目的 研究血浆可溶性CD36(sCD36)与2型糖尿病(T2DM)合并非酒精性脂肪性肝病(NAFLD)的关系。方法检测正常对照组(A组,39例)、T2DM未合并NAFLD组(B组,39例)和T2DM合并NAFLD组(C组,59例)患者的血浆sCD36水平,计算C组的肝脏脂肪含量(LFC)及NAFLD纤维化评分(NFS),测定上述3组糖脂代谢指标、肝功能指标及炎症指标。方差分析法比较上述指标在3组中的差异;相关分析法分析C组患者上述各项指标与sCD36的相关性;多元逐步回归法分析C组sCD36的影响因素。结果血浆sCD36(μg/L)水平在B组(3.87± 1.16)、C组(5.72±1.79)均高于A组(2.57±0.93),且C组高于B组(均P<0.01);相关分析示C组的sCD36水平与体质量指数(BMI)、腰围、内脏脂肪面积、空腹胰岛素(FINS)、胰岛素抵抗指数(HOMA-IR)、游离脂肪酸(FFA)、丙氨酸转氨酶(ALT)、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、LFC、NFS呈正相关(均P<0.05),多元逐步回归分析示FFA、LFC、TNF-α、IL-6是sCD36的影响因素。结论血浆sCD36与脂肪肝严重程度、肝脏损伤以及脂肪性肝纤维化有关,可能成为T2DM合并NAFLD的血浆标志物,CD36可能通过炎症机制参与T2DM合并NAFLD的发生发展。
糖尿病,2型;非酒精性脂肪性肝病;可溶性CD36;炎症;肝损伤;肝纤维化
非酒精性脂肪性肝病(NAFLD)是2型糖尿病(T2DM)的常见伴发症,也是代谢综合征的重要组分,其疾病谱包括单纯脂肪肝、脂肪性肝炎、脂肪性肝纤维化和肝硬化。脂肪酸转运体CD36在人体分布广泛,因配体的多样性而功能各异。而存在于肝细胞和脂肪细胞的CD36在NAFLD的形成过程中具有重要的作用。可溶性 CD36(soluble CD36, sCD36)是近年来发现的一种存在于血浆中的非细胞相连形式的CD36,它与多种组织和细胞的CD36表达水平相平行。本研究对sCD36和T2DM合并NAFLD的关系加以讨论,以探究sCD36在血浆中的作用以及CD36对T2DM合并NAFLD的影响。
1 对象与方法
1.1 研究对象 选择2012年7月—2014年2月我院初诊断的T2DM患者98例。同时选取健康体检者39例(A组),均为口服葡萄糖耐量试验(OGTT)结果正常且无脂肪肝者。98例T2DM患者中未合并NAFLD者39例(B组),合并NAFLD者59例(C组)。糖尿病诊断均符合1999年WHO糖尿病诊断标准;NAFLD的诊断参照2010年中华医学会非酒精性脂肪性肝病诊疗指南。排除标准:(1)1型糖尿病、妊娠糖尿病及其他特殊类型糖尿病。(2)严重感染或糖尿病急性并发症。(3)慢性心力衰竭及严重肺脑肝肾功能不全者。(4)有神经内分泌肿瘤或其他恶性肿瘤病史。(5)有饮酒史且饮酒折合乙醇量男性每周>140 g,女性每周>70 g。(6)病毒性肝炎、自身免疫性肝炎、酒精性肝病及药物、毒物引起的肝病等。
1.2 方法 测定3组受试者身高、体质量、腰围、臀围,计算体质量指数(BMI)和腰臀比(WHR)。禁食12 h后肘正中静脉取血,葡萄糖氧化酶法测定空腹血浆葡萄糖(FBG),放射免疫法测定空腹胰岛素(FINS),并用稳态模型评估法计算胰岛素抵抗指数(HOMA-IR)=FBG(mmol/L)×FINS(mIU/L)/22.5。采用高压液相色谱法测定糖化血红蛋白(HbA1c),酶化学法测定总胆固醇(TC)、三酰甘油(TG),酶比色法测定游离脂肪酸(FFA),电阻抗法测定内脏脂肪面积,酶速率法测定丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)和γ-谷氨酰转肽酶(γ-GT),散色比浊法测定超敏C反应蛋白(hs-CRP),血浆sCD36、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)采用酶联免疫吸附法(ELISA)测定(试剂盒购自北京康肽生物科技有限公司)。肝脏脂肪含量(liver fat content,LFC)测定:由同一位经验丰富的超声医师在同一台机器(飞利浦公司HD-11型B型超声检测仪)进行肝脏超声检查并存储图像,下载图像利用image J软件进行图像处理后计算肝脏脂肪含量(%)[1]=62.592×标化肝肾回声比值+168.076×标化肝脏回声衰减系数-27.863。非酒精性脂肪性肝病纤维化评分[2](NAFLDFibrosisScore,NFS)=-1.675+0.037×年龄(岁)+0.094× BMI(kg/m2)+1.13×空腹血糖受损/糖尿病(是=1,否=0)+0.99× AST/ALT-0.013×血小板计数(×109/L)-0.66×白蛋白(g/dL)。
1.3 统计学方法 采用SPSS 17.0软件分析数据。计数资料间比较采用卡方检验;计量资料以±s表示,多组间比较采用方差分析及SNK-q检验。变量间关系的判定采用Pearson相关分析及多元逐步回归分析。P<0.05为差异有统计学意义。
2 结果
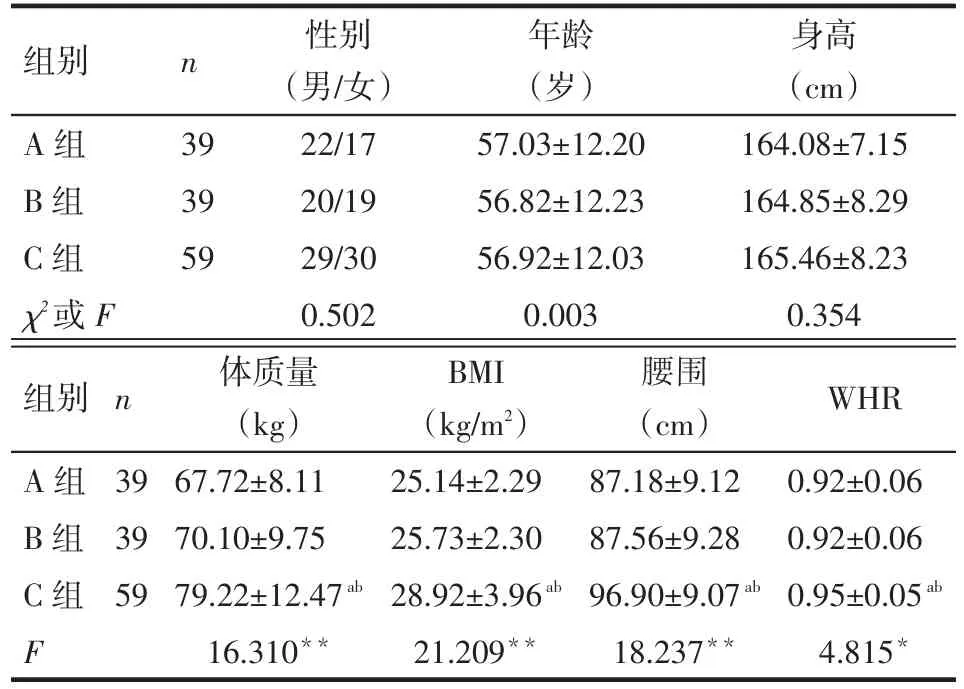
2.1 一般临床资料的比较 3组性别、年龄、身高比较差异均无统计学意义。C组体质量、BMI、腰围、WHR高于A组及B组(均P<0.05),A、B组间差异无统计学意义,见表1。
2.2 糖脂代谢、肝功能、炎症指标以及sCD36水平的比较 B组FBG、FINS、HOMA-IR、HbA1c、TC、FFA、内脏脂肪面积、TNF-α、IL-6、sCD36均高于A组(均P<0.05),其他指标B组与A组比较差异无统计学意义。C组FINS、HOMA-IR、TG、FFA、内脏脂肪面积、ALT、AST、γ-GT、hs-CRP、TNF-α、IL-6、sCD36均高于B组(均P<0.05),C组FBG、HbA1c、TC与B组比较差异无统计学意义,以上所有指标C组均显著高于A组,见表2。
2.3 sCD36与各变量的相关性分析 C组患者平均LFC(%)为36.29±17.92,平均NFS为-0.437±1.253。在C组患者中,血浆sCD36与BMI、腰围、内脏脂肪面积、FINS、HOMA-IR、FFA、ALT、TNF-α、IL-6、LFC、NFS呈正相关(r分别为0.407、0.301、0.577、0.444、0.449、0.653、0.454、0.406、0.439、0.583、0.326,均P<0.05)。
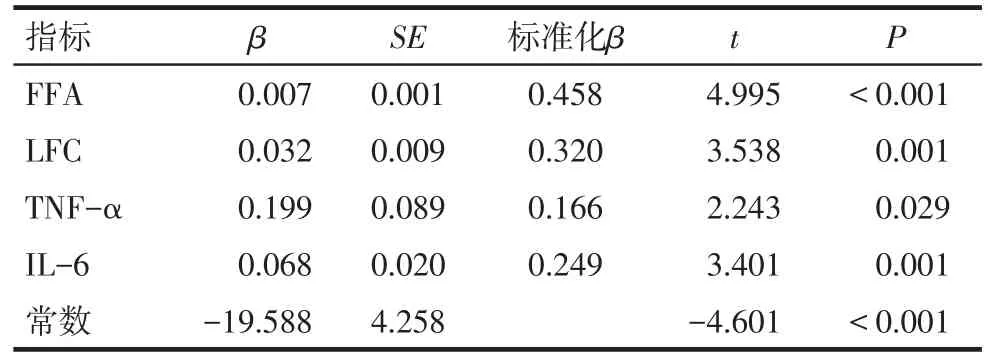
2.4 多元逐步回归分析 以C组患者血浆sCD36水平为因变量,以与sCD36呈正相关的指标为自变量进行分析,结果显示FFA、LFC、TNF-α、IL-6是sCD36的影响因素。见表3。
Tab.1 Comparison of clinical parameters between different groups表1 3组间一般临床资料比较 (±s)
Tab.1 Comparison of clinical parameters between different groups表1 3组间一般临床资料比较 (±s)
*P<0.05,**P<0.01;a与A组比较,b与B组比较,P<0.05;表2同
组别A组B组C组χ2或F n 39 39 59性别(男/女)22/17 20/19 29/30 0.502年龄(岁)57.03±12.20 56.82±12.23 56.92±12.03 0.003身高(cm)164.08±7.15 164.85±8.29 165.46±8.23 0.354组别A组B组C组F n 39 39 59体质量(kg)67.72±8.11 70.10±9.75 79.22±12.47ab16.310**BMI (kg/m2)25.14±2.29 25.73±2.30 28.92±3.96ab21.209**腰围(cm)87.18±9.12 87.56±9.28 96.90±9.07ab18.237**WHR 0.92±0.06 0.92±0.06 0.95±0.05ab4.815*
3 讨论
涉及人体的CD36有2种,一种是“组织内CD36”,即脂肪酸转运体,表达于血小板、巨噬细胞、脂肪细胞及肝脏细胞等,可识别长链脂肪酸、氧化型低密度脂蛋白等配体,发挥吞噬相关的免疫作用,参与脂肪代谢过程。另一种是sCD36,它是存在于人类血浆中的一种非细胞结合形式的CD36,其来源主要是血小板、巨噬细胞或内皮细胞脱落的“微颗粒(microparticles,MPs)”[3],以及全身低度炎症状态和多种原因引起细胞凋亡时,肝脏、脂肪、肌肉等组织释放CD36进入血液循环,形成sCD36[4]。研究发现,动脉粥样硬化患者、多囊卵巢综合征患者、伴有胰岛素抵抗及脂肪肝的非T2DM患者,其血浆中sCD36的水平显著升高[5-6]。
合并NAFLD的T2DM患者与单纯T2DM患者相比,BMI、内脏脂肪面积、FFA、FINS、HOMA-IR更高,说明内脏性肥胖和胰岛素抵抗(IR)与NAFLD的形成有关。T2DM合并NAFLD时,sCD36的水平与LFC呈正相关,说明sCD36有望成为揭示脂肪肝严重程度的血浆标志物。CD36能够通过调控脂肪酸从头合成途径的核因子过氧化物酶体增殖物活化受体γ(PPARγ)和重要酶类如乙酰辅酶A羧化酶等,促进小鼠肝脏从头合成脂肪酸[7]。据此本研究认为,T2DM患者肝脏CD36高表达可促进肝脏的脂肪沉积,肝脏CD36是血浆sCD36的重要来源,血浆sCD36水平的升高即可代表肝脏CD36的升高。García-Monzón等[8]研究发现血浆sCD36的水平与肝脏表达的CD36水平呈正相关,与本研究的推断相吻合。
Tab.3 Multiple stepwise regression analysis of the influencing factors of sCD36 level in patients of T2DM combined with NAFLD表3 T2DM合并NAFLD患者sCD36影响因素的多元逐步分析
Tab.2 Comparison of the glucose and lipid metabolic parameters,the liver function parameters,inflammatory parameters and sCD36 levels between different groups表2 3组间糖脂代谢指标、肝功能指标、炎症指标及sCD36水平比较 (±s)

Tab.2 Comparison of the glucose and lipid metabolic parameters,the liver function parameters,inflammatory parameters and sCD36 levels between different groups表2 3组间糖脂代谢指标、肝功能指标、炎症指标及sCD36水平比较 (±s)
组别A组B组C组F n 39 39 59 FBG (mmol/L)5.10±0.54 8.59±1.50a8.71±1.71a88.947**FINS (mIU/L)5.56±2.71 14.44±12.71a20.09±8.62ab15.900**HOMA-IR 1.26±0.64 5.24±6.98a7.60±3.07ab26.195**HbA1c (%)4.99±0.85 8.20±2.71a8.46±2.23a35.715**TC (mmol/L)3.70±0.92 5.01±1.37a5.29±1.12a23.664**TG (mmol/L)1.21±0.32 1.56±0.92 2.44±1.21ab22.191**FFA (μmol/L)313.41±110.70 515.98±122.15a696.20±120.90ab123.358**内脏脂肪面积(cm2)95.57±6.45 103.34±6.14a115.77±7.60ab106.662**组别A组B组C组F n 39 39 59 ALT (U/L)11.23±3.37 13.90±5.74 37.46±23.04ab43.253**AST (U/L)6.03±2.06 6.41±2.81 18.63±13.51ab31.392**γ-GT (U/L)13.44±3.71 18.72±8.07 34.41±17.53ab38.085**hs-CRP (mg/L)2.59±1.12 3.03±1.96 4.57±2.63ab12.114**TNF-α (ng/L)18.44±4.59 20.34±2.21a22.03±1.49ab18.301**IL-6 (pg/L)133.07±19.64 181.28±25.27a221.71±36.58ab681.671**sCD36 (μg/L)2.57±0.93 3.87±1.16a5.72±1.79ab60.477**
合并NAFLD的T2DM患者与单纯T2DM患者相比,sCD36、ALT、AST、γ-GT都显著升高,且sCD36的水平与ALT呈正相关,表明sCD36与NAFLD患者的肝脏损伤有关。因此sCD36的来源除了上面提到的可由肝脏CD36表达增加引起,也可能由NAFLD患者肝损伤造成CD36释放引起。多元逐步回归分析显示FFA、LFC、TNF-α、IL-6是T2DM合并NAFLD患者sCD36的影响因素,表明sCD36的产生与脂代谢紊乱和炎症有关。NAFLD的形成与IR导致的脂代谢紊乱和炎症、氧化应激等“二次打击”密切相关。sCD36水平受TNF-α、IL-6的影响,因此CD36可能通过炎症机制参与T2DM合并NAFLD的形成。
Angulo等[2]通过肝活检发现733例NAFLD患者中,近 70%患者存在不同程度的肝纤维化,NAFLD患者的肝纤维化进程值得关注。本研究按照NFS公式对T2DM合并NAFLD患者进行了纤维化评分。据相关研究[2],当NFS值低于-1.455时,可排除患者存在进展性肝纤维化(F3、F4期)的可能性,当NFS值高于0.676时,可基本确定其存在进展性肝纤维化。本研究发现sCD36的水平与NFS呈正相关,提示sCD36与NAFLD纤维化有关,但回归分析尚未证实NFS可影响sCD36的水平。肝星状细胞、细胞因子及细胞外基质间的相互作用,参与肝纤维化的发生发展[9]。本研究发现sCD36与炎症因子和肝纤维化密切相关,CD36也可能通过炎症机制参与NAFLD纤维化的形成。其具体作用及机制尚需进一步研究。
综上,T2DM合并NAFLD患者sCD36的水平与脂肪肝严重程度、肝脏损伤以及脂肪性肝纤维化有关。从组织病理学水平探明sCD36与NAFLD的相关性,从分子生物学水平明确CD36参与NAFLD形成的机制,将是今后研究工作的重点。该领域的研究将为阻止及延缓T2DM患者NAFLD的形成带来希望。
[1]Xia MF,Yan HM,He WY,et al.Standardized ultrasound hepatic/renal ratio and hepatic attenuation rate to quantify liver fat content: an improvement method[J].Obesity(Silver Spring),2012,20(2):444-452.
[2]Angulo P,Hui JM,Marchesini G,et al.The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD[J].Hepatology,2007,45(4):846-845.
[3]Alkhatatbeh MJ,Mhaidat NM,Enjeti AK,et al.The putative diabetic plasma marker,soluble CD36,is non-cleaved,non-soluble and entirely associated with microparticles[J].Thromb Haemost,2011,9(4): 844-851.
[4]Handberg A,Norberg M,Stenlund H,et al.Soluble CD36(sCD36) clusters with markers of insulin resistance,and high sCD36 is associated with increased type 2 diabetes risk[J].Clin Endocrinol Metab, 2010,95(4):1939-1946.
[5]Handberg A,Højlund K,Gastaldelli A,et al.Plasma sCD36 is associated with markers of atherosclerosis,insulin resistance and fatty liver in a nondiabetic healthy population[J].Intern Med,2012,271 (3):294-304.
[6]Glintborg D,Højlund K,Andersen M,et al.Soluble CD36 and risk markers of insulin resistance and atherosclerosis are elevated in polycystic ovary syndrome and significantly reduced during pioglitazone treatment[J].Diabetes Care,2008,31(2):328-334.
[7]Glugston RD,Yuen JJ,Hu Y,et al.CD36-deficienct mice are resistant to alcohol-and high-carbohydrate-induced hepatic steatosis [J].Lipid Res,2014,55(2):239-246.
[8]García-Monzón C,Lo Iacono O,Crespo J,et al.Increased soluble CD36 is linked to advanced steatosis in non-alcoholic fatty liver disease[J].Eur J Clin Invest,2014,44(1):65-73.
[9] Su TH,Kao JH,Liu CJ.Molecular mechanism and treatment of viral hepatitis-related liver fibrosis[J].Int J Mol Sci,2014,15(6): 10578-10604.
(2014-07-09收稿 2014-08-14修回)
(本文编辑 李国琪)
Relationship between Plasma sCD36 and Type 2 Diabetes Mellitus Combined with Nonalcoholic Fatty Liver Disease
YANG Ling1,JIA Guoyu2,WANG Lu2,LI Qiang2,ZHANG Jie2,XIE Chunxiao1,DI Fusheng2△
1 The Third Central Clinical Medical College of Tianjin Medical University,Tianjin 300170,China;2 Tianjin Third Central Hospital;Key Laboratory of Regenerative Medicine
△
E-mail:difusheng@vip.163.com
ObjectiveTo investigate the relationship between plasma soluble CD36(sCD36)and nonalcoholic fatty liver disease(NAFLD)in patients combined with type 2 diabetes mellitus(T2DM).MethodsPlasma levels of sCD36 were determined in normal control group(group A,n=39),patients of T2DM without NAFLD group(group B,n=39)and T2DM with NAFLD group(group C,n=59).Liver fat content(LFC)and nonalcoholic fatty liver fibrosis score(NFS)were calculated in group C.Glucose and lipid metabolic parameters,liver function parameters and inflammatory parameters were also detected in all three groups.Variance analysis was applied to analyze the differences of the above parameters among three groups; Correlation analysis was used to analyze the relationship between sCD36 level and all the above parameters;Multiple step-wise regression analysis was applied to determine the influencing factors of sCD36 level in patients of group C.ResultsPlasma sCD36(μg/L)levels in group B(3.87±1.16)and group C(5.72±1.79)are higher than that of group A(2.57±0.93) (both P<0.01),and it is higher in group C than in group B(each P<0.05);Correlation analysis showed that sCD36 level was positively correlated with body mass index(BMI),waist,visceral adipose tissue,fast insulin(FINS),insulin resistance index(HOMA-IR),free fatty acid(FFA),alanine transaminase(ALT),tumor necrosis factor-α(TNF-α),interleukin-6(IL-6), LFC and NFS(P<0.01 or P<0.05);Multiple stepwise regression analysis showed that FFA,LFC,TNF-αand IL-6 were influencing factors of sCD36 level in patients of group C.ConclusionPlasma sCD36 level was related to fatty liver severity, liver injury and fatty liver fibrosis,it might be used as a plasma marker of T2DM combined with NAFLD.CD36 might contribute to the development of T2DM combined with NAFLD through inflammatory mechanisms.
diabetes mellitus,type 2;nonalcoholic fatty liver disease;soluble CD36;inflammation;liver injury;liver fibrosis
R587.1
A
10.3969/j.issn.0253-9896.2014.12.016
天津市卫生局科技基金重点资助项目(2010KR02)
1天津医科大学三中心临床学院(邮编300170);2天津市第三中心医院、天津市人工细胞重点实验室△
E-mail:difusheng@vip.163.com

