姜黄素对人循环纤维细胞增殖及COLⅠ表达影响的研究
富徐燕,赵丕文,李亚东,唐雨晴,牛建昭,王鸿捷,李 彧
(1.北京中医药大学基础医学院,北京 100029;2.北京市红十字血液中心,北京 100088)
随着医学的发展,作为众多致残、致死的主要原因的纤维化疾病越来越受到全世界医学科研者的关注。组织器官的纤维化是一种病理过程,发生于多种器官,在炎症的反复刺激下,器官内纤维结缔组织异常增生,实质细胞减少,持续进展可导致器官结构破坏和功能衰退,最终器官衰竭[1]。细胞外基质的过度沉积是器官纤维化发展的主要原因。过去学者认为组织固有的(肌)成纤维细胞是细胞外基质生成的主要细胞,但自从1994年Bucala等[2]发现了循环纤维细胞后,越来越多的研究证明循环纤维细胞在纤维化疾病的产生和发展过程发挥了重要作用。循环纤维细胞由骨髓分化而来,存在于外周血中,能在趋化因子的作用下随血而至,到达损伤部位特异性分化成为功能活跃的(肌)成纤维细胞,分泌细胞外基质,促进纤维化的形成和发展[3]。姜黄素(curcumin)是从姜科植物姜黄中提取的一种植物多酚,具有降血脂、抗突变、抗癌、抗氧化等生理功能,大量研究表明姜黄素对心、肝、肾、肺等器官的纤维化具有较好的治疗效果[4]。目前,尚未见姜黄素对循环纤维细胞药理作用影响的研究报道。本实验旨在通过体外培养人循环纤维细胞,观察姜黄素对人循环纤维细胞增殖分化的影响,探讨姜黄素抗多器官纤维化的作用靶点。
1 材料
1.1 血液细胞抗凝浓缩白细胞由北京红十字血液中心提供。
1.2 主要试剂Ficoll-Paque PLUS(GE-Healthcare);DMEM培养基、胎牛血清、胰酶(Gibco,AUS);PE Mouse Anti-Human CD34、PE Mouse IgG1 κ Isotype Control、PE-CyTM5 Mouse Anti-Human CD45、PE-CyTM5 Mouse IgG1κIsotype Control、Purified Mouse IgG1κIsotype Control(BD);Anti-Collagen I antibody[5D8](Mouse anti-human)、Rabbit anti-Mouse IgG H&L(FITC)secondary antibody(Abcam);CCK-8(DOJINDO);姜黄素(Sigma)
2 方法
2.1 人循环纤维细胞的分离培养取浓缩白细胞3 ml,用 0.01 mol·L-1无菌磷酸盐缓冲液(PBS)等体积稀释。用注射器抽取淋巴细胞分离液(Ficoll-Paque PLUS)4.5 ml,加入15 ml的离心管中。取血液和PBS的混合液6 ml缓慢加至离心管中,使之分布在淋巴细胞分离的表层,并且上下分层明显,界面清晰,不混溶。将离心管轻轻放入离心机中,400×g离心35 min。离心后,取出离心管,观察分层情况,从上至下分别是:血浆层、白膜层(淋巴细胞)、淋巴细胞分离液层、红细胞层。快速用移液枪轻轻穿过血浆层至白膜层,将白膜层细胞全部吸出,放入已经加入了9 ml PBS的新离心管中,吹打,使之与PBS混匀。100×g离心10 min。离心后,轻轻取出,用移液枪去除上清液,沉淀的细胞中快速加入9 ml PBS,吹打,混匀。100×g离心10 min。去除上清,沉淀中迅速加入1 ml完全培养液,吹打混匀。
将分得的淋巴细胞按0.75×106的密度接种于25 ml培养瓶中,细胞置于37℃、5%CO2的饱和湿度培养箱中培养。培养3 d后去除悬浮细胞,所得贴壁细胞,经培养液冲洗后,补充新培养液继续培养,每3~5 d更换培养液1次。每隔几天进行细胞的观察和摄片。
2.2 人循环纤维细胞的免疫化学鉴定取种植在激光共聚焦专用皿中培养了5 d的循环纤维细胞,PBS洗涤1次,加入含有PE标记的CD34抗体和PE-Cy5标记的CD45抗体,4℃孵育30 min后,细胞清洗2次。用250μl的固定破膜剂重悬细胞,固定破膜20 min,4℃。加入稀释10倍的清洗液清洗细胞两次后,用含10%牛血清白蛋白的PBS 4℃封闭15 min。加COLⅠ一抗,4℃过夜。用稀释10倍的清洗液清洗细胞2次后,加入FITC标记的兔抗鼠IgG二抗,4℃暗室作用30 min。加入稀释10倍的清洗液清洗细胞两次后,加入PBS,采用激光共聚焦显微镜观察摄片。
2.3 人循环纤维细胞的流式鉴定将培养5 d的贴壁细胞经预冷PBS洗涤,用0.5%EDTA的胰酶消化细胞,离心收集,去除上清液。加 PE标记的CD34抗体和PE-Cy5标记的CD45抗体,4℃孵育30 min后,细胞清洗2次。用250μl的固定破膜剂重悬细胞,固定破膜20 min,4℃。加入稀释10倍的清洗液1 ml清洗细胞两次。用含10%牛血清白蛋白的PBS 4℃封闭15 min。离心收集细胞后,加入COLⅠ一抗,4℃过夜。用稀释10倍的清洗液清洗细胞3次,加入FITC标记的兔抗鼠IgG二抗,4℃暗室作用30 min。加入稀释10倍的清洗液清洗细胞2次后,加入PBS混匀,过滤后上机检测。除了实验组外,同时设对照组和补偿组。所用的同型对照有:PEmouse IgG1 isotype control,PE-Cy5 Mouse IgG1 isotype control,Purified Mouse IgG1 isotype control。
2.4 CCK-8测定姜黄素对人循环纤维细胞增殖的影响将培养6 d的细胞以5×104的密度接种于96孔培养板中。孵育72 h后,加入含20%胎牛血清的培养液配制的不同浓度的姜黄素溶液(1、3、10、20μmol·L-1)100μl,分别培育 24、48、72 h。反应结束后,去除旧的培养基,加入新的不含药物的培养基后,每孔加入10μl的CCK-8溶液,设置DMSO对照组、空白对照组,继续孵育3 h。用酶标仪测定在450 nm处的吸光度。
2.5 姜黄素对人循环纤维细胞COLⅠ表达的影响
将培养6 d的贴壁细胞去除培养液,用PBS清洗2遍后,将培养液换成含不同浓度姜黄素(1、3、10、20μmol·L-1)的培养液,孵育72 h后,消化收集细胞。细胞经COLⅠ的免疫染色(方法同“2.2”循环纤维细胞的流式鉴定),用流式细胞仪检测。同时设对照组,所用的同型对照为Purified Mouse IgG1 isotype control。
2.6 数据处理所有实验结果均用±s表示,采用SPSS 17.0统计软件进行数据处理,单因素方差分析。
3 结果
3.1 人循环纤维细胞的培养与观察随着培养时间的延长和持续的换液,可见培养瓶中的循环纤维细胞越来越纯净,杂细胞越来越少。形态学方面,细胞不断伸展扩大,所产生的触角也愈多,表明细胞的贴壁能力越来越强。培养4 d,可见大量的梭形细胞和少量星形细胞,多为群聚在一起。11 d时,细胞的生长趋向稳定,不再大量迁移,细胞已经延展变得扁平,在细胞周围可见大量触角,有众多的梭形细胞。15 d时,细胞更加扁平铺展,梭形细胞减少,开始出现巨噬细胞样细胞。22 d时,细胞继续延展,整个视野的细胞分布趋于纯化,梭形细胞更加减少,巨噬细胞样细胞增多,见Fig 1。

Fig 1 Human circulating fibrocytes after different culturing time by inverted m icroscope(×20)
3.2 人循环纤维细胞的鉴定通过对培养的贴壁细胞进行免疫染色,采用激光共聚焦技术进行观察,可见细胞呈现CD45和COLⅠ强阳性,而CD34表达很弱(Fig 2)。细胞流式技术显示99.9%的贴壁细胞呈COLⅠ阳性,79.7%的细胞为CD45阳性,只有3.3%细胞呈CD34阳性(Fig 3)。

Fig 2 Positive CD45 and COLⅠ coexpression in human blood fibrocytes by confocalm icroscopic system(×60)
3.3 姜黄素对人循环纤维细胞增殖的影响应用CCK-8法进行细胞增殖试验,与正常对照组相比,姜黄素对人循环纤维细胞的增殖作用呈现剂量和时间效应。作用24 h后,不同浓度的姜黄素皆可促进细胞的增殖,其中3μmol·L-1的姜黄素促细胞增殖能力最强(P<0.05)。作用 48 h后,低浓度(1、3 μmol·L-1)的姜黄素依然能促进细胞增殖,而高浓度(10、20μmol·L-1)则发挥了细胞增殖抑制作用。当作用72 h时,不同浓度的姜黄素均可抑制人循环纤维细胞的增殖,而且姜黄素浓度越大,对细胞增殖的抑制能力越强(P<0.01),(Tab 1和Fig 4)
3.4 姜黄素对人循环纤维细胞COLⅠ表达的影响

Fig 3 Positive CD34,CD45 and COLⅠ coexpression in human circulating fibrocytes by flow cytometry

Fig 4 Effect of curcum in on proliferation ofhuman circulating fibrocytes by CCK-8
采用流式细胞术分析了姜黄素对人循环纤维细胞表面抗体COLⅠ的相对表达的影响(Fig 5)。结果显示在DMSO对照组中,COLⅠ阳性的细胞比率为99.8%,当姜黄素浓度为1μmol·L-1时,COLⅠ阳性的细胞率降低至99.3%。随着姜黄素浓度的增加,可表达COLⅠ的细胞数也相应地减少(3μmol·L-1:95.8%;10μmol·L-1:94.7%)。姜黄素浓度达到20μmol·L-1时,阳性细胞降至87.5%。
4 讨论
纤维化是临床上常见的病理生理改变,是在创伤、感染、炎症、血液循环障碍及免疫反应等多种机体内外致病因素作用下,以细胞外基质(ECM)异常沉积为特征的各种疾病的不良结局,是机体对损伤的一种反应[5]。过去认为受损组织本身的成纤维细胞或肌成纤维细胞是ECM产生的主要活化细胞,其活化作用是纤维化疾病发生发展的关键进程。然而,成纤维细胞和肌成纤维细胞的来源却颇受争议,最初的研究认为它们来源于组织固有的纤维细胞,而近年来研究发现它们还可能由上皮细胞经上皮细胞-间充质转化(EMT)转化而来,也可由血液中骨髓来源的前体细胞——循环纤维细胞转化而来[6-7]。
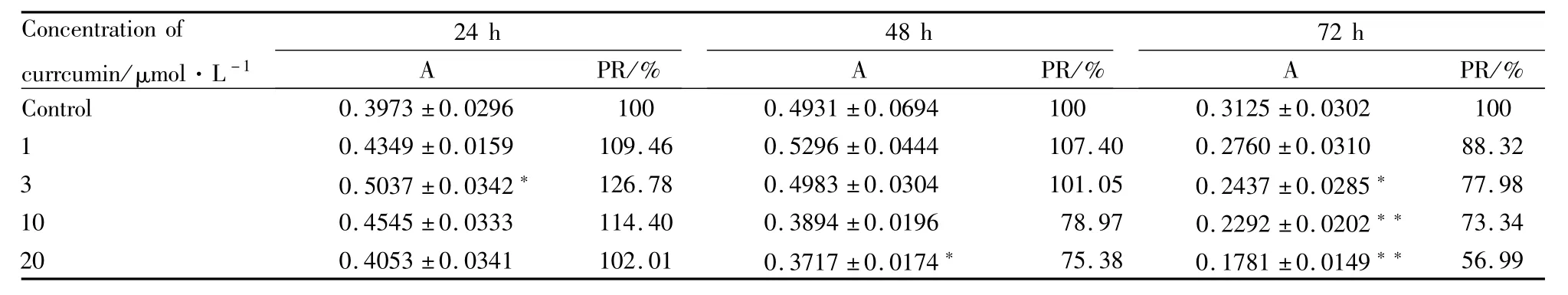
Tab 1 Effect of curcum in on proliferation of human circulating fibrocytes by CCK-8

Fig 5 Effect of curcum in on COLⅠexpression of human circulating fibrocytes by flow cytometry
研究表明循环纤维细胞来源于骨髓,存在于外周血中,是一种过渡性细胞,能在损伤的刺激作用下大量合成,并通过各种不同的细胞因子的介导从外周血中转移进入受损的组织或器官。进入受损部位的循环纤维细胞不仅自身可合成ECM参与纤维化进程,而且也可分化成为(肌)成纤维细胞来发挥生理性和病理性的纤维化作用。现代研究发现循环纤维细胞的表面标记物有20多种[8-9],而目前用于鉴定不同病理损伤部位中的循环纤维细胞的公认标准是同时具有胶原生成和血源来源性标记,即COLⅠ和CD34双阳性或COLⅠ和CD45双阳性[10]。
本实验从人外周血中提取淋巴细胞进行培养,当细胞分化为循环纤维细胞后,再进行姜黄素的各项实验。倒置显微镜观察可见人循环纤维细胞在早期时多为梭形细胞,并伴有少量星形细胞,与文献报道[11]一致。随着时间的推移和细胞的生长分化,细胞持续延展平铺,慢慢发展形成扁圆状的巨噬细胞样细胞,与已有的文献[13]一致。
CD34是高度糖基化的跨膜糖蛋白,能选择性地表达于人类及其他哺乳动物造血干/祖细胞表面,具有运输造血干细胞从骨髓转移进入外周血的作用[12]。而本实验中CD34的少量表达表明循环纤维细胞具有骨髓来源性,与已有的循环纤维细胞表面标志物表达的研究[9-10]一致。本研究发现在人循环纤维细胞培养的的初期,仅有3.3%的细胞呈CD34阳性,与 Liu等[13]实验中的2.99%相接近。CD45为白细胞共同抗原,广泛存在于造血系细胞如T细胞、B细胞、自然杀伤细胞和巨噬细胞表面[6],在淋巴细胞的发育成熟、功能调节及信号传递中具有重要意义。CD45的高表达体现了循环纤维细胞的血系特点,越来越广泛地用于循环纤维细胞的鉴定。COLⅠ蛋白是成纤维细胞的经典标志蛋白,COLⅠ的高表达证明循环纤维细胞具有致纤维化潜能,可以转分化为成纤维细胞。本实验中COLⅠ和CD45双阳性的细胞比率为79.7%,符合目前循环纤维细胞的鉴定标准。目前,国内外对于循环纤维细胞的研究尚未成熟,极少有关于药物对循环纤维细胞作用的研究报告。
姜黄素是从姜科植物姜黄中提取的一种植物多酚,是姜黄发挥药理作用最重要的活性成分[14],具有抗心、肝、肾、肺等器官纤维化的功效,且无毒、副作用小的优势及多靶点、多途径、多环节的作用特点。以往的研究发现姜黄素对受损组织固有的纤维细胞,如肝星形细胞[15-16]、肾小球系膜细胞[17]、肺泡Ⅱ型细胞[18],以及发生 EMT的上皮细胞[19]具有明显的药理作用。本实验探讨了姜黄素对具有骨髓来源的人循环纤维细胞的影响,发现高浓度(20 μmol·L-1)的姜黄素在长时间(72 h)作用下可明显抑制人循环纤维细胞的增殖和COLⅠ的表达。
综上所述,姜黄素可调控循环纤维细胞的增殖,并抑制其向成纤维细胞转化。由此推测循环纤维细胞可能成为姜黄素抗多器官纤维化的作用靶点,其发挥作用途径尚需进一步的研究。
参考文献:
[1]牛建昭,贲长恩.器官纤维化基础及中医药防治[M].北京:人民卫生出版社,2008:1.
[1]Niu JZ,Ben C E N.Organic fibrosisand TCM on prevention and treatment[M].Beijing:People’s Medical Publishing House,2008:1.
[2]Bucala R,Spiegel L,Chesney J,et al.Circulating fibrocytes define a new leukocyte subpopulation thatmediates tissue repair[J].Mol Med,1994,1(1):71-81.
[3]Grieb G,Steffens G,Pallua N,etal.Circulating fibrocytes-biology and mechanisms in wound healing and scar formation[J].Int Rev Cell Mol Biol,2011,291:1-19.
[4]李 彧,杨丽霞,李亚东,等.姜黄素抗纤维化作用研究进展[J].北京中医药大学学报,2008,31(6):408-11.
[4]Li Y,Yang L X,Li Y D,etal.Research progress on anti-fibrosis of curcumin[J]JBeijing Univ TrandionalChin Med,2008,31(6):408-11.
[5]高春芳,陆伦根.纤维化疾病的基础和临床[M].上海:上海科学技术出版社,2004:1.
[5]Gao C F,Lu LG.Basisand clinic of fibrotic diseases[M].Shanghai science and Technology Press,2004:1.
[6]李亚东,牛建昭,王建峰,等.人循环纤维细胞的分离和鉴定[J].解剖学报,2007,38(2):168-72.
[6]Li Y D,Niu JZ,Wang JF,et al.Isolation and identification of circulating fibrocytes from human peripheral blood[J].Acta Anatom Sin,2007,38(2):168-72.
[7]Wada T,Sakai N,Sakai Y,et al.Circulating fibrocytes-biology and mechanisms in wound healing and scar formation[J].Clin Exp Nephrol,2011,15(1):8-13.
[8]Alberto B,Sabrina M.The role of the fibrocyte,a bonemarrowderived mesenchymal progenitor,in reactive and reparative fibroses[J].Labor Investig,2007,87(9):858-70.
[9]Timothy E,Shawn C,Wu SP,etal.Circulating fibrocytes:collagen-secreting cells of the peripheral blood[J].Int J Biochem Cell Biol,2004,36(4):598-606.
[10]Erica L,Richard B.Fibrocytes in health and disease[J].Exp Hematol,2010,38(7):548-56.
[11]Ekert J,Murray L,Das A,et al.Chemokine(C-Cmotif)ligand 2 mediates directand indirect fibrotic responses in human and murine cultured fibrocytes[J].Fibrog Tissue Repair,2011,4(1):23.
[12]Yin T,Li L.The stem cell niches in bone[J].J Clin Investig,2006,116(5):1195-2010.
[13]Liu P,Hu G,Feng J,et al.Influence of circulating fibrocytes on the growth,proliferation and migration of keratinocytes and fibroblasts[J].JAppl Biomed,2012,10:9-17.
[14]余美荣,蒋福升,丁志山.姜黄素的研究进展[J].中草药,2009,40(5):828-31.
[14]Yu M R,Jiang F S,Ding Z S.Advances in studies on curcumin[J].Chin Tradit Herbal Drugs,2009,40(5):828-31.
[15]Vera L,Pérez P,Varela A,etal.Curcumin and liver disease[J].Biofactors,2013,39(1):88-100.
[16]张自力,张 涉,郭 瑶,等.大麻素受体在肝星状细胞活化中的作用及姜黄素干预效应[J].中国药理学通报,2013,29(5):626-31.
[16]Zhang Z L,Zhang S,Guo Y,et al.Research on the role of cannabinoid receptors in hepatic stellate cell activation and interfering effects of curcumin[J].Chin Pharmacol Bull,2013,29(5):626-31.
[17]Gaedeke J,Noble N A,Border W A.Curcumin blocksmultiple sites of the TGF-beta signaling cascade in renal cells[J].Kidney Int,2004,66(1):112-20.
[18]Raktima D,Sunil K,Halder B Z.Roleof TGF-βsignaling in curcumin-mediated inhibition of tumorigenicity of human lung cancer cells[J].JCancer Res Clin Oncol,2013,139(4):563-72.
[19]Rui L,Yunman W,Yujun L,et al.Curcumin inhibits transforming growth factor-β1-induced EMT via PPARγpathway,not Smad pathway in renal tubular epithelial cells[J].PLoS One,2013,8(3):e58848.

