新型抗淋巴瘤药物anti-CD19(Fab)-LDM的靶向分布研究
时玉峥,刘红芹,姜琳琳,杨 铭,范冬梅,屈 浩,石 琳,石 钏,冯春玲,刘 芸,熊冬生,廖晓龙
(1.中国医学科学院北京协和医学院血液病医院血液学研究所,天津 300020;2.协和干细胞基因工程有限公司,天津 300384)
恶性淋巴瘤是起源于淋巴及网状内皮系统的恶性肿瘤,其中非霍奇金式淋巴瘤占绝大部分[1]。CD19分子是除CD20分子之外,B系恶性淋巴瘤的另一个理想治疗靶点,其高表达于从前B至成熟B细胞的整个发育过程,但在淋巴干细胞中尚未见表达[2],因此针对CD19分子抗原的靶向药物有望克服临床B淋巴瘤对利妥昔(rituximab,美罗华)的耐药[3],获得较好的治疗效果。
力达霉素(lidamycin,LDM)是一种大分子肽类抗生素,由辅基蛋白(LDP)和AE组成,其最大特点是对耐药和敏感肿瘤均有很好的杀伤活性,是理想的“弹头”药物[4-5]。发色团(AE)具有细胞毒性,但是结构不稳定;LDP本身无抗肿瘤作用,对AE起稳定和保护作用。AE和LDP可自由拆分和重建。
前期我们利用基因工程方法,将anti-CD19-Fab片段与LDM的辅基蛋白LDP进行重组,形成融合蛋白 anti-CD19(Fab)-LDP[6]。本研究首次采用 Cy5标记anti-CD19-Fab-LDP抗体,体外鉴定其与人淋巴瘤Raji细胞表面CD19分子的结合能力,并利用活体动物体内光学成像系统研究其靶向CD19+恶性B淋巴瘤的能力。
1 材料与方法
1.1 材料
1.1.1 细胞系 人Burkitt’s淋巴瘤细胞系Raji为实验室自有细胞株,培养于含有10%胎牛血清的RPMI 1640培养基中。
1.1.2 主要试剂和耗材 胎牛血清购自PAA公司;RPMI 1640培养基购自Gibco公司;花青素复合物(cyanidin,Cy5)、PD10柱(G25)购自 GE;IgG1-PE和CD19-PE购自美国贝克曼库尔特公司;溶血素购自美国BD公司。
1.2 方法
1.2.1 Cy5标记anti-CD19(Fab)-LDP和LDP 用pH 9.5的碳酸盐缓冲液平衡PD10柱4次,将1 ml浓度大于5 g·L-1的抗体加入到已平衡好的PD10柱上置换缓冲液,接收抗体液并浓缩使其终浓度大于10 g·L-1。按照每mg抗体加入50μg Cy5(浓度为10 g·L-1)溶液的比例进行交联,混匀,室温振摇2 h。将反应液通过经PBS平衡的PD 10柱,收集第一个有颜色的峰,测定交联样品的OD652/OD280在3左右。根据公式计算浓度(g·L-1)=[(A280-A652÷5.23)÷1.5]×稀释倍数。向样品中加入浓度为100 g·L-1的 BSA,使其终浓度为 10g·L-1;加入 100 g·L-1NaN3,使其终浓度为 0.5 g·L-1。
1.2.2 FACS测定 Cy5-anti-CD19(Fab)-LDP结合Raji细胞表面抗原的能力 收集1×106个Raji细胞,PBS洗3次,将细胞重悬于100μl含有20 mg·L-1Cy5直标的抗 CD19(Fab)-LDP,4℃孵育 30 min。400×g,4℃离心10 min,弃上清,冷 PBS洗细胞,重复3次。将细胞重悬于400μl的PBS中,流式细胞仪测定 Cy5-anti-CD19(Fab)-LDP与 Raji细胞表面CD19抗原结合的阳性率。
1.2.3 建立裸鼠移植瘤模型 利用本室保存的CD19+人B淋巴瘤Raji细胞建立移植瘤模型。6只 Balb/c裸鼠(nu/nu),♀,4~5周龄,接种前 1日,以4Gy/只剂量,γ-射线全身照射后,于右前肢根部背侧皮下接种浓度为2×1011·L-1的Raji细胞0.2 m l。每天观察并测量瘤体积。
1.2.4 Raji移植瘤模型的鉴定
1.2.4.1 取肿瘤组织,HE染色进行鉴定 ⓐ取材与固定:取肿瘤组织,投入预先配好的固定液中(体积分数0.1福尔马林)固定,使组织变性凝固,保持细胞原来的形态结构。ⓑ脱水透明:用由低浓度到高浓度酒精作为脱水剂,逐渐脱去组织块中的水分。再将组织块置于既溶于酒精又溶于石蜡的二甲苯中透明,以二甲苯替换出组织块中的酒精。ⓒ浸蜡包埋:将已透明的组织块置于已溶化的石蜡中,放入溶蜡箱保温。待石蜡完全浸入组织块后进行包埋:先制备好容器,倒入已溶化的石蜡,迅速夹取已浸透石蜡的组织块放入其中,冷却凝固成块即可。ⓓ 切片:将包埋好的蜡块固定于切片机上,切成薄片,厚5~8μm。切下的薄片往往皱折,要放到加热的水中烫平,再贴到载玻片上,放45℃恒温箱中烘干。ⓔ脱蜡染色:苏木精是一种碱性染料,可将细胞核和细胞内核糖体染成蓝紫色;伊红是一种酸性染料,能将细胞质染成红色或者淡红色。染色前,须用二甲苯脱去切片中的石蜡,再经由高浓度到低浓度酒精,最后入蒸馏水,就可以染色。将已入蒸馏水后的切片放入苏木精水溶液中染色数分钟;酸水及氨水中分色,各数秒钟;流水冲洗1 h后入蒸馏水片刻;入体积分数0.7和体积分数0.9的酒精中脱水各10 min;入酒精伊红染色液染色2~3 min。ⓕ 脱水透明:染色后的切片经纯酒精脱水,再经二甲苯使切片透明。ⓖ 封固:将已透明的切片用中性树脂封片,盖上盖玻片封固。
1.2.4.2 FACS检测肿瘤细胞表面CD19表达情况
无菌环境下,将肿瘤组织放入盛有无血清的RPMI 1640培养基中,用眼科剪剪碎,直接放入匀浆器中匀浆,用生理盐水研磨成悬液,200目尼龙网过滤,制备单细胞悬液。用PBS清洗2遍后,取圆底流式专用试管,调整细胞浓度,每管含有细胞1×106个。加入10μl CD19-PE抗体,在涡旋器上轻轻振荡一下;4℃避光孵育 30 min;400×g离心 10 min,弃上清,用 PBS清洗2遍,弃上清;加入 400μl PBS,FACS检测。
1.2.5 小动物活体成像观察Cy5直标抗体在荷瘤鼠内的分布 待裸鼠皮下移植瘤体积为400~500 mm3时,随机选择3只尾静脉注射Cy5-anti-CD19(Fab)-LDP(0.8 nmol/只),将裸鼠麻醉,分别于不同时间点用活体动物成像系统观察anti-CD19(Fab)-LDP在荷瘤鼠体内的动态分布情况。其余3只,尾静脉注射 Cy5-LDP(0.8 nmol/只),将裸鼠麻醉,分别于不同时间点用活体动物成像系统观察anti-CD19(Fab)-LDP及 Cy5-LDP在荷瘤鼠体内的动态分布情况,并统计瘤体上荧光值。结果用SPSS 19.0进行独立样本t检验分析。
2 结果
2.1 Cy5-anti-CD19(Fab)-LDP与 Raji细胞的结合活性用流式细胞仪检测Cy5-anti-CD19(Fab)-LDP与Raji细胞的结合活性。结果表明,与未加标记抗体的空白对照相比,Cy5-anti-CD19(Fab)-LDP能与表达CD19靶抗原的人淋巴瘤Raji细胞特异性结合(Fig 1)。
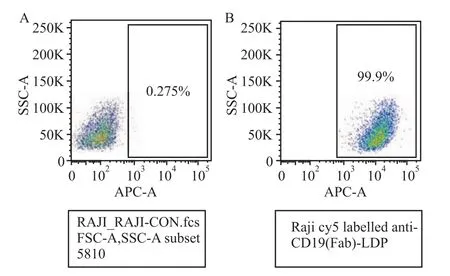
Fig 1 Binding capacity of labeled antibody and target cell by FACs
2.2 Raji移植瘤模型的鉴定待到肿瘤生长至一定体积,取肿瘤部位,进行病理组织学检查。石蜡切片,HE染色结果表明,肿瘤模型建立成功(Fig 2)。显微镜下观察,存在大量的肿瘤细胞。取肿瘤组织,研磨后制备悬液。200目尼龙网过滤后,用CD19-PE抗体检测肿瘤细胞表面CD19分子的表达。结果表明,抗体与细胞表面CD19抗原的结合率在90%以上,说明移植瘤模型建立成功。
2.3 动物活体成像观察 Cy5-anti-CD19(Fab)-LDP在荷瘤鼠内的分布利用活体动物成像系统观察Cy5-anti-CD19(Fab)-LDP在荷瘤裸鼠体内的分布,结果表明,Cy5-anti-CD19(Fab)-LDP抗体尾静脉进入小鼠体内5 min,就能靶向肿瘤部位,肿瘤单位表面积的测得荧光值为(0.24±0.00)scaled counts/s/mm2;在 10 min的时候开始在肿瘤部位聚集。随着时间延长,肿瘤部位荧光信号逐渐增强,在36 h的时候达到最强,单位面积荧光值变为(0.60±0.04)scaled counts/s/mm2。而其余部位未见抗体留存,说明融合蛋白anti-CD19(Fab)-LDP体内可以有效靶向结合CD19+的移植瘤细胞表面CD19抗原,组装上发色团可实现进一步的靶向杀伤作用。而仅注射Cy5-LDP的对照组由于无CD19的靶向作用,在小鼠体内通过代谢,在体内无滞留,逐渐排除,而对照组标记为Cy5-LDP的小鼠,在注射5 min后肿瘤单位面积测得荧光值为(0.16±0.03)scaled counts/s/mm2;36 h后测得该值为(0.02±0.00)scaled counts/s/mm2(Fig 3)。两组进行独立样本t检验,P<0.05,两组间差异存在显著性,结果如Tab 1、Fig 4。
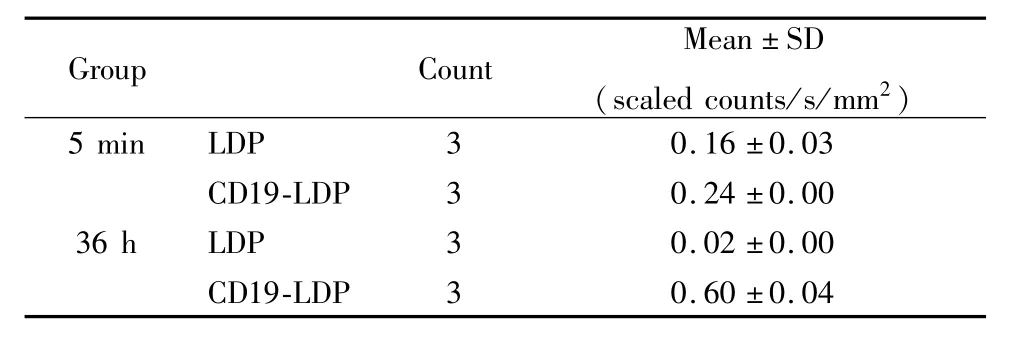
Tab 1 Statistical results of experimental group and control group
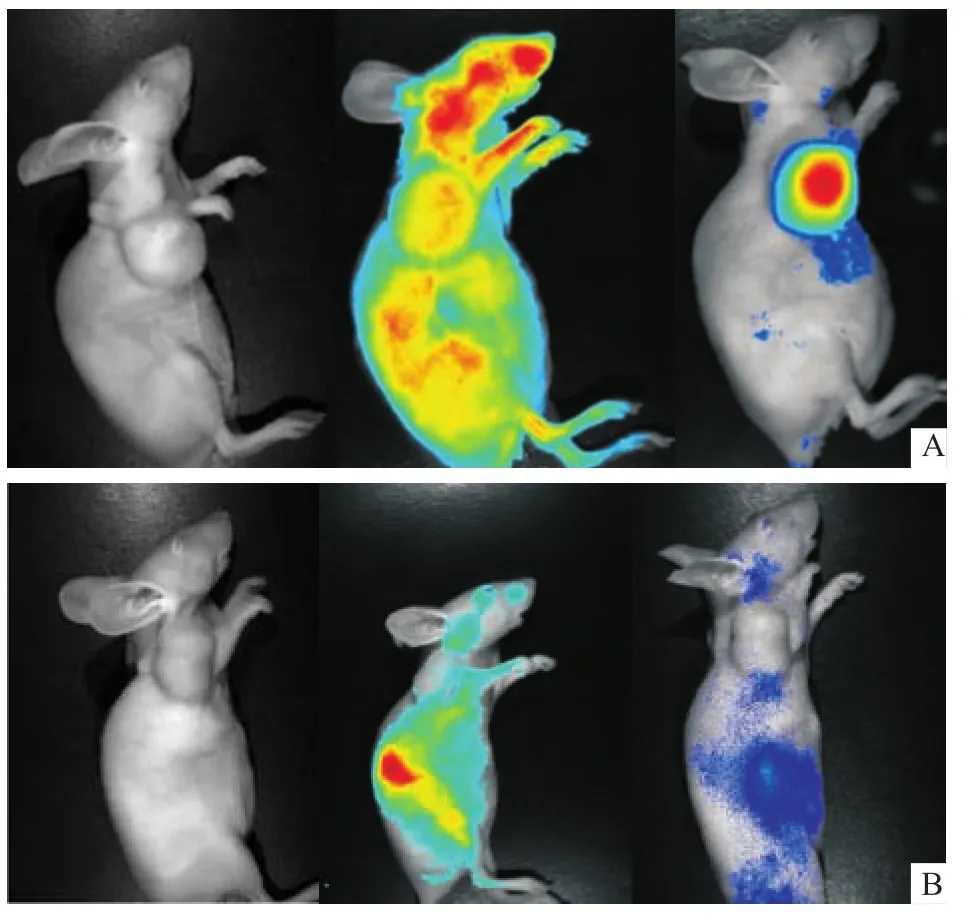
Fig 3 Fluorescence imaging of the Cy5 labeled anti-CD19(Fab)-LDP(A)and Cy5 labeled LDP(B)in vivo
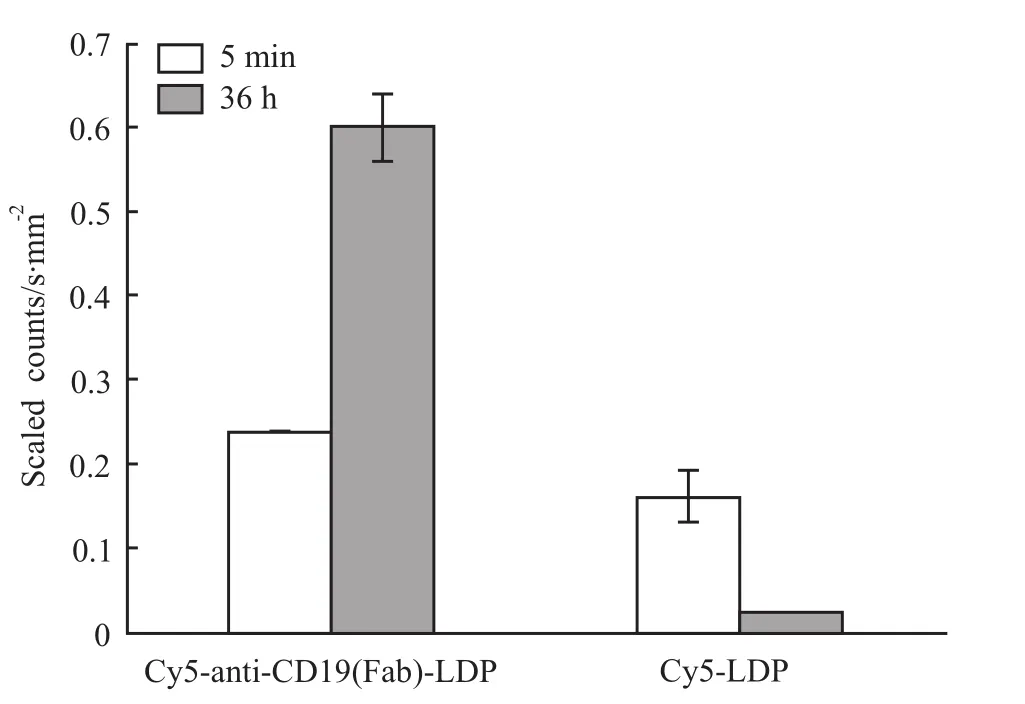
Fig 4 Comparison between Cy5-anti-CD19(Fab)-LDP and Cy5-LDP in term s of fluorescence value of per unit area in m ice tumor
3 讨论
在我国,非霍奇金淋巴瘤(NHL)占全部淋巴瘤病例的90%左右,近十几年来其发病率逐年升高。NHL为全身性疾病,目前主要以联合化疗为主,但其效果并不理想。随着单克隆抗体的出现,针对淋巴瘤表面CD20抗原的人源性单抗利妥昔在淋巴瘤的靶向治疗中取得了巨大的成功,然而随着临床应用的增多,超过50%患者对其发生耐药。其机制可能涉及肿瘤细胞表面CD20抗原的下调等因素,因此,寻找更适合的治疗靶点迫在眉睫。而抗体药物免疫偶联物的研究,是近几年肿瘤靶向治疗的一个热点[9]。
B型淋巴细胞表面有多种抗原表达,包括CD19、CD22、CD37和CD40等。CD19抗原在 B细胞发育阶段早期就有表达,而且还表达在大多数慢性B淋巴细胞白血病(CLL)、非霍奇金淋巴瘤(NHL)和急性B淋巴细胞白血病(ALL)细胞表面,并且抗原在淋巴细胞发生恶性转移时并未丢失。这些特性表明,CD19抗原是抗体靶向治疗B系恶性淋巴瘤的一个理想靶点。LDM是一种具有较强肿瘤杀伤活性的抗生素,并且其对多药耐药性的肿瘤细胞也显示出强烈的细胞毒性[10],是一种比较理想的高效“弹头”药物,用于研制新的小型化高效抗肿瘤导向药物[11]。力达霉素还有另外一个优势,是由一个烯二炔发色团AE和一个酸性辅基蛋白LDP以非共价键结合而成,可以进行拆分和重建[12]。因此,将抗人CD19抗体片段与LDM重组,形成的抗CD19(Fab)-LDM分子质量小,易于穿透肿瘤组织,并且通过基因重组方法,结构稳定,剂量可控,有希望成为治疗淋巴瘤的靶向药物。
Cy5属于花菁类染料(Cyanine dyes),这类染料的荧光特性与传统荧光素类似,但水溶性和对光稳定性较强,荧光量子产率较高,对pH等环境不敏感。Cy5比其他的荧光团探针要更亮,更稳定,背景更弱。由于Cy5的最大发射波长为680 nm,很难用裸眼观察,而且不能使用高压汞灯作为理想的激发光源,通常观察Cy5时需使用激光扫描共聚焦显微镜。前期工作我们已经将CD19 Fab片段与力达霉素LDM的辅基蛋白LDP进行基因重组形成融合蛋白,组装上发色团AE形成强化融合蛋白,证实了强化融合蛋白对肿瘤细胞的抑制杀伤作用[6]。由于发色团AE具有细胞毒性,且结构不稳定,因此不能将LDM注射到动物体内观察靶向分布。
本研究首次采用Cy5标记抗体的方法,制备了Cy5-anti-CD19(Fab)-LDP标记抗体,采用流式细胞术分析标记抗体与淋巴瘤Raji细胞的亲和力。流式结果证明,Cy5-anti-CD19(Fab)-LDP与淋巴瘤Raji细胞有良好的亲和活性。
为了更好的验证该融合蛋白的靶向性作用,成功构建裸鼠CD19 Raji移植瘤模型,体内活体成像观察结果表明,anti-CD19(Fab)-LDP确实可以靶向CD19+的肿瘤部位,并且随着时间的增加,抗体在肿瘤部分的富集逐渐增多。
本实验研究说明,我们可以采用Cy5标记抗体药物,并用活体成像系统可以实时监测到抗体药物在荷瘤裸鼠体内的生物动态分布。应用基因工程技术获得的抗CD19抗体Fab片段和力达霉素的融合蛋白,分子量小、活性强,具有较好的临床价值,应用在肿瘤治疗方面具有很好的前景。且Cy5标记的方法对其他类型的抗体药物在荷瘤小鼠体内的靶向效果分析同样具有参考价值和指导意义。
参考文献:
[1]Ferlay J,Autier P,Boniol M,etal.Estimates of the cancer incidence and mortality in Europe in 2006[J].AnnalsOncol,2006,18(3):581-92.
[2]Siegel R,Naishadham D,Jemal A.Cancer statistics for Hispanics/Latinos,2012[J].CA:ACancer JClin,2012,62(1):10-9.
[3]Winter M C,Hancock BW.Ten years of rituximab in NHL[J].Expert Opin Drug Saf,2009,8(2):223-35.
[4]Shao RG,Zhen Y S.Antitumor activity ofnew antitumor antibiotic C1027 and itsmonoclonal antibody assembled conjugate[J].Yao Xue Xue Bao,1992,27(7):486-91.
[5]Xu Y J,Zhen Y S,Goldberg IH.C1027 chromophore,a potent new enediyne antitumor antibiotic,induces sequence-specific double-strand DNA cleavage[J].Biochemistry,1994,33(19):5947-5954.
[6]姜琳琳,张孝云,马 莉,等.基因工程抗体抗 CD19(Fab)-LDM的制备及生物学活性研究[J].中国药理学通报,2013,29(10):421-6.
[6]Jiang L L,Zhang X Y,Ma L,et al.Preparation of genetic engineering antibody anti-CD19(Fab)-LDM and its biological activity[J].Chin Pharmacol Bull,2013,29(10):421-6.
[7]Friedberg JW.Relapsed/refractory diffuse large B-cell lymphoma[J].Hematol Am Soc Hematol Educ Program,2011,2011(1):498-505.
[8]Zelenetz A D,Abramson JS,Advani R H,et al.NCCN clinical practice guidelines in oncology:non-Hodgkin’s iymphomas[J].J Natl Compr Canc Netw,2010,8(3):288-334.
[9]Swann JB,Smyth M J.Immune surveillance of tumors[J].J Clin Invest,2007,117(5):1137-46.
[10]Shao R G,Zhen Y S.Relationship between themolecular composition of C1027,a new macromolecular antibiotic with enediyne chromophore,and its antitumor activity[J].Yao Xue Xue Bao,1995,30(5):336-42.
[11]程 昕,杨 铭,范冬梅,等.重组融合蛋白抗CD20Fab-LDM的构建、表达及体外活性研究[J].中国药理学通报,2009,25(12):1650-4.
[11]Cheng X,Yang M,Fan D M,et al.Construction,expression andin vitrospecific killing activity of a recombinant fusion protein:anti-CD20Fab-LDM[J].Chin Pharmacol Bull,2009,25(12):1650-4.
[12]Shao R G,Zhen Y S.Enediyne anticancer antibiotic lidamycin:chemistry,biology and pharmacology[J].Anticancer AgentsMed Chem,2008,8(2):123-31.

