钙调素依赖性蛋白激酶Ⅱ的分子调节与突触可塑性
贺文彬,张俊龙,于龙川,陈乃宏,2
(1.脑藏象学山西省高等学校重点实验室,山西中医学院基础医学院,山西太原 030024;2.天然产物活性物质与功能国家重点实验室,中国医学科学院北京协和医学院药物研究所,北京 100050;3.北京大学生命科学学院,北京 100871)
自从神经科学家们第一次认识到神经元内部的生物化学变化能够影响到的整个脑的功能以后,人们便开始了寻找“记忆分子”的历程。它可能是某种未知离子、小分子、蛋白或者核酸等等,而对于记忆分子的了解可能会引导我们揭示认知过程的奥秘。目前已经建立了很多关于记忆分子如何工作的模型,但是人们更倾向于认为记忆分子可能是一种基于蛋白激酶/蛋白磷酸酶的分子开关[1]。已知有很多具有这种特性的蛋白激酶[2],其中钙调素依赖性蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinaseⅡ,CaMKⅡ)在学习和记忆中的作用研究较为深入[3]。CaMKⅡ是一种作用底物广泛的丝氨酸/苏氨酸磷酸化蛋白激酶。它存在于大多数组织中,在某些脑区(如海马)甚至可达到神经元总蛋白含量的2%[4]。大多数具有激酶活性的蛋白分子在组织中的表达量都相对较低,所以CaMKⅡ在神经系统中高度表达必然具有其特殊意义。值得注意的是,CaMKⅡ可以分布于神经元的不同亚细胞结构或者组分中,CaMKⅡ的这种特性可能在其调控神经递质囊泡的细胞内转运,从而在调控突触可塑性的功能中具有重要作用。自从1978年CaMKⅡ活性被首次描述以来,以CaMKⅡ作为题目中关键词的研究论文已超过1 200篇。本文将对近年来关于CaMKⅡ分子调节及其参与突触可塑性机制的研究进展做一综述。
1 CaMKⅡ的分子结构和自身磷酸化特征
哺乳动物组织中的CaMKⅡ由α、β、γ和δ4种基因编码,但在脑组织中以α和β亚型居多。不同亚型的CaMKⅡ单体组成一个全酶,大鼠脑中的CaMKⅡ全酶由8~12个单体构成。最近针对重组大鼠CaMKⅡ的研究得到了高分辨率的全酶立体构象。研究表明,CaMKⅡ全酶结构是一个由两个6聚体环叠在一起的12聚体,全酶的分子质量大约为300~700 ku,单体分子质量为50~62 ku。目前还没有高分辨率的CaMKⅡ全酶X射线结构。每个单体都包含有催化区、调节区和结合区。催化区位于N末端(aa1-272),与其相邻的是调节区(aa273-314)。调节区是整个激酶分子结构中功能变化最多的部分。调节区又由自身抑制区(aa281-309)、钙调素结合区(296-311)和自身磷酸化位点(苏氨酸286、305、306,丝氨酸314)组成。结合区(aa315-478)是不同单体组成全酶的相接部位。静息状态时,CaMKⅡ的自身抑制区与催化区相互重叠,封闭催化区与底物或者ATP的相互作用的位点。Ca2+/CaM是主要的激活CaMKⅡ的信号分子。Ca2+/CaM与C末端(aa293-310)的结合使得 CaMKⅡ分子构象改变,自身抑制区释放催化区的底物和ATP结合位点,并且在Thr286发生自身磷酸化。Thr286的自身磷酸化随后可引起全酶各个单体之间的相互磷酸化,这种变化使得CaMKⅡ具有自动捕捉CaM的能力,从而导致全酶的活化。当Ca2+/CaM与CaMKⅡ结合时,仅有Thr286发生磷酸化,Thr305和Thr306处于去磷酸化状态。一旦Ca2+浓度持续低水平,Ca2+/CaM便会与 CaMKⅡ解离,导致 Thr305和Thr306发生自身磷酸化,阻止Ca2+/CaM与CaMKⅡ的结合,并且最大化全酶的活性。此时CaMKⅡ的活性是钙非依赖的,并且这种钙非依赖性活性能够维持很长一段时间(Fig 1)。因此CaMKⅡ又被称为具有“记忆功能”的蛋白激酶。
2 CaMKⅡ亚细胞空间定位在突触可塑性机制中的重要作用

图1 CaMKⅡ的自身磷酸化示意图[Fukunaga K and Miyamoto E.Neurosci Res,2000,38(1):3-17]
CaMKⅡ参与突触可塑性作用的发挥有赖于它的亚细胞空间定位(Fig 2)。CaMKⅡ能够在接收刺激前移动到接近其底物的位置,或者在接收刺激后迅速转移到锚定蛋白处[5-6]。CaMKⅡ及其底物的空间位移可能具有以下作用[7]:(1)CaMKⅡ向其底物的位移使得CaMKⅡ在其底物处的含量升高,从而增加其对刺激的敏感性并加快自身磷酸化速度;(2)位移使得CaMKⅡ远离其基础状态时的位置从而提高激酶活性的信噪比;(3)向锚定蛋白的位移可以提高激酶的原位浓度,包括基础状态时的浓度,从而增加激酶对第二信使的敏感性,甚至增强在基础状态时的激酶活性。Ca2+作为第二信使只在特定的亚细胞位置发挥作用,因此,CaMKⅡ的空间位移可使其转移到Ca2+集中部位从而明显提高其对Ca2+浓度变化的反应。(4)除了向底物和Ca2+的位移,CaMKⅡ还向蛋白磷酸酶和钙调素接近,从而增加其活性强度。
2.1 CaMKⅡ的PSD定位突触后致密部位(PSD)存在大量可与CaMKⅡ结合的蛋白。以往的研究表明,CaMKⅡ活化后可使CaMKⅡ向PSD转移使其含量翻倍。PSD中CaMKⅡ的浓度能够影响长时程增强和海马依赖的学习获得,因此对于CaMKⅡ向PSD的转移并与之结合的研究显得尤其重要。NMDA受体(NMDA-R)是CaMKⅡ的一个重要底物。在脑组织提取物、共转染的HEK293细胞和脑片研究中,CaMKⅡ与NMDA-R的相互作用已经被多种方法证明。在转染绿荧光蛋白(GFP)和CaMKⅡ的海马神经元中,活化的NMDA-R产生出强烈的荧光,并与PSD中的标志性蛋白PSD-95免疫沉淀结合[8]。关于CaMKⅡ向PSD转移的机制假说认为:树突中的CaMKⅡ的β亚基与F-肌肉蛋白(F-actin)结合绑定,当NMD-R活化引起钙离子内流以及随后的CaMKⅡ活化,从而引起CaMKⅡ向PSD转移。除了NMDAR之外,densin-180也是一个重要的PSD底物。它能够选择性的与自身磷酸化的αCaMKⅡ结合,二者的复合物又与αactinin形成三聚物[9]。另外1个重要的PSD底物是细胞骨架相关蛋白 synGAP(synaptic ras-GTPase-activating protein),二者的结合可能是联系Ca2+信号通路和MAPK信号通路的关键环节[10]。最近采用GFP和CaMKⅡ融合蛋白表达的研究表明,活化后的CaMKⅡ可能定位于突触后致密部,并通过某种机制诱导其他相关蛋白定位于突出后致密部,共同完成突触功能增强[11]。
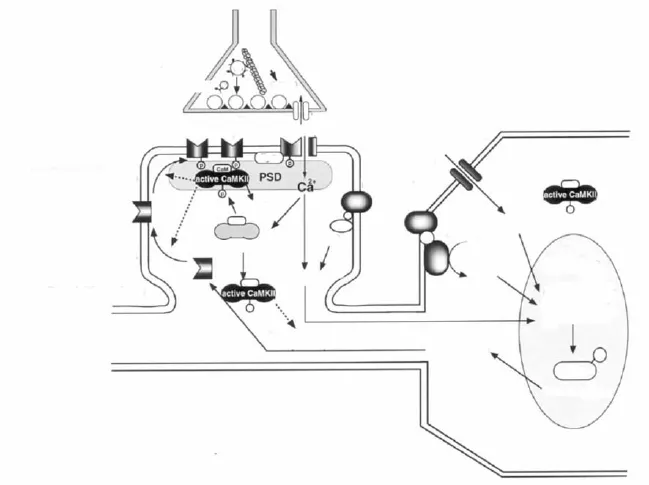
图2 CaMKⅡ的细胞内工作模型示意图[Fukunaga K and Miyamoto E.Neurosci Res,2000,38(1):3-17]
2.2 CaM KⅡ的核定位CaMKⅡ介导的基因表达改变需要实现它的核定位。最近的研究发现,颗粒细胞中调控树突生长和形态变化的转录因子NeuroD能够被CaMKⅡ磷酸化,但是还不清楚参与其中的是CaMKⅡ的哪种亚型[12]。编码CaMKⅡ的基因中含有一个叫做核定位信号(nuclear localization signal,NLS)的序列,直接调控CaMKⅡ的核定位。体外研究证实,CaMKI和CaMKIV都能磷酸化一个丝氨酸残基,最终导致CaMKⅡ核定位的阻断,而这个丝氨酸残基紧邻αCaMKⅡ的NLS位点(Ser332),表明CaMKⅡ的核定位受某种机制的调控。Thr286的自身磷酸化同样可以阻断CaMKⅡ核定位,表明在持续的高Ca2+水平时期,核外有CaMKⅡ的合成存在。
2.3 CaM KⅡ的膜定位在CaMKⅡ的亚型中有一种叫做αKAP(αkinase anchoring protein),由于替换剪接和编码区的增强子被替代,导致其催化能力缺陷,替换其N末端的是一个短的疏水性肽段,紧邻结合区域。它的结合域使其与其他含有催化域的亚型相接形成全酶,而其疏水肽段与膜相连,使得整个全酶锚靠在膜上[13]。因此,本质上αKAP是CaMKⅡ的一个锚定蛋白。经典的理论认为CaMKⅡ通过其催化区与突触囊泡相接,从而提高突触素I与突触囊泡的结合力,突触素I又与微管蛋白相结合。研究证实突触素I是通过αCaMKⅡ与突触囊泡连接。因此,CaMKⅡ必定会进行一种翻译后修饰,从而增强与脂质双层的相互作用,或者是与一种膜蛋白相互作用而完成其膜定位。
2.4 CaMKⅡ的细胞骨架定位应用GFP-CaMKⅡ的研究证明CaMKⅡ可通过细胞骨架蛋白结合而定位到细胞膜、树突和丝状伪足。CaMKⅡ能定位于细胞骨架蛋白F-actin,但能被 Ca2+/CaM解离[14]。F-actin与 βCaMKⅡ相结合,而不是αCaMKⅡ。这种结合在丝状伪足和神经突起运动、树突和突触形成中发挥重要作用。我们的研究还表明神经节苷脂GT1b和GD1b诱导的CaMKⅡ磷酸化可以促进CDC42介导的肌动蛋白重组,引起丝状伪足的生长[15],这种现象是否也涉及到βCaMKⅡ亚型的定位有待进一步研究。应用CaMKⅡ的高选择性可透膜抑制剂和反义RNA技术下调βCaMKⅡ表达证明能够减少神经突起的运动并减少树突分化[16]。α/βCaMKⅡ与actin的部分结合,可引起神经元部分树突分化[16],而非神经元亚型与actin的部分结合可导致actin富集的神经突起延伸[17]。尽管αCaMKⅡ已经被证明与突触功能增强有关,但是βCaMKⅡ可能在促进树突和丝状伪足运动以及新的突触联系形成中具有重要作用。
3 CaMKⅡ在突触和行为可塑性中的作用
CaMKⅡ分子的自身磷酸化特征和亚细胞空间定位变化是其参与神经元突触功能调节,进而在学习和记忆机制中发挥作用的结构基础[5,6,18]。已有大量采用药理和基因技术的研究在细胞和整体水平研究了CaMKⅡ在是神经元功能中的作用。长时程增强(long-term potentiation,LTP)是指在给予一个高频串刺激后突触功能得到增强并维持很长一段时间。研究表明海马CA1区LTP诱导和维持依赖于CaMKⅡ的活化[19],LTP诱导后5 min内便会产生CaMKⅡ的Thr286自身磷酸化。最新的体内实验研究表明,动物在经过行为学训练以后,其海马中磷酸化的CaMKⅡ蛋白含量升高,进一步证实了这个结论[20]。LTP的缺陷常会引起空间记忆能力的损坏,缺乏αCaMKⅡ的动物不能够正常完成空间学习任务。CaMKⅡ的“开关”样特征在突触可塑性机制中具有重要作用。研究表明在Thr286位点发生的CaMKⅡ自身磷酸化在诱导LTP形成的刺激消除后仍然维持在较高水平,定点突变研究证明含有αCaMKⅡT286A的动物由于失去CaMKⅡ自身磷酸化作用而阻断CA1区LTP诱导,并且该动物不能正常完成Morris水迷宫学习[21]。相关条件恐吓研究也能够诱导αCaMKⅡ的自身磷酸化,从而使动物形成条件性记忆,而应用CaMKⅡ抑制剂可以导致恐吓记忆障碍,并且无法诱导LTP[22]。基因敲除或转基因小鼠的应用为我们提供了一个更好了解αCaMKⅡ的途径,大量的此类研究证实了CaMKⅡ在海马突触可塑性、皮层突触可塑性以及学习记忆行为中不可替代的作用[23]。已有充足的证据表明突触后的CaMKⅡ在突触可塑性机制中具有重要作用,新的研究还表明突触前的CaMKⅡ活化同样是突触可塑性机制所必需的。在培养的海马神经元中,向突触前膜注射不可透膜的CaMKⅡ抑制剂肽281-309能够抑制由强直刺激、谷氨酸或者NO/cGMP通路激活所诱导的突触后 EPSP形成[24]。
4 几种新的CaMKⅡ的作用底物
CaMKⅡ的作用底物广泛,已知有多种作用底物,如NMDA受体、AMPA受体、突触素I、微管相关蛋白等等。CaMKⅡ能够催化这些底物而发挥其广泛的生物功能。最近的研究确认了几种新的CaMKⅡ作用底物还包括钙离子通道和钾离子通道。研究表明:R型电压依赖型钙通道的CaMKⅡ依赖性活性降低能够阻断LTP的诱导[25],果蝇中CaMKⅡ能够通过磷酸化eag钾通道而降低树突的兴奋性[26],在哺乳动物中CaMKⅡ能够磷酸化Kv4.2 A型钾通道,并提高它们在细胞膜上的表达,从而降低细胞兴奋性[27]。对CaMKⅡ与这些新发现的底物之间的相互作用研究正在深入进行。
5 CaMKⅡ是突触可塑性的分子开关吗?
在脊椎动物和无脊椎动物的大量研究均证实CaMKⅡ参与学习获得和记忆形成。在某种意义上,这些证据可以说明CaMKⅡ是一个记忆分子。然而类似的证据已经表明许多其他分子同样具有记忆分子的特性。仅在蛋白激酶家族中,细胞外信号调节激酶ERK、蛋白激酶C、蛋白激酶A、细胞周期依赖蛋白激酶cdk5和受体/非受体酪氨酸激酶等都被证明参与某种类型的记忆形成。在这个概念上,所有这些蛋白激酶都是记忆分子。因此,给记忆分子下一个准确的定义是及其困难的,重要的是我们是否应该继续致力于寻找记忆分子的努力?是否确实存在这样的记忆分子?因为已经被证明的参与LTP和空间学习的蛋白激酶都具有其他非学习相关的作用。我们已经知道脑的可塑性与细胞和亚细胞结构的短时程或者长时程变化有关。如CaMKⅡ,其主要聚集的亚细胞结构,是突触后致密部。要明确CaMKⅡ如何参与记忆形成,首先应当了解CaMKⅡ在突触后致密部是如何与它的作用底物进行相互调节的?如何影响神经递质囊泡的细胞内转运?最新的研究已经证实CaMKⅡ对成熟和新生的运动神经元释放乙酰胆碱具有双向调节作用[28],但对于其他神经递质的研究还有大量的研究工作等待我们去探索。
参考文献:
[1]Pi H J,Otmakhov N,Lemelin D,et al.Autonomous CaMKⅡ can promote either long-term potentiation or long-term depression,depending on the state of T305/T306 phosphorylation[J].JNeurosci,2010,30(26):8704-9
[2]袁 辉,杨 胜,周文霞,等.MAPK级联信号通路与长时程增强[J].中国药理学通报,2006,22(7):769-74
[2]Yuan H,Yang S,Zhou W X,et al.Mitogen-activated protein kinases cascade pathway and long-term potentiation[J].Chin Pharmacol Bull,2006,22(7):769-74
[3]Li L,Stefan M I,Le Novère N.Calcium input frequency,duration and amplitude differentiallymodulate the relative activation of calcineurin and CaMKⅡ[J].PLoSOne,2012,7(9):e43810.
[4]Kato K,Iwamoto T,Kida S.Interactions betweenαCaMKⅡ and calmodulin in living cells:conformational changes arising from CaM-dependent and-independent relationships[J].Mol Brain,2013,6(1):37.
[5]Jalan-Sakrikar N,Bartlett R K,Baucum A J2nd,etal.Substrateselective and calcium-independent activation of CaMKⅡ byα-actinin[J].JBiol Chem,2012,287(19):15275-83.
[6]Jin D Z,Guo M L,Xue B,et al.Phosphorylation and feedback regulation ofmetabotropic glutamate receptor1 by calcium/calmodulin-dependent protein kinaseⅡ[J].JNeurosci,2013,33(8):3402-12.
[7]Jurado S,Biou V,Malenka R C.A calcineurin/AKAP complex is required for NMDA receptor-dependent long-term depression[J].Nat Neurosci,2010,13(9):1053-5.
[8]Shen K,Meyer T.Dynamic control of CaMKⅡ translocation and localization in hippocampal neurons by NMDA receptor stimulation[J].Science,1999,284(5411):162-6.
[9]Walikonis R S,Oguni A,Khorosheva E M,et al.Densin-180 forms a ternary complex with theα-subunit of Ca2+/calmodulindependent protein kinaseⅡ andα-actinin[J].JNeurosci,2001,21(2):423-33.
[10]Oh JS,Manzerra P,Kennedy M B.Regulation of the neuron-specific Ras GTPase-activating protein,synGAP,by Ca2+/calmodulin-dependent protein kinaseⅡ[J].J Biol Chem,2004,279(17):17980-8.
[11]Hudmao A,Lebel E,Roy H,etal.Amechanism for Ca2+/calmodulin-dependent protein kinaseⅡclustering at synaptic and nonsynaptic sites based on self-association[J].JNeurosci,2005,25(30):6971-83.
[12]Gaudillliere B,KonishiY,de la Iglesia N,etal.A CaMKⅡ-NeuroD signaling pathway specifies dendritic morphogenesis[J].Neu-ron,2004,41(2):229-41.
[13]Mouslim C,Aittaleb M,Hume R I,etal.A role for the calmodulin kinaseⅡ-related anchoring protein(αkap)in maintaining the stability of nicotinic acetylcholine receptors[J].JNeurosci,2012,32(15):5177-85.
[14]Feng B,Raghavachari S,Lisman J.Quantitative estimates of the cytoplasmic,PSD,and NMDAR-bound pools of CaMKⅡ in dendritic spines[J].Brain Res,2011,14(19):46-52.
[15]Chen N,Furuya S,Doi H,et al.Ganglioside/Calmodulin kinaseⅡsignal inducing cdc42-mediated neuronal actin-reorganization[J].Neurosci,2003,120(1):163-76.
[16]Fink C,Bayer K,Myers J,et al.Selective regulation of neurite extension and synapse formation by theβbutnotαisoform of CaMKⅡ[J].Neuron,2003,39(2):283-97.
[17]Caran N,Johnson L D,Jenkins K J,et al.Cytosolic targeting domains ofγandδcalmodulin-dependent protein kinaseⅡ[J].J Biol Chem,2001,276(45):42514-19
[18]Griffith L C.Regulation of calcium/calmodulin-dependent protin kinaseⅡactivation by intramolecular and intermolecular interactions[J].JNeurosci,2004,24(39):8394-8
[19]Silva A J,Stevens C F,Tonegawa S,et al.Deficient hippocampal long-term potentiation in alpha-calcium-calmodulin kinaseⅡmutantmice[J].Science,1992,257(5067):201-6.
[20]Pollak D D,Herkner K,Hoeger H,et al.Behavioral testing upregulates pCaMKⅡ,BDNF,PSD-95 and egr-1 in hippocampus of FVB/N mice[J].Behav Brain Res,2005,163(1):128-35.
[21]Giese K P,Fedorov N B,FilipkowskiR K,etal.Autophosphorylation at Thr286 of the alpha calcium-calmodulin kinaseⅡin LTP and learning[J].Science,1998,279(5352):870-3.
[22]Rodrigues SM,Farb CR,Bauer E P,etal.Pavlovian fear conditioning regulates Thr286 autophosphorylation of Ca2+/calmodulindependent protein kinaseⅡ at lateral amygdala synapses[J].J Neurosci,2004,24(13):3281-8.
[23]Elgersma Y,Sweatt JD,Giese K P.Mouse genetic approaches to investigating calcium/calmodulin-dependent protein kinase Ⅱfunction in plasticity and cognition[J].J Neurosci,2004,24(39):8410-5.
[24]Ninan I,Arancio O.Presynaptic CaMKⅡ is necessary for synaptic plasticity in cultured hippocampus neurons[J].Neuron,2004,42(1):129-41.
[25]Yasuda R,Sabatini B L,Svoboda K.Plasticity of calcium channels in dendritic spines[J].Nat Neurosci,2003,6(9):948-55.
[26]Wang Z,Wilson G F,Griffith L C.Calcium/calmodulin-dependent protein kinaseⅡphosphorylates and regulates the Drosophila eag potassium channel[J].JBiol Chem,2002,277(27):24022-9.
[27]Varga AW,Yuan L L,Anderson A E,et al.CaMKⅡ modulates Kv4.2 channel expression and upregulates neuronal A-type potassium currents[J].JNeurosci,2004,24(14):3643-54.
[28]Bogatcheva PO,Balezina O P.Multidirectionaleffects of calmodulin kinaseⅡon transmitter release in mature and newly formed mouse motor synapses[J].Bull Exp Biol Med,2013,154(3):316-9.

