α1抗胰蛋白酶突变体ATZ过表达增强细胞自噬水平
朱 娜,冯利杰,王海萍,沈玉君,沈玉先
(安徽医科大学1.药学院、2.基础医学院、3.生物药物研究所,安徽 合肥 230032)
α1抗胰蛋白酶(α1-antitrypsin,AAT)属于丝氨酸蛋白酶超家族成员,由肝细胞合成和分泌,可以抑制包括胰蛋白酶、糜蛋白酶、凝血酶等多种蛋白酶活性,但其主要作用是通过血液循环扩散到肺部,保护肺组织弹力纤维免受中性粒细胞弹性蛋白酶的水解和破坏[1]。AAT缺乏症是一种常染色体隐性遗传病,由于编码AAT蛋白的基因突变而引起AAT分泌障碍所致,其中最常见的突变为Z型突变,该突变编码的蛋白为AAT Z突变体(α1-antitrypsin Z variant,ATZ)。AAT缺乏症最典型的临床表现为早发性肝脏疾病和肺气肿[2-3]。其中,AAT缺乏症肝脏疾病主要是由于ATZ蛋白在肝细胞内聚集造成的细胞毒性引起。我们的前期研究已发现ATZ具有细胞毒性,但其细胞毒作用的确切机制还不清楚。自噬是普遍存在于真核细胞中的一种保守的蛋白质降解途径,细胞利用溶酶体降解自身细胞器和大分子物质,实行“自我消化”,在营养缺乏、氧化应激、缺氧等条件下对细胞具有一定程度的保护作用;但是,过度激活的自噬也会引起细胞的损伤,甚至细胞死亡[4]。研究发现,引起细胞毒性的ATZ聚集体部分会被自噬体包裹并降解,而对于自噬在过表达ATZ所引起的细胞毒性过程中是否发挥着一定的作用尚不清楚[5]。本研究通过在293T细胞中过表达ATZ蛋白,检测细胞自噬相关基因和蛋白表达及自噬体的形成,观察ATZ对自噬活性和细胞形态的影响,从而为其细胞毒性作用提供实验依据。
1 材料与方法
1.1 试剂及抗体DMEM高糖培养基,Opti-MEM,Lipofectamine 2000购自Gibco公司,小牛血清(fatal bovine serum,FBS)购自杭州四季青公司,预染蛋白分子量Marker购自Fermentas公司,PVDF膜为GE公司产品,ECL发光试剂盒购自Pierce公司,NH4Cl购自上海生工产品,p62、LC3、α-tubulin多克隆抗体购自Sigma公司,Alexa Fluor 488 goat anti-mouse IgG(H+L)和 Alexa Fluor 350 donkey anti-goat IgG(H+L)购自Invitrogen公司,DAB显色试剂盒购自中衫金桥公司,SYBR Premix EX Tag购自宝生生物工程(大连)有限公司。
1.2 方法
1.2.1 质粒转染 293T细胞按5×105个细胞/孔接种于6孔板,在5%CO237℃恒温培养箱中培养,直至转染前细胞密度达到80%~90%;质粒转染采用Lipofectamine 2000,操作方法按试剂说明书进行,转染后的细胞在含5%CO237℃恒温培养箱中培养6 h后,更换培养液。
1.2.2 细胞免疫荧光染色和DAB染色 接种于24孔板的细胞去除培养液,4%多聚甲醛4℃固定10 min,PBS洗 5 min×3次,用含 1.0 g·L-1牛血清白蛋白和1.0 g·L-1皂素的PBS于4℃透膜封闭处理0.5 h,加入DAB染色的一抗,37℃孵育2 h,PBS洗5 min×3次,依次加SP试剂盒中的B,C液,DAB显色;PBS洗5 min×3次后加入适当稀释度的一抗,37℃孵育2 h,PBS洗5 min×3次,加入适当稀释度的荧光二抗37℃避光孵育1 h,DAPI(5 mg·L-1)孵育10 min衬染核,PBS洗5 min×3次,共聚焦显微镜或荧光显微镜采集图片。
1.2.3 蛋白质免疫印迹 收集6孔板中转染后的细胞,用含蛋白酶抑制剂的蛋白裂解液冰上裂解细胞30 min,100℃变性15 min。SDS-PAGE凝胶电泳后湿转至PVDF膜。用含0.5 g·L-1脱脂奶粉的PBST封闭30 min后,加入适当稀释度的一抗室温孵育2 h,PBST洗10 min×3次,加入适当稀释度的二抗室温结合1 h,PBST洗10 min×3次,ECL显影。
1.2.4 real-time PCR 反应总体积10μl,SYBR Premix Ex Taq 5μl,cDNA模板1μl,双蒸水3.2μl,引物0.8μl,反应条件为:94℃变性2 min,94℃变性10 s,57℃退火10 s,72℃延伸20 s,45个循环。Beclin1上游引物:5′-CAA GATCCTGGACCGTGTCA-3′,下游引物:3′-TGGCACTTTCTGTGGACATCA-5′;Atg5上游引物:5′-AGAATAGCCAGTACAGCA-3′,下游引物:3′-ATGAA CCGACGAATAAAC-5′;Atg12上游引 物:5′-GCGAACACGAACCATCCA-3′,下 游 引物:3′-CCACGCCTGAGACTTGCA-5′。
2 结果
2.1 ATZ表达对自噬相关蛋白LC3和p62表达的影响为了检测ATZ表达对细胞自噬的影响,我们观察了自噬相关蛋白:微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)和p62的表达。结果发现,转染表达正常AAT蛋白质粒(pcDNA3.1-zeo+-ATM)的细胞相比,ATM(alpha1-antitrypsin M phenotype)为正常活性 AAT,转染Z型突变体质粒(pcDNA3.1zeo+-ATZ)的细胞中LC3-Ⅱ/Ⅰ增加,提示ATZ能增加自噬体形成(Fig 1);同时转染ATZ的细胞中p62水平明显降低,而溶酶体抑制剂氯化铵(25 mmol·L-1)作用4 h能增加p62水平(Fig 1),提示ATZ增加细胞自噬水平,增加p62降解。
2.2 ATZ表达对细胞自噬体形成的影响同上转染细胞,并用氯化铵抑制溶酶体降解功能,免疫荧光双标结果显示,ATZ表达少的细胞中LC3弥散在胞质中(Fig 2,细箭头所示);而ATZ表达多的细胞中可以看到大量LC3的点状聚集(Fig 2,粗箭头所示),并且与ATZ共定位,提示ATZ能促进细胞内自噬体的形成。
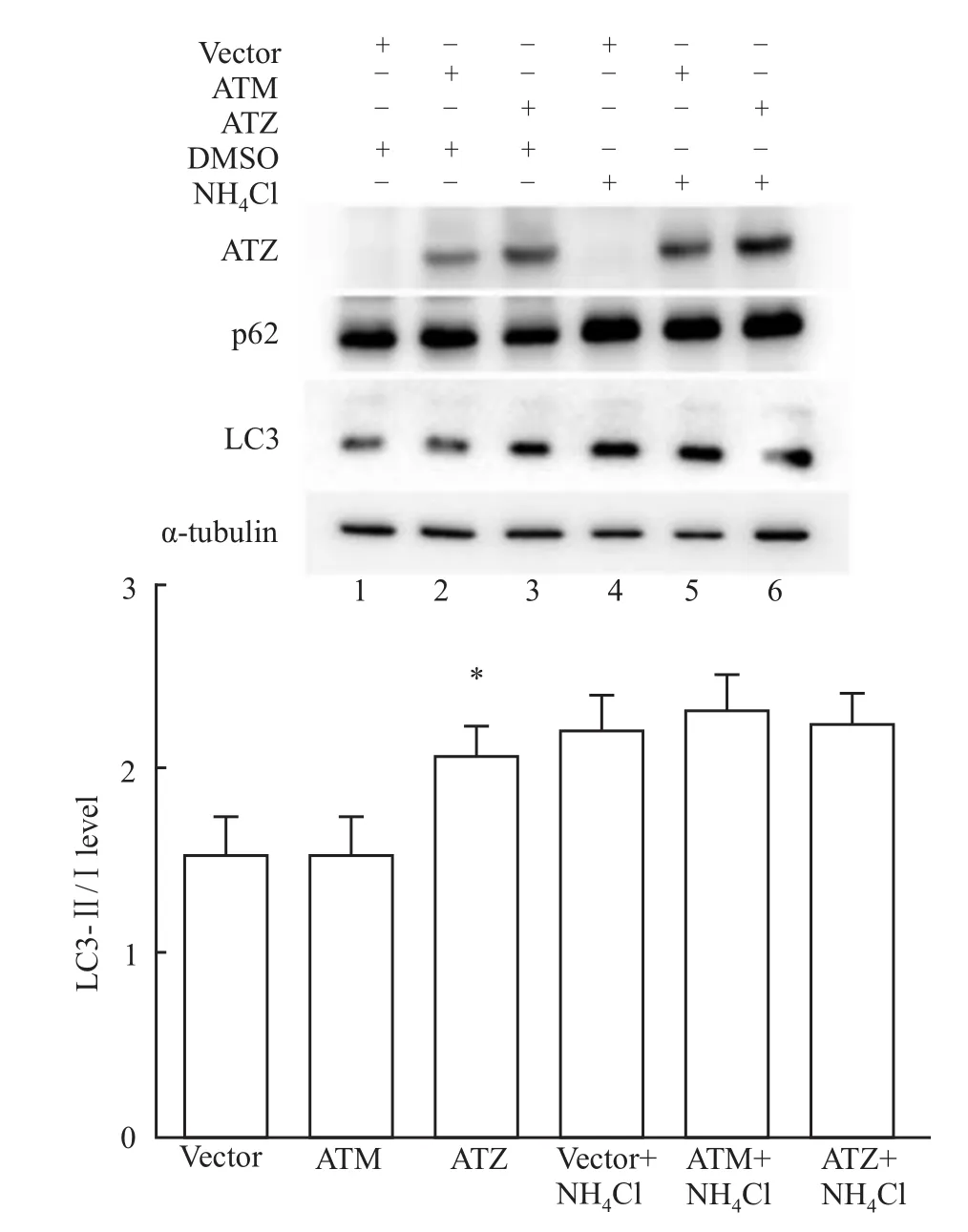
Fig 1 ATZ overexpression increases LC3-Ⅱ/Ⅰand facilitates p62 degradation
2.3 ATZ表达对细胞自噬相关基因的影响为了进一步了解ATZ对细胞自噬水平的影响,我们观察了自噬关键基因Atg5、Atg12和Beclin1的表达。与转染空质粒的细胞相比,过表达ATZ的细胞中Atg5和Atg12的mRNA水平明显增加(Fig3 A,B),而对Beclin1水平无明显影响(Fig 3C)。
2.4 ATZ诱导的自噬水平增加对细胞形态的影响
为了观察ATZ诱导的细胞自噬水平增加对细胞形态的影响,我们同上转染细胞,用免疫细胞染色法检测表达ATZ细胞的形态和LC3水平。结果发现,在少量表达ATZ的细胞中,细胞及细胞核形态趋向正常,LC3表达增加,呈点状聚集在胞质中;ATZ表达高的细胞体积较小或偏圆,细胞核变小、致密或淡染、碎裂甚至消失,破碎;胞质中无 LC3表达(Fig 4)。
3 讨论
AAT是体内重要的蛋白酶抑制物,能抑制包括胰蛋白酶、糜蛋白酶、凝血酶、胶原酶、纤溶酶、尿激酶等多种蛋白酶,其缺乏可引起系统性脉管炎、坏死性脂膜炎、肝脏以及肺部疾病。肝脏疾病包括肝炎、肝硬化和肝癌是AAT缺乏症患者尤其是肝细胞内有AAT多聚体患者明显的临床表现[6]。自噬是一个调控细胞内容物的降解和再循环的过程,通过参与细胞器的代谢、降解以及再利用等维持正常细胞功能。其特征是首先在细胞质中形成月牙形的膜结构,包裹待降解物质后形成的泡状结构称为自噬体,随后自噬体与溶酶体发生融合,自噬所包裹着的待降解物质进入溶酶体中被降解。自噬作为一种细胞生存的机制,在很多生理过程如抵抗营养缺乏、清除损坏的细胞器、降解细胞内异常蛋白质中发挥重要作用[7];然而过度的自噬则会形成自噬应激,损伤细胞器,如造成线粒体功能障碍等,从而产生细胞毒性。
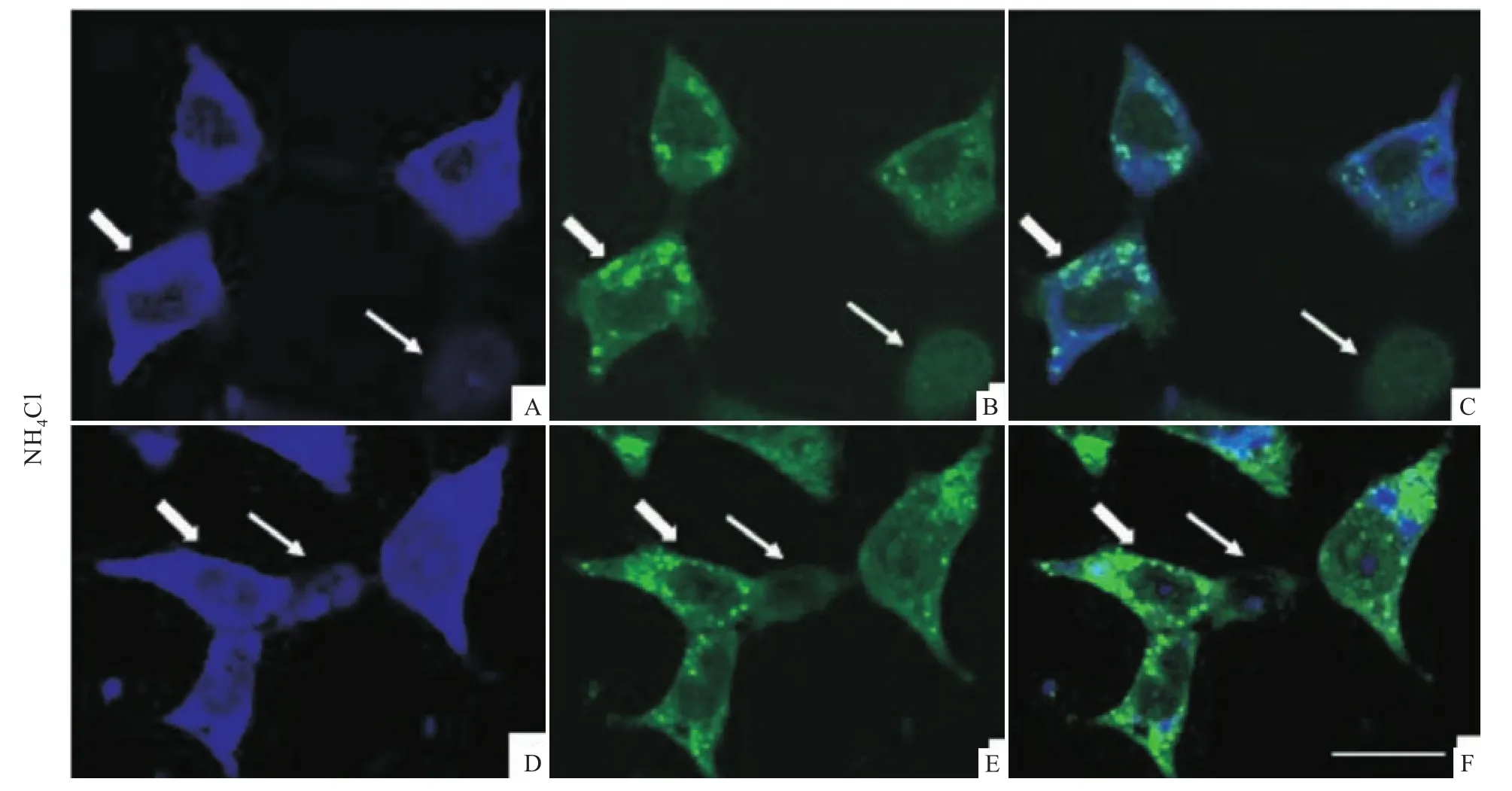
Fig 2 ATZ co-localizeswith LC3 and increases LC3 puncta after autophagy inhibition by NH 4 Cl
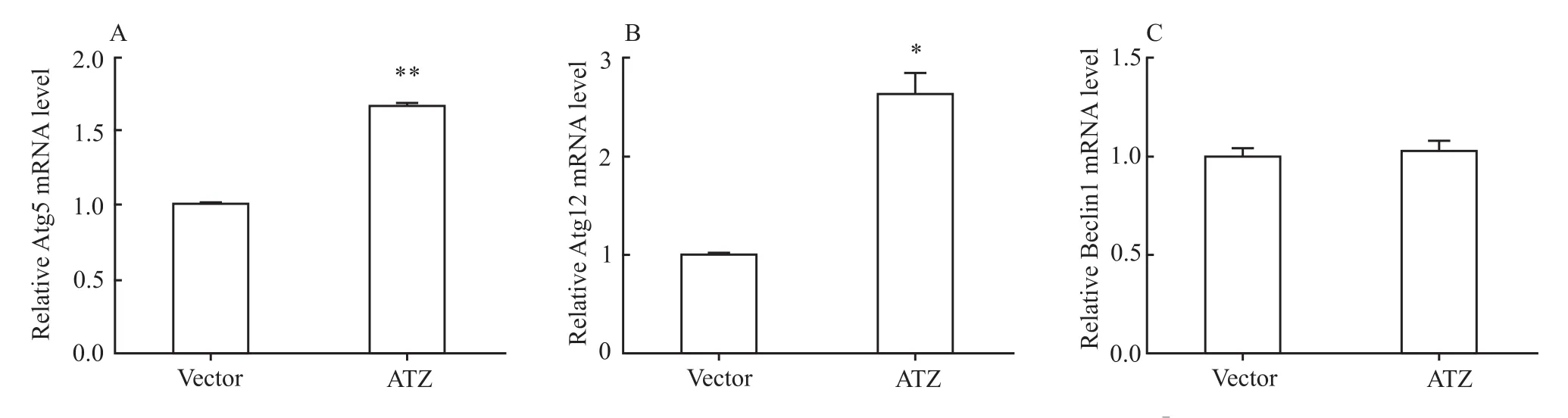
Fig 3 ATZ overexpression increases themRNA levels of Atg5 and Atg12±s)
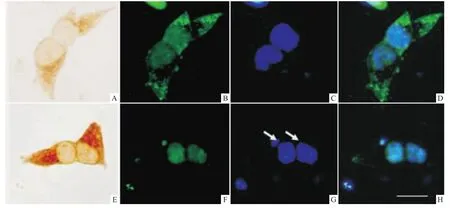
Fig 4 Effect of ATZ expression on cellmorphologies
为了探究ATZ细胞毒性是否与诱导细胞自噬有关,我们在293T细胞中过表达ATZ,观察LC3-Ⅱ/Ⅰ比值的变化以及p62水平。LC3是自噬体膜标志性蛋白,有LC3-Ⅰ和LC3-Ⅱ两种亚型;自噬形成时,胞浆型 LC3(即 LC3-Ⅰ)会酶解掉一小段多肽,转变为(自噬体)膜型(即 LC3-Ⅱ),因此,LC3-Ⅱ/Ⅰ比值的大小可估计自噬水平的高低。p62是一个自身可通过自噬特异性降解的多功能蛋白,p62水平降低在一定程度上反映了自噬水平的增加。我们的结果显示,过表达ATZ细胞中LC3-Ⅱ/Ⅰ比值增加,p62水平降低,而氯化铵抑制自噬后p62水平恢复,提示ATZ能增加细胞自噬。为了更直观的反映ATZ对细胞自噬体形成的影响,我们采用氯化铵抑制溶酶体活性,利用LC3在自噬形成过程中发生聚集的现象观察ATZ对自噬体数量的影响,结果发现过表达ATZ后 LC3点状聚集明显增加[8],提示ATZ能促进细胞内自噬体形成。
通常情况下,细胞自噬的发生依赖于一系列Atg家族蛋白,其中 Beclin1是酵母 Atg6/Vps30基因在哺乳动物中的同源物,通过与ClassⅢPI3K形成复合物参与自噬体初期自噬体膜的形成[9];另外,Atg5在细胞内形成Atg12-Atg5复合物,能促使LC3-Ⅰ到LC3-Ⅱ的转变,对自噬体膜的延伸至关重要[10]。Q-PCR结果显示,过表达 ATZ细胞内自噬相关基因Atg5和Atg12的mRNA水平明显升高,而对Beclin1的mRNA水平无明显影响。因此我们猜测,过表达ATZ可能通过作用Atg5-Atg12复合物参与自噬体膜延伸环节而非自噬体膜初期形成阶段。另外,我们发现表达ATZ的细胞自噬活性的增加,但ATZ过度表达的细胞形态明显异常,核分叶、固缩、碎裂或消失,这与我们前期结果一致[11]。
综上所述,细胞自噬在过表达ATZ的细胞模型中可能发挥着双重作用;一方面,在早期阶段自噬的诱导加速了蛋白聚集体的清除,对细胞起保护作用;另一方面,蛋白聚集体因细胞自噬活性改变而不能有效降解,最终会导致细胞毒性。过表达ATZ可能通过影响Atg5-Atg12复合物影响自噬,至于确切的作用机制还需进一步的实验证实。
参考文献:
[1]Lomas D A,Mahadeva R.α1-antitrypsin polymerization and the serpinopathies:pathobiology and prospects for therapy[J].JClin Invest,2002,110(11):1585-90.
[2]Trapnell B C,Luisetti M.The parallel lives of alpha1-antitrypsin deficiency and pulmonary alveolar proteinosis[J].Orphanet J Rare Dis,2013,8(1):153.
[3]Rudnick D A,Perlmutter D H.Alpha-1-antitrypsin deficiency:A new paradigm for hepatocellular carcinoma in genetic liver disease[J].Hepatology,2005,42(3):514-21.
[4]Sumpter R Jr,Levine B.Selective autophagy and viruses[J].Autophagy,2011,7(3):260-5.
[5]Kamimoto T,Shoji S,Yoshimori T,etal.Intracellular inclusions containing mutantα1-antitrypsin Z are propagated in the absence of autophagic activity[J].JBiol Chem,2006,281(7):4467-76.
[6]Lomas D A,Evans D L,Finch JT,Carrell RW.Themechanism of Z alpha 1-antitrypsin accumulation in the liver[J].Nature,1992,357(6379):605-7.
[7]Levine B,Mizushima N,Virgin HW.Autophagy in immunity and inflammation[J].Nature,2011,469(7330):323-35.
[8]陈菊英,刘朝纯,朱邦豪,等.紫草素通过PI3K/Akt通路促进人乳腺癌MCF细胞自噬 [J].中国药理学通报,2013,29(2):194-8.
[8]Chen JY,Liu Z C,Zhu B H.Shikonin promotes autophagy of MCF-7 human breast cancer cells through PI3K/Akt pathway[J].Chin Pharmacol Bull,2013,29(2):194-8.
[9]Petiot A,Pattingre S,Codogno P,et al.Diversity of signaling controls ofmacroautophagy in mammalian cells[J].Cell Struct Funct,2002,27(6):431-41.
[10]Nontasut P,Singhasivanon V,Setasuban P,etal.Effectof singledose albendazole and singledosemebendazole on Necator americanus[J].Southeast Asian J Trop Med Public Health,1989,20(2):237-42.
[11]王海萍,王法财,沈玉先.GFP-ATZ在HEK 293T中的表达及其细胞毒作用[J].安徽医科大学学报,2010,45(6):733-4.
[11]Wang H P,Wang FC,Shen Y X.Eukaryotic expression of GFPATZ and its toxic effect to HEK 293T cells[J].Acta Univ Med Anhui,2010,45(6):733-4.

