淫羊藿苷通过降低醛固酮水平减轻自发性高血压大鼠肾间质纤维化
李叶丽,王颖婉,李意奇,张丽梅,龚其海,杨丹莉
高血压肾损害系由原发性或继发性高血压引起的肾脏疾病,其中肾间质纤维化是导致肾脏损伤的重要原因。醛固酮作为肾间质纤维化进程中的一个重要因素,已成为高血压肾损害研究的热点之一。最近研究表明,醛固酮可上调离体的肾小管上皮细胞促纤维化的细胞因子如Ⅲ型胶原、TGF-β1、CTGF、FN等的表达[1-4],加速肾间质纤维化的发生与发展。淫羊藿为小檗科淫羊属植物,具有温阳补肾、除风祛湿、强心益气等功效。ICA是淫羊藿的主要活性成分,现代药理学研究证明,ICA具有抗肿瘤、增强免疫、改善心脑血管功能、调节内分泌及抗骨质疏松等作用[5]。本研究拟观察 ICA是否具有抗SHR肾间质纤维化作用,及该效应是否与降低醛固酮水平,下调TGF-β1和Smad2的表达有关。
1 材料与方法
1.1 药品、试剂与仪器 淫羊藿苷购自南京泽朗医药有限公司;醛固酮试剂盒和Ⅲ型胶原试剂盒购自上海雅吉生物科技有限公司;RNA逆转录试剂盒、荧光混合物,β-actin、TGF-β1、Smad2、CTGF、FN的引物购自TaKaRa生物工程公司;RNA逆转录仪,德国Eppendorf公司;real time RT-PCR扩增仪,美国BIO-RAD公司;通用酶标仪,美国 BIO-RAD公司;Leica光学显微镜及照相系统,德国Leica Microsystems Ltd。
1.2 实验动物及分组 13周龄的♂ SHR大鼠14只、WKY大鼠7只,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。SHR大鼠随机分为两组,分别为模型组(n=7)和ICA组(n=7),WKY大鼠作为对照组。所有大鼠适应性饲养1周后,ICA组给予 ICA 40 mg·kg-1,ig,bid,至26周龄,模型组和对照组给予等量生理盐水。
1.3 肾脏病理学 给药14周后,7%水合氯醛(0.35 g·kg-1)经腹腔注射麻醉成功后,取各组大鼠肾脏组织,置于4%甲醛溶液中固定48 h后,分别进行HE和Masson染色,光镜下观察肾脏病理学变化。
1.4 血浆醛固酮和Ⅲ型胶原含量测定 腹主动脉取血2 ml,置于抗凝管中,离心后取上清,采用双抗体夹心法测定血浆醛固酮和Ⅲ型胶原含量。测定方法严格按照试剂盒说明书执行。
1.5 real time RT-PCR法检测肾脏组织中TGF-β1、Smad2、CTGF、FN mRNA的表达 取各组肾脏组织,置于1 ml TRIzol中,提取总RNA并检测其纯度后,经两步法逆转录-聚合酶链反应分别检测β-actin、TGF-β1、Smad2、CTGF、FN mRNA的表达。相关引物参照 GenBank中大鼠 β-actin、TGF-β1、Smad2、CTGF、FN mRNA的序列设计,见 Tab 1。目的基因表达相对定量法:以PCR扩增过程中荧光信号强度达到阈值所需的循环数(cycle threshold,Ct值)为统计参数,依次计算平均 Ct值 =(Ct1+Ct2)/2(重复管);dCt=平均 Ct值 -中间值;基因表达 =2-dCt;相对定量 =目的基因的表达/内参基因的表达×100,将空白对照组的mRNA表达量设定为100。
1.6 统计学分析 所有数据均采用SPSS 11.0统计分析软件进行处理,以¯x±s表示,组间比较采用方差分析,SNK法两两比较。
2 结果
2.1 肾脏病理学 HE和Masson染色均显示对照组肾小球、肾小管结构正常。与正常对照组比较,HE染色结果显示模型组肾小球囊腔狭窄且不规则,小球内系膜基质增多,细胞排列紊乱,Masson染色结果显示肾小管纤维增生,间质纤维化;与模型组比较,HE和Masson染色显示ICA组肾小球囊腔增宽,小球内系膜基质减少,细胞排列较为整齐,肾小管间质纤维化程度减轻,见Fig 1。
2.2 血浆醛固酮和Ⅲ型胶原含量 与正常对照组比较,模型组血浆醛固酮和Ⅲ型胶原含量均升高(P<0.01);与模型组比较,ICA组血浆醛固酮和Ⅲ型胶原含量均降低(P<0.01或 P<0.05),结果见Tab 2。
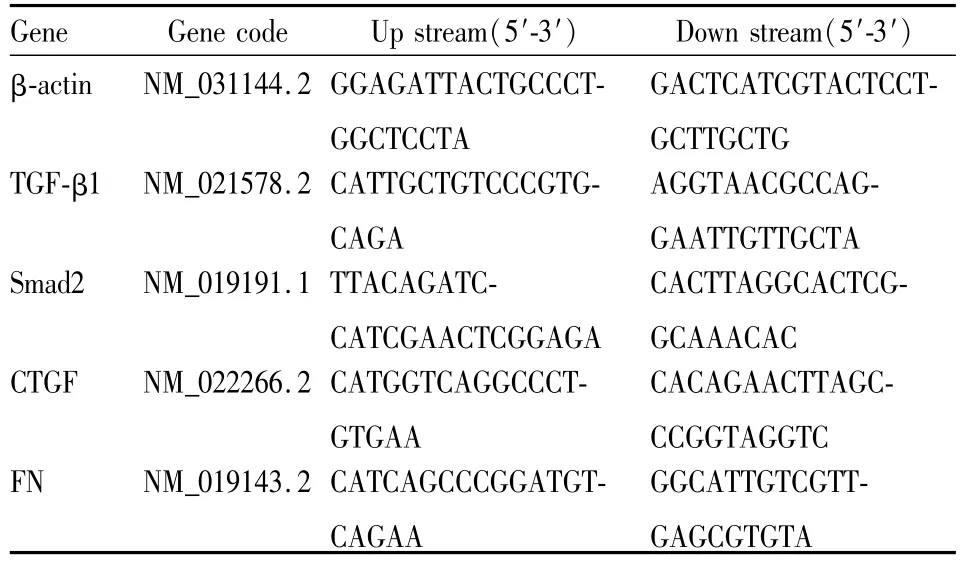
Tab 1 Primer pair of real time RT-PCR

Tab 2 Effects of ICA on plasma aldosterone and collagen typeⅢ(¯x±s,n=6)
2.3 肾脏组织中 TGF-β1、Smad2、CTGF、FN mRNA的表达 与正常对照组比较,模型组TGF-β1、Smad2、CTGF、FN mRNA的表达均明显上调(P<0.01或 P<0.05);与模型组比较,ICA组 TGF-β1、Smad2、CTGF、FN mRNA的表达均明显下调(P<0.01或P<0.05),结果见Fig 2。
3 讨论
肾间质纤维化是肾脏疾病发展和预后的重要因素,也是导致肾单位进行性损伤的病理机制,其本质是细胞外基质(extracellular matrix,ECM)异常沉积,ECM过度合成和降解受抑是ECM积聚的直接原因[6]。本研究结果显示,与正常对照组相比,模型组肾小球囊腔狭窄且不规则,肾小球内系膜基质增多,肾小管间质纤维化,提示模型组大鼠出现了明显的肾间质纤维化。另有研究表明[7],24周龄的自发性高血压大鼠出现了明显的肾间质纤维化。
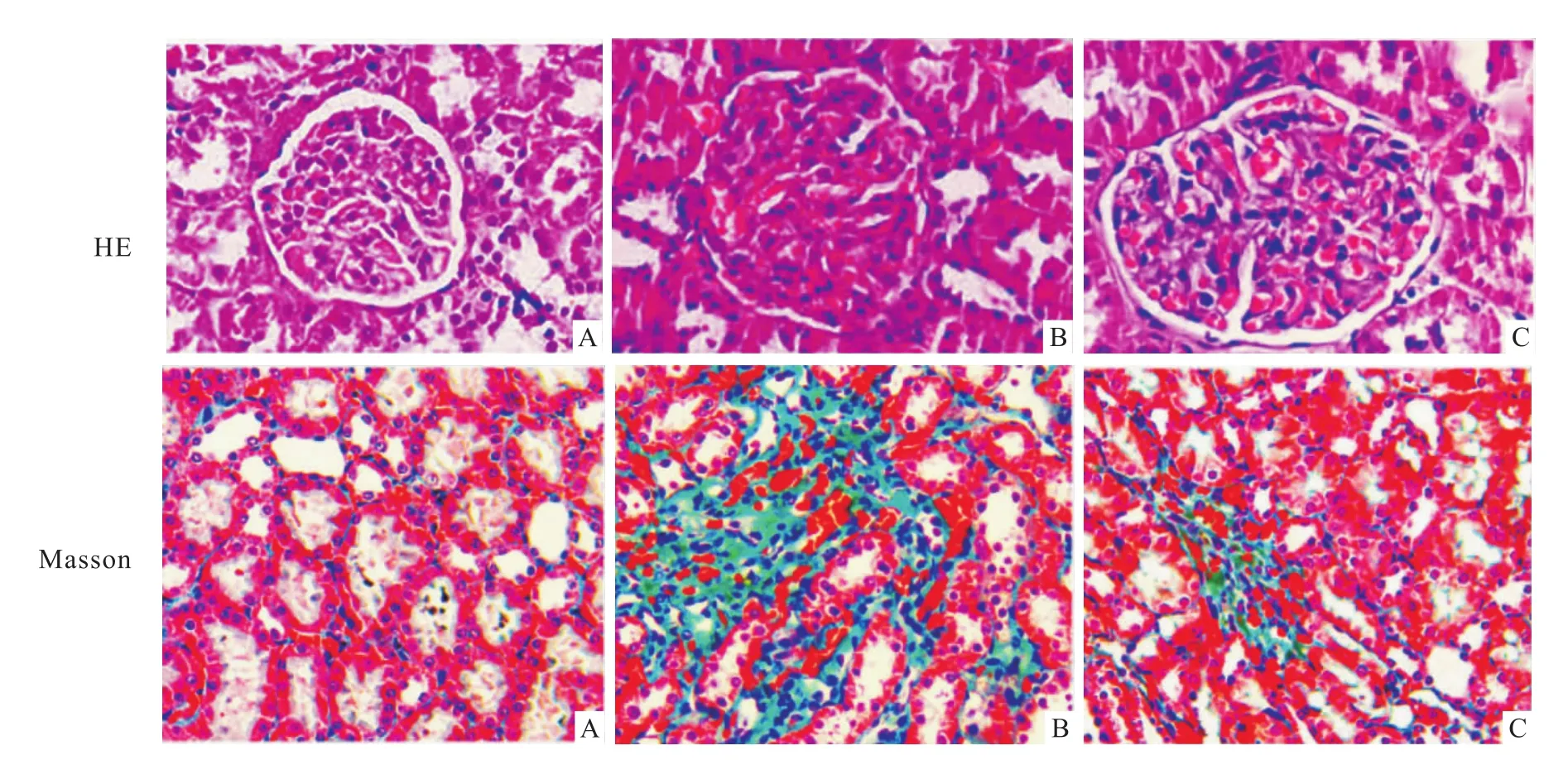
Fig 1 HE staining of kidney tissue(×400)and Masson staining of kidney tissue(×200)
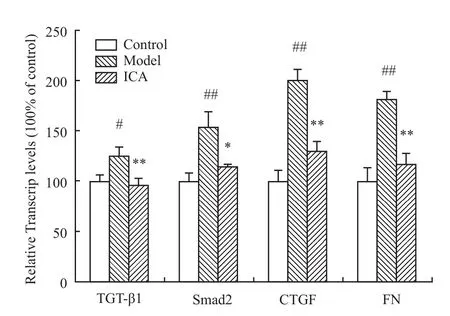
Fig 2 Effects of ICA on expressions of TGF-β1、Smad2、CTGF、FN mRNA in kidney tissue(¯x±s,n=6)
醛固酮可促进肾间质纤维化的发生[8-9],也可上调Ⅲ型胶原、TGF-β1、CTGF、FN等的表达[1-4]。最近研究表明,醛固酮可能通过调控基质金属蛋白酶1/金属蛋白酶1组织抑制剂(MMP-1/TIMP-1)的基因表达,使Ⅲ型胶原降解减少,ECM过度积聚[3];也可能通过促进 TGF-β1的表达诱导CTGF的表达[10],从而促进肾间质纤维化的发展。
TGF-β1是一种重要的促纤维化细胞因子,可参与成纤维细胞的增殖、分化与迁移,促进ECM的生成与沉积,抑制其降解[11]。TGF-β1/Smad2信号通路的过度激活,可导致肾脏ECM生成增多,直接或间接导致CTGF和FN的产生[12]。CTGF作为TGF-β1的下游,可促使TGF-β1发挥促增生和ECM合成等作用[13],也可在 TGF-β1诱导下参与成纤维细胞合成FN,使ECM在肾间质积聚,促进肾间质纤维化的发展。
与模型组相比,ICA组肾小球囊腔增宽,肾小球内系膜基质减少,细胞排列较为整齐,肾小管间质纤维化程度减轻,提示ICA可能具有抗SHR肾间质纤维化的作用。此外,ICA组血浆醛固酮、Ⅲ型胶原含量,以及 TGF-β1、Smad2、CTGF、FN mRNA的表达均明显低于模型组,提示ICA可能通过降低醛固酮水平,下调TGF-β1和Smad2的表达抗SHR肾间质纤维化。
参考文献:
[1] 罗 洋,芮宏亮,谌贻璞.ERK1/2丝裂原活化蛋白激酶对醛固酮促进肾小管上皮细胞合成转化生长因子β1的作用[J].中华医学杂志,2006,86(44):3133-7.
[1] Luo Y,Rui H L,Chen Y P.The role of MAPK/ERK1/2 signaling pathway in aldosterone stimulated transforming growth factor-beta1 synthesis in renal tubular epithelial cells[J].Zhonghua Med Magazine,2006,86(44):3133-7.
[2] 王 健,李晓东,王金华,郭志军.醛固酮对人近端肾小管上皮细胞结缔组织生长因子 mRNA表达的影响 [J].天津医药,2007,35(10):736-8.
[2] Wang J,Li X D,Wang JH,Guo Z J.Effect of aldosterone on expression of connective tissue growth factor in human proximal tubular epithelial cells[J].Tianjin Med J,2007,35(10):736-8.
[3] 孙东立,张林霞,李 颖,李晓东.醛固酮对人肾小管上皮细胞MMP-1/TIMP-1基因表达和合成分泌纤维连接蛋白的影响[J].中国现代医学杂志,2012,22(18):28-31.
[3] Sun D L,Zhang L X,Li Y,Li X D.Effects of aldosterone on gene expressions of MMP-1/TIMP-1 and secretion of fibronectin in cultured human renal tubular epithelial cells[J].China J Mod Med,2012,22(18):28-31.
[4] Xu G,Liu A,Liu X.Aldosterone induces collagen synthesis via activation of extracellular signal-regulated kinase 1 and 2 in renal proximal tubules[J].Nephrology(Carlton),2008,13(8):694-701.
[5] 龚其海,杨丹莉,石京山,等.淫羊藿苷的神经药理作用及分子机制研究进展[J].中国新药与临床杂志,2011,30(7):481-6.
[5] Gong Q H,Yang D L,Shi JS,et al.Advances in neuroharm-acological effects and molecular mechanisms of icariin[J].Chin J New Drugs Clin Rem,2011,30(7):481-6.
[6] Zeisberg M,Neilson E G.Mechanisms of tubulointerstitial fibrosis[J].J Am Soc Nephrol,2010,21(11):1819-34.
[7] 王敏莲,刘淑华,闫 晗,等.缬沙坦对自发性高血压大鼠肾间质纤维化及转化生长因子-β1表达的影响[J].武汉大学学报,2009,30(6):744-7.
[7] Wang M L,Liu SH,Yan H,et al.Effect of valsartan on renal interstitial fibrosis and expression of transforming growth factor-betal in spontaneously hypertensive rats[J].Med J Wuhan Univ,2009,30(6):744-7.
[8] Remuzzi G,Cattaneo D,Perico N.The aggravating mechanisms of aldosterone on kidney fibrosis[J].J Am SocN Ephrol,2008,19(8):1459-62.
[9] Brem A S,Morris DJ,Gong R.Aldosterone-induced fibrosis in the kidney:questions and controversies[J].Am J Kidney Dis,2011,58(3):471-9.
[10]赵俐丽,叶山东,徐 将,等.螺内酯对高糖及醛固酮诱导的肾小球系膜细胞CTGF表达的影响[J].中国药理学通报,2010,26(7):914-7.
[10]Zhao L L,Ye SD,Xu J,et al.Effects of spironolactone on aldosterone or high glucose induced CTGF mRNA and protein expression in the glomerular mesangial cells[J].Chin Pharmacol Bull,2010,26(7):914-7.
[11]张丽梅,杨 竞,李意奇,等.淫羊藿苷抑制 TGF-β1/Smad2信号通路改善压力超负荷所致的大鼠心肌纤维化[J].中国药理学通报,2013,29(10):1422-5.
[11]Zhang L M,Yang J,Li Y Q,et al.Anti-myocardial fibrosis activity of icariin in pressure overload rats through inhibition of TGF-β1/Smad2 signal pathway[J].Chin Pharmacol Bull,2013,29(10):1422-5.
[12]EI Mesallamy H O,Ahmed H H,Bassyouni A A,Ahmed A S.Clinical significance of inflammatory and fibrogenic cytokines in diabetic nephropathy[J].Clin Biochem,2012,45(9):646-50.
[13]敖 翔,李强翔,周巧玲.氯沙坦对自发性高血压大鼠肾脏结缔组织生长因子表达的调控[J].中华高血压杂志,2010,18(8):779-83.
[13]Ao X,Li Q X,Zhou Q L.Effects of losartan on expression of connective tissue growth factor in kidneys of spontaneously hypertensive rats[J].Chin J Hypertens,2010,18(8):779-83.

