四氢生物蝶呤在2型糖尿病肾病小鼠肾脏NO生成中的作用
汪建云,王栋栋,陆昭磊,朱 闯,张 帆,郭 昊,印晓星
糖尿病肾病(diabetic nephropathy,DN)是导致终末期肾病的常见病因之一,严重影响了糖尿病患者的生活质量。在DN的发生发展过程中,一氧化氮(nitric oxide,NO)发挥着重要的作用,直接参与了糖尿病早期肾小球高灌注和高滤过的形成,造成DN的多尿与蛋白尿[1-2]。我们前期的实验发现,高糖培养的肾小球系膜细胞诱导型一氧化氮合酶(induced nitric oxide synthase,iNOS)活性明显增高,进而引起NO增高[3]。四氢生物蝶呤(tetrahydrobiopterin,BH4)为NO合成的关键酶iNOS的必要辅因子,NO的生成与BH4的水平有着密切的联系。目前有关糖尿病肾病中BH4与NO及尿量、蛋白尿关系的研究,鲜见报道。
本研究采用BH4合成酶-Ⅰ型三磷酸鸟苷环化水解酶(guanosine triphosphate cyclohydrolase I,GTPCHⅠ)的抑制剂 2,4二氨基 6羟基嘧啶(DAHP),在国际上广为采用的先天性2型糖尿病所致的肾病模型(2型DN)db/db小鼠上,观察BH4对iNOS的蛋白表达、NO生成及血尿生化指标的影响,为2型DN的防治寻找新的靶点提供初步的实验依据。
1 材料与方法
1.1 材料 尿蛋白检测试剂盒、NOS活性检测试剂盒及血肌酐(Scr)检测试剂盒均购自南京建成生物工程研究所,总NO试剂盒及BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所,葡萄糖测定试剂购自上海荣盛生物药业有限公司。DAHP购自Sigma公司,兔多克隆抗iNOS抗体购自Abcam公司。
1.2 方法
1.2.1 动物分组及处置 12周龄自发性糖尿病C57BL/KSJdb/db小鼠及同周龄非糖尿病C57/KSJ db/m小鼠,由南京军区总医院从美国Jackson公司引进,自体繁殖成功后提供。收集小鼠24 h尿液,检测24 h尿蛋白,证实小鼠发生DN(db/db小鼠24 h尿蛋白含量明显高于db/m小鼠)。将成模的DN小鼠随机分为2组:DAHP治疗组(DAHP组,n=8),腹腔注射 DAHP150 mg·kg-1(溶于 5%DMSO生理盐水中);糖尿病肾病组(DN组,n=6),腹腔注射相同剂量的5%DMSO生理盐水。同周龄db/km小鼠为正常对照组(NS组,n=6),腹腔注射相同剂量的5%DMSO生理盐水。所用的动物实验按照徐州医学院伦理委员会准则操作。3组小鼠给药7 d,收集血液及24 h尿液,处死。迅速分离两侧肾脏,生理盐水冲洗后称重,去除髓质。取部分肾皮质以福尔马林固定,作iNOS的免疫组化测定。其余肾皮质置于-80℃冰箱内,备BH4、NO及iNOS蛋白的检测。
1.2.2 常规血尿生化指标测定 血糖采用葡萄糖氧化酶法检测;用代谢笼收集小鼠24 h尿量,24 h尿蛋白测定采用考马斯亮蓝法检测;血肌酐采用苦味酸法检测。所有指标均在Elx808IU酶标仪上检测(美国Bio-tex公司)。
1.2.3 Griess法检测肾皮质NO 将50 mg肾皮质用200μl的PBS匀浆处理,离心。根据Griess反应原理,取100μl离心液加入等量的Griess反应液,混匀,室温放置10 min,用酶标仪于540 nm处进行光密度测定,根据标准曲线换算NO浓度。
1.2.4 比色法检测肾皮质iNOS活性 将50 mg肾皮质用200μl的PBS匀浆处理,离心,取上清液。iNOS的活性不依赖钙,可催化L-精氨酸和分子氧反应生成NO,NO与亲核性物质生成有色化合物,在530 nm波长处测定其光密度值,即代表iNOS活性。具体操作参照NOS活性检测试剂盒说明进行。
1.2.5 免疫组化法检测iNOS蛋白 大鼠肾脏以10%中性福尔马林固定24 h后,石蜡包埋切片,常规二甲苯脱蜡,梯度酒精脱水,3%H2O237℃孵育10 min以灭活内源性过氧化物酶,0.01 mol·L-1枸橼酸缓冲液(pH 6.0)中煮沸15 min,以修复抗原,正常山羊血清工作液封闭2 h,滴加兔多克隆抗iNOS抗体(1∶200),4℃ 冰箱孵育过夜,用PBS缓冲液代替一抗作阴性对照。滴加辣根过氧化物酶标记山羊抗兔IgG二抗,DAB显色。
1.2.6 Western blot法测iNOS蛋白 取预处理的肾皮质细胞在冷提液中匀浆。以BCA法测定总蛋白浓度。取上样蛋白100μg,经8%的SDS-PAGE电转移蛋白至PVDF膜,5%脱脂奶粉封闭2 h。加兔多克隆抗iNOS抗体(1∶200),4℃过夜;TBST缓冲液洗膜后,加碱性磷酸酶标记的羊抗兔IgG二抗(1∶1 000)孵育2 h。滴加 BCIP/NBT显色液,避光显色15 min。以β-actin为内参,iNOS与β-actin的灰度比值代表iNOS的相对表达量。
1.2.7 HPLC法检测BH4将肾皮质组织在裂解液(50 mmol·L-1Tris-HCl,pH 7.4,1 mmol·L-1DTT,1 mmol·L-1EDTA)中匀浆、离心。取上清,BCA试剂盒检测蛋白含量。在上清中按照90μl裂解液中加入10μl 1.5 mol·L-1HClO4和2.0 mol·L-1H3PO4(1∶1)的比例处理析出蛋白,取上清分两部分处理。一部分在酸性条件下氧化:按90μl裂解液中加10μl 1% 碘液(2%KI配制)比例混匀,避光置于室温60 min,加入5μl新配制的抗坏血酸溶液(20 g·L-1),离心;一部分于碱性条件下氧化:按80μl裂解液中加入10μl NaOH,再加入10 μl碘液的比例混匀,避光置于室温60 min;加入20 μl H3PO4及5μl抗坏血酸溶液,离心。取两者的上清采用Zorbax SB-C18(4.6 mm×250 mm柱)反相高效液相色谱法分析(Shimadzu LC.10A高效液相色谱仪,日本岛津)。以甲醇/水混合液(5% ∶95%)作为流动相,1.0 ml·min-1恒速洗脱。通过荧光检测器(RF-10Ax)在荧光激发波长350 nm、发射波长450 nm处检测生物蝶呤的积分峰面积值,出峰时间6.0 min左右。该方法检测生物蝶呤灵敏度为152 ng·L-1。在酸性条件下氧化的标本检测出总生物蝶呤(biopterin)包括BH4、二氢生物喋呤和生物喋呤;在碱性条件下氧化的标本检测出二氢生物喋呤和生物喋呤;将二氢生物喋呤和生物喋呤从总生物蝶呤中除去,就是BH4含量。
1.3 统计学分析 数据均以¯x±s表示,采用SPSS 13.0统计软件处理。两组间比较采用t检验,多组间比较采用单因素方差分析(ANOVA)。
2 结果
2.1 小鼠各项生化指标 DN组及DAHP组小鼠血糖、24 h尿蛋白、24 h尿量、Scr明显高于NS组(P<0.05),表明db/db小鼠此时已进入DN阶段,DN模型建模成功。与DN组比较,DAHP组体重、24 h尿蛋白及尿量明显低于DN组(P<0.05),而Scr及血糖无明显降低(Tab 1)。

Tab 1 Biochemical characteristics of mice(¯x±s)
2.2 各组小鼠肾皮质中BH4水平 DN组的BH4水平明显高于 NS组,差异有统计学意义(P<0.05),表明糖尿病肾病时肾皮质中BH4水平增高;BH4合成酶抑制剂DAHP组的BH4水平明显低于DN组(P<0.01),表明DAHP能明显抑制糖尿病肾病时BH4的合成(Fig 1)。
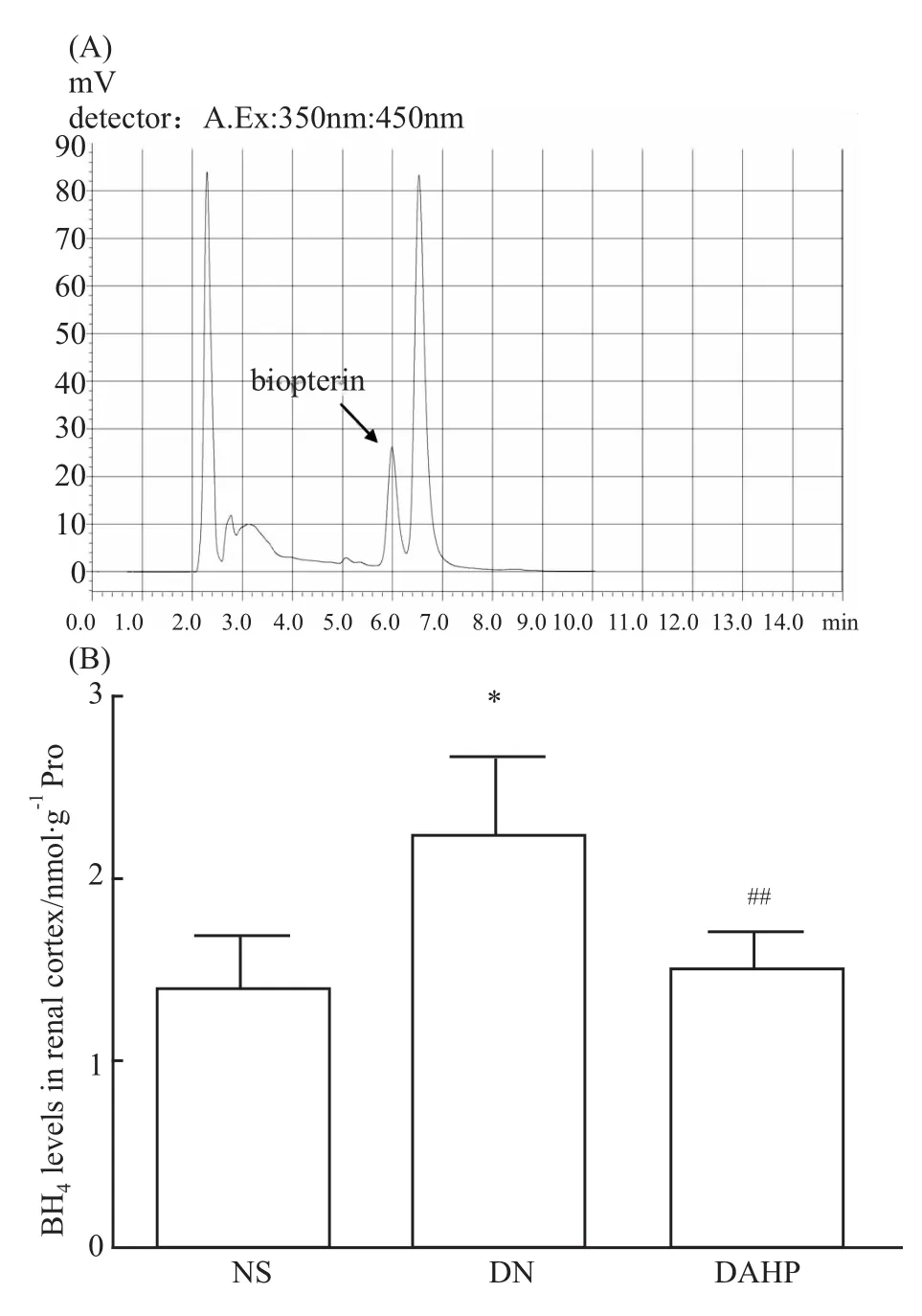
Fig 1 BH 4 levels in renal cortex of mice
2.3 小鼠肾皮质中iNOS蛋白表达 免疫组化法显示:肾小球iNOS蛋白位于肾细胞胞质中。NS组肾皮质中iNOS蛋白鲜有表达,DN肾病中iNOS蛋白染色密度较NS组明显加深,经过DAHP治疗后,DN小鼠的肾皮质中iNOS蛋白染色密度降低。Western blot结果显示:DN组的iNOS蛋白水平明显高于NS组,差异有统计学意义(P<0.01),DAHP组的iNOS水平明显低于DN组(P<0.05)(Fig 2)。表明DN小鼠肾皮质中iNOS蛋白表达增高;当BH4合成被抑制后,iNOS蛋白表达明显降低,即DN小鼠肾皮质iNOS的蛋白表达受BH4的调控。
2.4 小鼠肾皮质中iNOS活性 DN组小鼠肾皮质中iNOS活性明显高于NS组小鼠(P<0.05);DAHP组iNOS活性明显低于 DN组(P<0.01)(Fig 3)。表明DN小鼠肾皮质中iNOS活性明显增高,当BH4合成被抑制后,其活性明显降低。
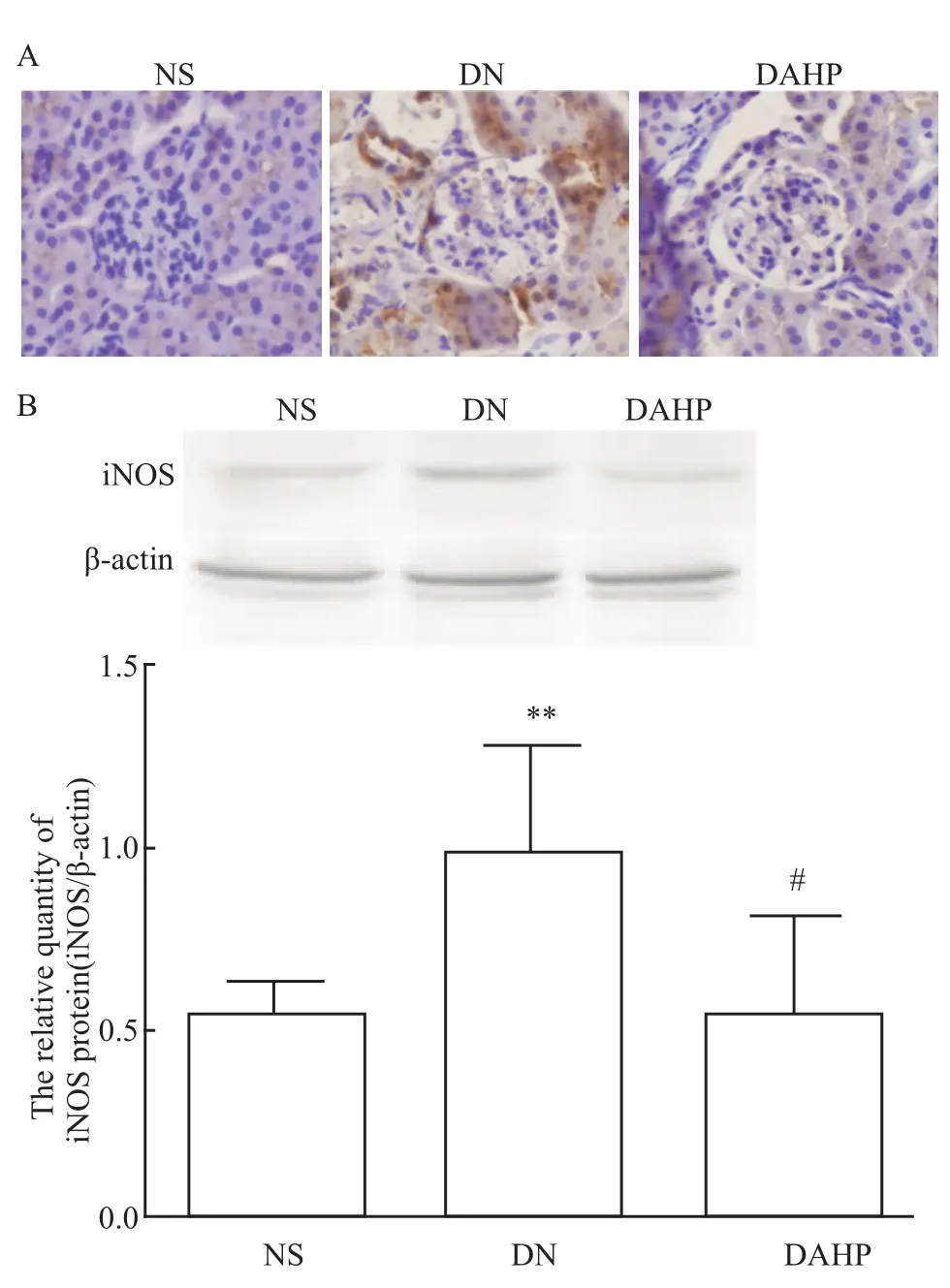
Fig 2 Expression of iNOS protein in renal cortex of mice
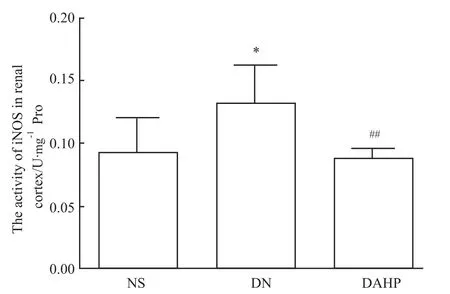
Fig 3 Activity of iNOS in renal cortex of mice
2.5 小鼠肾皮质中NO水平 DN组NO水平明显高于NS组,差异有统计学意义(P<0.05),DAHP组的NO水平明显低于DN组(P<0.05)(Fig 4)。表明DN小鼠肾皮质中NO水平明显增高;当BH4合成被抑制后,NO生成减少。
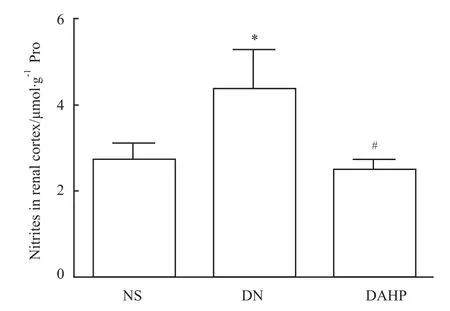
Fig 4 NO level in renal cortex of mice
3 讨论
糖尿病已经成为全球流行疾病,其中2型糖尿病占糖尿病总体人群的95%以上[4]。DN是2型糖尿病最常见的并发症,也是2型糖尿病患者的主要死亡原因之一。2型DN的发病机制非常复杂,至今尚未完全阐明。研究表明,长期的高血糖所致的细胞因子的表达失衡、氧化应激以及由此引起的肾脏血流动力学异常在2型DN病程中起着非常重要的作用。
NO是一种重要的生理、病理性因子,它可扩张血管,改变肾血流量、增加肾小球滤过率。目前国内外学者对NO在DN中的利弊作用说法不一[5-8]。但是有大量研究表明,NO的过量生成是DN肾小球高内压、高灌注、高滤过的主要原因,直接促进蛋白尿的产生,降低异常增高的NO的生成可有效减少尿蛋白的生成[7-8]。本研究也发现,DN小鼠肾皮质中NO水平明显增高,24 h尿量及尿蛋白也明显增加。因此有效降低NO很可能是防治DN肾损害的新的切入点。
NO由一氧化氮合酶(nitric oxide synthase,NOS)催化L-精氨酸而产生。NOS可分为两大类,一类是构成型一氧化氮合酶(constitutive NOS,cNOS),包括内皮型一氧化氮合酶(endothelial nitric oxide synthases,eNOS)和神经元型一氧化氮合酶(neuronal NOS,nNOS),其产生的基础NO主要参与正常的细胞内信号传递;另一类是诱导型一氧化氮合酶(inducible NOS,iNOS),只在细胞受到病理性刺激如微生物内外毒素、氧化应激、炎症介质(TNF-α、IL-1)等的伤害后才表达[9]。且 iNOS一旦表达,其活性将持续数小时,产生的NO是eNOS和nNOS的100~1 000倍。此时,异常增高的NO可造成组织损伤[10]。大量研究证实,DN肾皮质中eNOS蛋白表达明显降低[11-12]。以 eNOS基因缺陷引起的eNOS表达降低已成为目前DN动物模型之一[13-15]。而nNOS通常表达于神经组织中,在肾皮质中表达较少。因此,DN中异常增高的NO可能由iNOS的改变引起。为此,本研究检测了iNOS的蛋白表达及酶活性。结果显示:DN肾皮质中iNOS蛋白表达及酶活性明显增高,这可能是导致DN肾皮质中NO异常增高的主要原因。
BH4作为NO合成的关键酶iNOS的必要辅因子,具有稳定iNOS结构、增加L-精氨酸和iNOS结合力等作用。目前有关BH4的研究多数关注于其缺陷造成的内皮功能障碍,它的缺乏可产生多种疾病[16-18]。但是近年来有学者表明,BH4的异常增高可引起线粒体功能障碍,从而造成活性氧的恶性循环,组织损害作用更强[19]。很多疾病如白癜风、恶性贫血、神经退行性疾病等与BH4的异常增高密切相关[19-21]。在本研究中,我们发现2型DN小鼠肾皮质中BH4水平明显增高,iNOS表达明显增强。当采用GTPCHI(BH4合成的限速酶)抑制剂阻断BH4合成后,2型DN小鼠肾脏中iNOS及NO含量明显降低,这表明DN肾皮质中增高的BH4可能是造成iNOS表达增强的主要原因。因此,有效保持BH4平衡对机体微环境的维持是非常重要的。减少2型DN肾皮质中BH4的量可有效降低iNOS及NO的水平,进而降低尿量及尿蛋白。同时我们发现DAHP组体重较DN组明显下降,表明抑制BH4的合成可对2型DN的升高的体重有所改善。但是DAHP对血糖、肌酐没有影响,这将值得我们进一步探索其机制。
综上,在自发性2型DN小鼠肾脏中,BH4含量明显增加,进而可使iNOS蛋白表达及酶活性增加,从而导致NO生成增多,这与2型DN的多尿及蛋白尿密切相关。因此,BH4很可能是防治2型DN的治疗靶点之一,这值得我们进一步深入研究。
参考文献:
[1] Prabhakar SS.Role of nitric oxide in diabetic nephropathy[J].Semin Nephrol,2004,24(4):333-44.
[2] 刘慰华,杨 冰,陶 莎,等.复方交泰丸对糖尿病大鼠肾损伤的保护作用及其机制的研究[J].中国药理学通报,2007,23(4):559-60.
[2] Liu W H,Yang B,Tao S,et al.Protective effects of Jiaotai pill complex presicription on renal injury in diabetic rats[J].Chin Pharmacol Bull,2007,23(4):559-60.
[3] Zhai Y P,Lu Q,Liu Y W,et al.Over-production of nitric oxide by oxidative stress-induced activation of the TGF-beta1/PI3K/Akt pathway in mesangial cells cultured in high glucose[J].Acta Pharmacol Sin,2013,34(4):507-14.
[4] 潘长玉,金文胜.2型糖尿病流行病学 [J].中华内分泌代谢杂志,2005,21(5):5s1-5.
[4] Pan C Y,Jin W S.Epidemiology of type 2 diabetes mellitus[J].Chin J Endocrinol Met,2005,21(5):5s1-5.
[5] Mariee A D,Abd-Allah G M,El-Yamany M F.Renal oxidative stress and nitric oxide production in streptozotocin-induced diabetic nephropathy in rats:the possible modulatory effects of garlic(Allium sativum L.)[J].Biotechnol Appl Biochem,2009,52(3):227-32.
[6] Imanishi M,Okada N,Konishi Y,et al.Angiotensin II receptor blockade reduces salt sensitivity of blood pressure through restoration of renal nitric oxide synthesis in patients with diabetic nephropathy[J].J Renin Angiotensin Aldosterone Syst,2013,14(1):67-73.
[7] Arya A,Yadav H N,Sharma P L.Involvement of vascular endothelial nitric oxide synthase in development of experimental diabetic nephropathy in rats[J].Mol Cell Biochem,2011,354(1-2):57-66.
[8] Kuhad A,Chopra K.Attenuation of diabetic nephropathy by tocotrienol:involvement of NFkB ignalingpathway[J].Life Sci,2009,84(9-10):296-301.
[9] Levine D Z.Hyperfiltration,nitric oxide and diabetic nephropathy[J].Curr Hypertens Rep,2006,8(2):153-7.
[10]Soskic SS,Dobutovic B D,Sudar E M,et al.Regulation of Inducible Nitric Oxide Synthase(iNOS)and its Potential Role in Insulin Resistance,Diabetes and Heart Failure[J].Open Cardiovasc Med J,2011,5(1):153-63.
[11]Balakumar P,Chakkarwar V A,Krishan P,et al.Vascular endothelial dysfunction:a tug of war in diabetic nephropathy[J]?Biomed Pharmacother,2009,63(3):171-9.
[12]Li F,Wang C H,Wang JG,et al.Elevated tissue factor expression contributes to exacerbated diabetic nephropathy in mice lacking eNOSfed a high fat diet[J].J Thromb Haemost,2010,8(10):2122-32.
[13]Alpers C E,Hudkins K L.Mouse models of diabetic nephropathy[J].Curr Opin Nephrol Hypertens,2011,20(3):278-84.
[14]Nakagawa T.A new mouse model resembling human diabetic nephropathy:uncoupling of VEGF with eNOS as a novel pathogenic mechanism[J].Clin Nephrol,2009,71(2):103-9.
[15]Zhang M Z,Wang S,Yang S,et al.Role of blood pressure and the renin-angiotensin system in development of diabetic nephropathy(DN)in eNOS-/-db/db mice[J].Am J Physiol Renal Physiol,2012,302(4):F433-8.
[16]McNeill E,Channon K M.The role of tetrahydrobiopterin in inflammation and cardiovasculardisease[J].Thromb Haemost,2012,108(5):832-9.
[17]Fiege B,Blau N.Assessment of tetrahydrobiopterin(BH4)responsiveness in phenylketonuria[J].J Pediatr,2007,150(6):627-30.
[18]Welsh C,Enomoto M,Pan J,et al.Tetrahydrobiopterin deficiency induces gastroparesis in newborn mice[J].Am J Physiol Gastrointest Liver Physiol,2013,305(1):G47-7.
[19]Cardaci S,Filomeni G,Rotilio G,et al.p38MAPK/p53 signalling axis mediates neuronal apoptosis in response to tetrahydrobiopterin-induced oxidative stress and glucose uptake inhibition:implication for neurodegeneration[J].Biochem J,2010,430(3):439-51.
[20]Chavan B,Beazley W,Wood J M,et al.H(2)O(2)increases de novo synthesisof(6R)-L-erythro-5,6,7,8-tetrahydrobiopterin via GTPcyclohydrolase Iand its feedback regulatory protein in vitiligo[J].J Inherit Met Dis,2009,32(1):86-94.
[21]Deliconstantinos G,Villiotou V,Stavrides JC,et al.Nitric oxide and peroxynitrite production by human erythrocytes:a causative factor of toxic anemia in breast cancer patients[J].Anticancer Res,1995,15(4):1435-46.

