柿叶黄酮缓释片兔体内药动学及其生物等效性研究
陈 丽, 陈 君, 吴 钢, 梁宇红, 杨志杰, 伍善广*
(1. 广西科技大学医学院,广西 柳州 545005,2. 柳州市工人医院,广西 柳州 545005)
黄酮类化合物是柿叶的主要有效成分,具有保护心脑血管、保护肝脏、抗氧化、止血、降糖、抗菌等多种药理作用[1-7]。柿叶中黄酮类化合物有芦丁、黄芪苷、异槲皮素、山柰酚、槲皮素、金丝桃苷和杨梅树皮苷等[8]。脑心清片是以柿叶黄酮为主药的心脑血管疾病治疗药物,能显著增加冠脉和脑部血流量,改善心、脑组织的供血供氧状态,用于冠心病、心绞痛、脑动脉硬化和缺血性脑血管病等。但脑心清片需每日服用3次,每次2~4片,这使患者用药顺应性降低。本研究以柿叶黄酮为主药,壳聚糖为主要辅料试制了柿叶黄酮缓释片,并对其体外释放度进行了研究,研究表明自制缓释片质量稳定,体外药物释放机制符合Ritger-Peppas释药模型的Non-Fick扩散,在12 h内呈现良好的释药性能[9]。为验证缓释片体内缓释效果,本研究以芦丁为对照,建立兔血浆中柿叶黄酮测定的高效液相色谱法,对柿叶黄酮缓释片在兔体内的药动学进行初步研究。
1 材料
1.1 药品 柿叶黄酮(西安市天园生物制剂厂,批号 TY20120629,纯度80.3%);芦丁对照品(中国食品药品检定研究院,批号100080-200707,纯度92.5%);柿叶黄酮缓释片(自制,批号HS130109,每片含柿叶黄酮16 mg的缓释片);柿叶黄酮普通片(自制,批号PT130108,每片含柿叶黄酮8 mg的缓释片)。
1.2 试剂 甲醇(一级色谱纯,天津四友,批号120705);蒸馏水(屈臣氏蒸馏水,批号20130204);磷酸(分析纯,成都市科龙化工试剂厂,批号20120629);冰醋酸(分析纯,成都市科龙化工试剂厂,批号20120625)。
1.3 仪器 1260 Infinity 高效液相色谱仪(美国Agilent公司);TGL16M台式高速冷冻离心机(湖南凯达科学仪器有限公司);电子分析天平(塞多利斯科学仪器北京有限公司);TDP1.5T单冲压片机(上海力超电机厂);SB-3200DTDN超声波清洗机(宁波新芝生物科技股份有限公司);移液器(赛默飞世尔仪器有限公司);其它为常规仪器。
1.4 动物 健康雄性兔6只,体质量约2.5 kg,由广西医科大学实验动物中心(许可证号:SCXK桂2009-0002)。
2 方法与结果
2.1 兔血浆中芦丁的测定
2.1.1 色谱条件 岛津Cn-3色谱柱(250 mm×4.6 mm,5 μm);流动相甲醇-0.1%磷酸溶液(47∶53);进样量10 μL;体积流量0.8 mL/min;检测波长360 nm;柱温室温。
2.1.2 血浆样品的处理方法 精密量取经肝素抗凝的兔血浆100 μL至1.5 mL具盖离心管中,精密加入1 000 μL提取液(甲醇-冰醋酸为9∶1),混合后超声10 min,4 ℃下15 000 r/min离心10 min,取上清液过0.22 μm有机滤膜,滤液取10 μL注入高效液相色谱仪,记录色谱图。
2.1.3 芦丁对照溶液的制备 精密称取105 ℃下干燥至恒定质量的芦丁对照品0.005 4 g(纯度92.5%),置250 mL量瓶中,用少量甲醇超声溶解后,放冷,再用甲醇定容,摇匀,即得质量浓度为19.98 μg/mL的芦丁对照溶液。
2.1.4 芦丁标准曲线的绘制 精密量取经肝素抗凝的兔血浆100 μL至1.5 mL离心管,分别精密加入芦丁对照溶液10、50、100、200、300、500、700、1 000 μL,精密加入提取液至1.5 mL,使芦丁的血药质量浓度为0.133 2、0.666 0、1.332 0、2.664 0、3.996 0、6.660 0、9.324 0、13.320 0 μg/mL。混合后超声10 min,4 ℃下15 000 r/min离心10 min,取上清液过0.22 μm有机滤膜,滤液取10 μL注入高效液相色谱仪。以血浆芦丁质量浓度(μg/mL)为横坐标,对应峰面积为纵坐标,用最小二乘法进行线性回归,得标准曲线回归方程:Y=799.093 3X-0.039 9 (r=0.999 1),本方法质量浓度在0.133 2~13.320 0 μg/mL范围内线性关系良好。
2.1.5 回收率试验 取空白兔血浆100 μL,制备低、中、高3种血药质量浓度(0.666 0、6.660 0、13.320 0 μg/mL)的样品各5份,按“2.1.2”项下方法操作,记录样品峰面积(As)。与相同质量浓度的芦丁对照品溶液峰面积(Ar)进行比较,即回收率=As/Ar×100%。结果见表1。从表1可看出,低、中、高3种质量浓度的样品溶液回收率均>70%,相对标准差(RSD%)均<10%,符合生物样本分析要求。
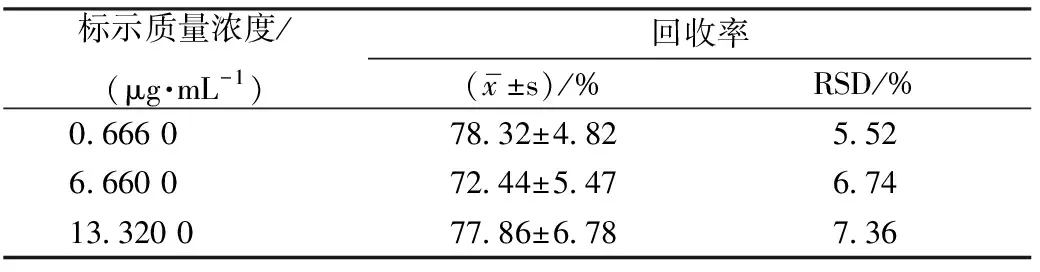
表1 回收率试验结果(n=5)
2.1.6 精密度试验 取空白兔血浆100 μL,制备低、中、高3种血药质量浓度(0.666 0、6.660 0、13.320 0 μg/mL)的样品各5份,按“2.1.2”项下方法操作,同一样品同日内连续进样5次及不同日连续5 d进样,计算日内和日间精密度。结果见表2,结果表明,样品在日内和日间RSD<10%,方法精密度良好。
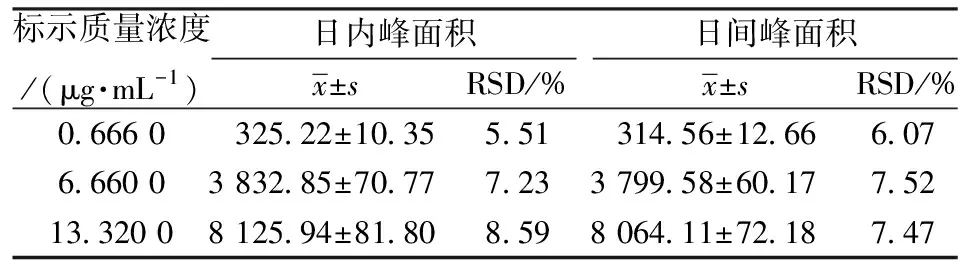
表2 精密度试验结果(n=5)
2.1.7 专属性试验 在所采用的色谱条件下,空白血浆、空白血浆加芦丁对照品、给药后兔血浆的色谱图见图1。从图1可知,柿叶黄酮中芦丁的峰形良好,基线平稳,血浆中内源性物质不干扰检测,对照品芦丁和柿叶黄酮中芦丁的保留时间一致,样品峰与杂质峰的分离度大于1.5,本法能准确测定血浆中柿叶黄酮芦丁的质量,灵敏度高。

图1 血浆中HPLC色谱图
2.2 柿叶黄酮缓释片在兔血浆中的药动学研究
2.2.1 给药方案及方法 健康兔6只,随机分为2组,按自身对照交叉实验进行。1组服用柿叶黄酮普通片,4片/只;另1组服用柿叶黄酮缓释片,2片/只。均整片药物塞入会厌部,使兔自动吞咽并灌入适量清水送下,经1周清洗期后交换。给药前禁食不禁水12 h,给药后6 h统一进食。
2.2.2 血样采集 2组均在给药前取空白血样,给药后0.5、1、2、3、4、5、6、8、10、12、16、24 h分别取静脉血,每次2 mL,离心分离出血浆后按“2.1.2”项下方法操作,所得峰面积代入标准曲线计算柿叶黄酮中芦丁含有量。平均血药浓度-时间曲线见图2。

图2 兔口服柿叶黄酮制剂后的平均药时-曲线
2.2.3 药动学参数的计算[10]将经时血药浓度数据用3P87药动学数据程序处理,对柿叶黄酮缓释片和普通片的血药质量浓度-时间数据进行拟合,以F检验的结果结合AIC最小作为模型选择的依据。药动学参数:Cmax、Tmax用实测值,AUC0→24、AUC0→∞、MRT用非房室模型统计矩法算得,以普通片为参比制剂,计算柿叶黄酮缓释片单剂量给药的相对生物利用度F%。以主要药动学参数AUC0→∞、Cmax、Tmax为指标评价柿叶黄酮缓释片与普通片的生物等效性:对AUC0→∞、Cmax进行方差分析,双单侧t检验和90%置信区间检验,用秩和检验对Tmax进行统计分析。兔单剂量口服柿叶黄酮制剂后的药动学参数见表3,药动学参数统计分析见表4。
结果表明:柿叶黄酮缓释片和普通片的体内过程均符合一级吸收一室模型特征,权重系数为1,药物吸收有延迟;缓释片的AUC0→24、AUC0→∞、Tmax、MRT比普通片显著增大,Cmax明显降低;方差分析说明,AUC0→∞和Cmax的个体间F、周期间F均小于F0.05,无显著性差异,但制剂间F大于F0.05,差异显著;双单侧t检验AUC0→∞、Cmax的T1,T2均小于t1-0.05(4);缓释片与普通片AUC0→∞、Cmax对数比值的90%置信区间分别为50.0%~59.9%和103.2%~134.5%,不在临界范围80%~125%和 70%~143%内,故柿叶黄酮缓释片与普通片具有生物不等效性。秩和检验统计量Z=-2.882,单侧概率P=0.002,说明缓释片与普通片之间的Tmax有显著差异,缓释片的Tmax明显延长。
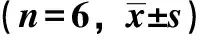
表3 兔口服柿叶黄酮制剂后的药动学参数

表4 药动学参数统计分析
3 讨论
柿叶总黄酮体外含量测定可采用紫外法[11],但体内影响因素多,紫外法不适合体内研究。目前发现的柿叶黄酮类化合物有黄芪苷、槲皮素、异槲皮素、芦丁、金丝桃苷等,已有学者以芦丁为对照用HPLC法检测体外柿叶黄酮[12],还有学者建立了HPLC法检测动物血浆中芦丁[13-15]的方法,我们在这些研究基础上进行多次试验,得到以芦丁为对照的HPLC法检测家兔血浆中柿叶黄酮的条件为用甲醇-冰醋酸(9∶1)作为蛋白沉淀剂,甲醇-0.1%磷酸溶液(47∶53)为流动相,检测波长为360 nm。本法血浆样品处理方法简单,灵敏,专属性高。
采用3P87药动学参数数据程序对经时血药浓度数据进行药动学模型拟合,拟合评价指标显示,柿叶黄酮缓释片在家兔体内的药动学模型符合一级吸收一室模型特征,药物吸收有延迟。缓释片峰浓度(Cmax)明显降低(P<0.01),达峰时间(Tmax)明显延长(P<0.01),平均滞留时间(MRT)显著延长(P<0.01),说明缓释片的骨架材料能改变总黄酮在体内的吸收、分布与代谢。柿叶黄酮缓释片采用壳聚糖和阿拉伯胶为混合骨架材料,壳聚糖和阿拉伯胶能在酸性介质中膨胀形成黏稠物使药物在胃肠道停留时间延长,有充分时间吸收,故而相对生物利用度F%明显提高,约为普通片的1.9倍。
AUC0→∞、Cmax、Tmax是制剂间生物等效性评价的主要药动学参数,因AUC0→∞、Cmax不呈正态分布,故先将其进行对数转换,才可进行方差分析。以AUC0→∞、Cmax为指标的方差分析、双单侧t检验和90%置信区间检验结果可知,缓释片与普通片在制剂间具有生物不等效性;以Tmax为指标的秩和检验结果表明,缓释片与普通片存在显著差异。
本研究结果证明,自制柿叶黄酮缓释片能在家兔体内达到较好的缓释效果,能降低峰浓度、延长药物在体内的滞留时间,减少血药质量浓度的峰谷波动,提高生物利用度,达到了缓释片的设计要求。
参考文献:
[1] 孙 懿,谭宏棣,蓝晓步,等.柿叶黄酮预处理对大鼠离体心脏缺血再灌注损伤的保护作用[J].济宁医学院学报,2009,32(1):9-10.
[2] 覃斐章,林 兴,张绪东,等.柿叶黄酮对L-NAME诱导的高血压大鼠血压的影响[J].现代中医药,2008,28(3):61-63.
[3] 张 艳.柿叶黄酮体外抗氧化活性及对小鼠急性肝损伤保护作用的研究[D].西安:陕西师范大学,2011:1.
[4] 宋常春,鲍庆胜.柿叶黄酮类化合物提取方法和抗氧化性的研究[J].食品与发酵工业,2004,30(9):117-119.
[5] 王树松,王晓风.柿叶止血成分的实验研究[J].河北中医,2005,7(1):66-67.
[6] 胡忠泽,杨久峰,谭志静.柿叶黄酮对糖尿病小鼠降血糖作用及机制探讨[J].营养学报,2006,28(6):540-541.
[7] 尹淑丽,张丽萍,梁 然,等.柿叶黄酮对BSD-2菌株芽胞数量及抑菌活性的影响[J].微生物学杂志,2010,30(6):49-51.
[8] 王 燕.柿叶中黄酮类化合物的研究进展[J].亚太传统医药,2011,7(4):173-174.
[9] 梁宇红,陈 丽,吴 钢,等.柿叶黄酮缓释片的制备及其释放度测定[J].中成药,2013,35(10):2134-2137.
[10] 梁文权.生物药剂学与药物动力学[M].北京:人民卫生出版社,2004:328-335.
[11] 罗昱澜.柿叶中总黄酮的含量测定[J].华夏医学,2008,21(3):433-434.
[12] 赵晓莉.柿叶黄酮类化合物提取分离研究[D].陕西西安:西北工业大学,2005.
[13] 杨子华.HPLC法检测大鼠血浆中芦丁浓度及其药物动力学[J].中国药师,2012,15(6):853-855.
[14] 汤 洁,王 剑,沈丽杰.小鼠血浆及组织中芦丁和槲皮素HPLC检测方法的建立[J].沈阳药科大学学报,2000,17(增刊):49-50.
[15] 许 良,毕开顺.大鼠血浆中芦丁和槲皮素的RP-HPLC同时分析方法[J].内蒙古民族大学学报:自然科学版,2006,21(1):10-13.