伊曲康唑纳米乳的制备及含量测定
高 瑞,欧阳五庆
(西北农林科技大学 动物医学院,陕西 杨凌 712100)
伊曲康唑(Itraconazole,ITZ),是一种广谱的三唑类抗真菌药物[1-2],其耐受性好,亲脂性强,极难溶于水[3]。ITZ通过抑制真菌细胞膜的重要成分之一麦角固醇的合成来发挥抗真菌作用[4],而且ITZ对真菌细胞色素P450酶系统的亲和力强于对动物细胞色素P450酶系统的亲和力,故其毒性较低[5]。此外,ITZ在皮肤内的药物代谢比较特殊,主要通过皮脂转运,从而使得皮肤内的药物浓度明显高于血液,因此适用于皮肤真菌病的治疗。目前用于临床的ITZ制剂主要有口服溶液剂、胶囊和注射液等,但它们具有蓄积毒性大或生物利用度不稳定等缺点[6-8]。
已有报道,许多香精油有抗真菌的作用[9-10]。肉桂醛(Cinnamaldehyde)作为肉桂香精油的重要成分之一,天然存在于樟树的树皮及叶子中[11],其对细菌(包括革兰氏阳性菌和革兰氏阴性菌)和真菌(如酵母、丝状霉菌、皮肤癣菌)均有抑杀作用[12],此外还具有消毒、防腐、抗氧化等功能[13-14],它难溶于水,易氧化、易挥发。
纳米乳(Nanoemulsion)是一种纳米级别的胶体分散体系,由于可以用来包封、保护以及传递亲脂性药物或生物活性物质,近年来被广泛应用于食品和制药行业,例如保健品、药品、维生素、抗菌剂、抗氧化剂等[15-21]。纳米乳由油、水、表面活性剂组成,粒径通常小于100 nm,从而增强了其稳定性[20],增加了澄明度[19,21-23],提高了生物利用度[18,23]。水包油(O/W)型纳米乳是其类型之一。制备纳米乳时,所用辅料一般具有良好的生物相容性,毒副作用小,以保证制得的纳米乳安全可靠[24]。
本研究将ITZ制备成纳米乳制剂,考察了伊曲康唑纳米乳的理化性质,并建立了一种精确的伊曲康唑纳米乳中伊曲康唑含量的测定方法,以期为临床提供一种治疗真菌感染的广谱、高效、安全、稳定的水包油型纳米乳药物。
1 材料与方法
1.1 主要药品
伊曲康唑,西安博昌生物科技有限公司;肉桂醛,吉安市国光香料厂。
1.2 伊曲康唑纳米乳的制备
1.2.1 混合油相的筛选 ITZ极难溶于水,但可溶于油相。待选油相有:有机类油相(乙酸乙酯、三乙酸甘油酯、乙酸丁酯)、中药油类油相(肉桂醛)。将溶解度相对较好的有机类油相与肉桂醛按质量比 2∶1,1∶1,1∶2分3组混匀,分别测定其对ITZ的溶解度,选择溶解度较大的组合作为混合油相。
1.2.2 表面活性剂的筛选 本试验待选表面活性剂有EL-40、RH-40、吐温-80。将这3种表面活性剂与筛选出的混合油相,在室温下分别按质量比 9.5∶0.5,9∶1,8.5∶1.5,8∶2,7.5∶2.5,7∶3,6∶4,5∶5,4∶6,3∶7,2∶8和1∶9混合。混匀后,边搅拌边滴加蒸馏水,滴加速度为0.5 mL/min,搅拌速度为500 r/min。随着滴加过程的进行,体系会先由稀变黏而后再由黏变稀,准确记录由黏变稀时的用水量。利用Origin Pro 7.5 软件绘制伪三元相图,根据形成的乳区大小确定表面活性剂的种类。
1.2.3 助表面活性剂的筛选 预试验发现,短链醇类助表面活性剂对ITZ的溶解性较好,为增大载药量,在室温下,选择对ITZ有较好溶解性的短链醇作为助表面活性剂。本试验从1,3-丁二醇、异丙醇和1,2-丙二醇中选择。分别将3种助表面活性剂与ITZ、筛选出的混合油相、表面活性剂以及水按一定配比制成纳米乳,60 ℃水浴30 min后考察其稳定性,以此确定最终的助表面活性剂。
1.2.4 表面活性剂与助表面活性剂质量比(Km)的确定 室温下,将筛选好的表面活性剂与助表面活性剂分别按质量比4∶1,3∶1,2∶1混匀,然后与筛选出的混合油相分别按质量比9.5∶0.5,9∶1,8.5∶1.5,8∶2,7.5∶2.5,7∶3,6∶4,5∶5,4∶6,3∶7,2∶8和1∶9混匀,之后重复1.2.2中滴加蒸馏水的步骤,最后准确记录用水量。分别以水相、油相、表面活性剂/助表面活性剂(Km)作为3个顶点,利用Origin Pro 7.5软件绘制伪三元相图,根据形成的乳区大小确定Km值。
1.2.5 伊曲康唑纳米乳配方的确定 室温下,先将ITZ按配方量加入筛选好的混和油相中,搅拌直到完全溶解;随后,分别加入表面活性剂、助表面活性剂,搅拌混匀;最后,边搅拌边滴加蒸馏水,速度为0.5 mL/min,搅拌速度为500 r/min,即可制备出澄明透亮的伊曲康唑纳米乳。
1.3 伊曲康唑纳米乳结构类型的鉴别
用染色法判断纳米乳的类型。将油溶性苏丹红和水溶性次甲基蓝分别滴到所制备的伊曲康唑纳米乳中,观察2种染色液的扩散速度,以此来判断所制备纳米乳的结构类型。若蓝色的次甲基蓝扩散速度大于红色的苏丹红,则为水包油(O/W)型纳米乳;反之,则为油包水(W/O)型纳米乳[25]。
1.4 伊曲康唑纳米乳的形态观察及粒径分布
取伊曲康唑纳米乳适量,稀释15倍,加2滴左右的分散剂(体积分数5%甘油),用超声波(33 Hz、50 W)振荡处理0.5 h。然后分成2份,1份滴加在有Formvar膜的铜网上,用质量分数为2.0%的磷钨酸负染150 s,自然干燥后,在透射电子显微镜下观察纳米乳的形态;另1份用激光粒度分析仪测定其平均粒径和多分散系数(Polydispersity index,PDI)。
1.5 伊曲康唑纳米乳的稳定性考察
1.5.1 加速试验 取适量伊曲康唑纳米乳,置于离心管中,在4 500 r/min条件下离心45 min,考察其外观。 取伊曲康唑纳米乳适量,密封于棕色玻璃瓶内,于相对湿度75%,温度分别为-4,25,40,60 ℃条件下保存,并分别于5和10 d后取样,观察其外观是否发生相分离。
1.5.2 光照试验 常温下,将适量伊曲康唑纳米乳密封于透明的西林瓶内,于(4 500±500) lx光照强度条件下,分别放置0,5,10 d,观察其外观形状。
1.6 伊曲康唑纳米乳中伊曲康唑含量的测定
1.6.1 检测波长的确定以及方法专属性的考察 准确称取0.05 g伊曲康唑,用适量甲醇完全溶解,之后定容到50 mL容量瓶中,配制成1 mg/mL的伊曲康唑甲醇溶液。取适量该溶液稀释成终质量浓度为0.2 mg/mL的溶液,此为样品1。按照1.2.5中的方法制备载药纳米乳以及空白纳米乳(配方中无伊曲康唑,其余同载药纳米乳),分别取适量,均稀释3 000倍,得到样品2和样品3。将上述3种样品分别在200~500 nm的波长进行紫外扫描。
1.6.2 标准曲线的建立 分别取0.25,0.5,1.0,1.5,2.0,2.5和3.0 mL质量浓度为1 mg/mL的伊曲康唑甲醇溶液,用甲醇定容到5 mL,摇匀,得到 0.05,0.1,0.2,0.3,0.4,0.5和0.6 mg/mL的伊曲康唑甲醇溶液,以甲醇作为空白对照,在检测波长261 nm处分别测定其吸光度。以伊曲康唑甲醇溶液的质量浓度为横坐标,吸光度为纵坐标,建立标准曲线,并求出回归方程与相关系数。
1.6.3 回收率的测定 分别向空白纳米乳中加入处方量(1 mg/mL)80%,100%和120%的伊曲康唑,经过适当稀释后,得到高(0.6 mg/mL)、中(0.5 mg/mL)、低(0.4 mg/mL)3种待测样品。在261 nm处进行紫外扫描,每个处理做3个平行,记录吸光度,求出实际质量浓度。利用求出的回归方程计算回收率、平均回收率和相对标准偏差(RSD),以考察检测方法的准确度。
1.6.4 日内和日间精密度的测定 分别于同一天内的0,1,5,10,24 h时,取样检测0.4,0.5,0.6 mg/mL 待测样品在261 nm处的吸光度,以评价日内精密度;再分别在一周内的0,1,3,5,7 d时,取样检测 0.4,0.5,0.6 mg/mL待测样品在261 nm处的吸光度,共测5次,以评价日间精密度。
2 结果与分析
2.1 伊曲康唑纳米乳的制备
2.1.1 混合油相的筛选 试验结果表明,室温下伊曲康唑在乙酸乙酯、三乙酸甘油酯、乙酸丁酯中的溶解度分别为0.7,0.6,0.5 g。故选择溶解度较大的乙酸乙酯与肉桂醛按质量比2∶1,1∶1,1∶2分3组混匀,室温下测得其对ITZ的溶解度分别为8.5,13.5,10.3 g。故选择乙酸乙酯与肉桂醛质量比1∶1为混合油相。
2.1.2 表面活性剂的筛选 利用Origin Pro 7.5软件绘制伪三元相图筛选表面活性剂,结果见图1。由图1可知,EL-40、RH-40、吐温-80 3种表面活性剂在一定配比范围内均可形成澄明透亮的纳米乳,且以EL-40为表面活性剂时,画出的乳区(图中的黑色部分)最大,故选择EL-40为制备伊曲康唑纳米乳的表面活性剂。

图 1 表面活性剂对伊曲康唑纳米乳制备的影响
2.1.3 助表面活性剂的筛选 预试验表明,室温条件下ITZ在异丙醇中的溶解度大于在1,3-丁二醇和1,2-丙二醇2种醇类中的溶解度。室温下,3种助表面活性剂在一定配比范围内均可形成澄明透亮的纳米乳,但经过30 min、 60 ℃水浴加热后,由1,3-丁二醇和1,2-丙二醇作为助表面活性剂的纳米乳变为乳白色,而由异丙醇作为助表面活性剂的纳米乳仍然澄明透亮。故选择异丙醇作为制备伊曲康唑纳米乳的助表面活性剂。
2.1.4 表面活性剂与助表面活性剂质量比(Km)的确定 以乙酸乙酯/肉桂醛为混合油相、EL-40为表面活性剂、异丙醇为助表面活性剂,利用Origin Pro 7.5软件绘制伪三元相图以确定Km值,结果见图2。由图2可知,当Km=2∶1时,形成的乳区(黑色部分)最大,故Km值确定为2∶1,即EL-40与异丙醇的最佳质量比为2∶1。

图 2 不同Km值对伊曲康唑纳米乳制备的影响
2.1.5 伊曲康唑纳米乳配方的确定 伊曲康唑纳米乳的配方确定为:伊曲康唑1.24%,肉桂醛 4.58%,乙酸乙酯4.58%,EL-40 24.44%,异丙醇12.17%,蒸馏水52.99%,以上均为质量分数。按该配方制备的伊曲康唑纳米乳澄明透亮,稀释后具纳米乳特有的淡蓝色乳光。
2.2 伊曲康唑纳米乳的质量评价
2.2.1 伊曲康唑纳米乳结构类型的鉴别 分别滴加苏丹红和次甲基蓝于2份制备好的伊曲康唑纳米乳样品中,结果发现,水溶性的次甲基蓝在纳米乳样品中迅速向四周扩散,而油溶性的苏丹红仅在纳米乳样品表面呈分层现象,次甲基蓝在该纳米乳中扩散速度明显快于苏丹红,表明该纳米乳是水包油(O/W)型纳米乳。
2.2.2 伊曲康唑纳米乳的形态观察以及粒径分布 透射电镜下观察到,制备的伊曲康唑纳米乳乳滴呈圆球形,大小均一,分布均匀,分散性良好,无粘连(图3)。粒度分析仪测定结果(图4)显示,伊曲康唑纳米乳的平均粒径为14.48 nm,多分散系数(PDI)为0.014,粒径在1~25 nm的占100%。
2.2.3 伊曲康唑纳米乳的稳定性 在加速试验中,各伊曲康唑纳米乳样品均保持外观澄明均一,未发生相分离、絮凝或药物析出等变浑浊的现象,说明所制备的纳米乳稳定性良好,耐储存。在光照试验中,该纳米乳于(4 500±500) lx光照强度、常温条件下分别放置0,5,10 d后外观仍然保持淡黄色澄清透明,未出现分层、絮凝或药物析出等现象,这表明该纳米乳制剂对光照不敏感,对储放条件的要求不高。

图 3 伊曲康唑纳米乳的透射电镜观察结果
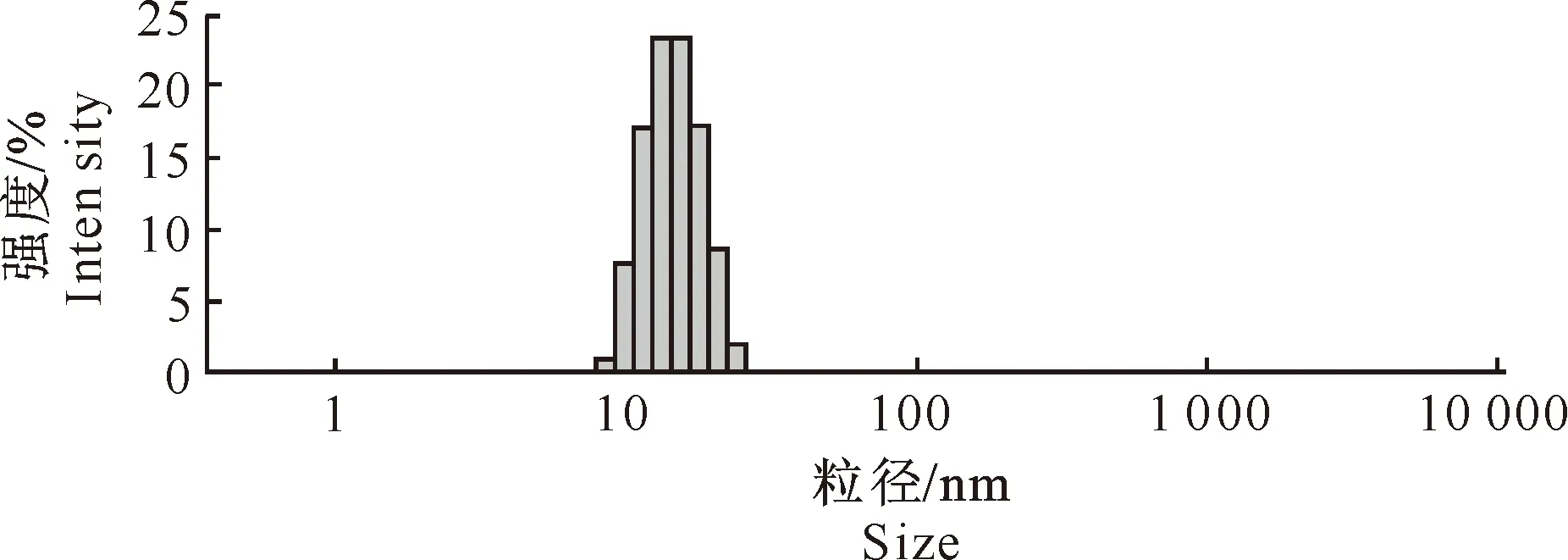
图 4 伊曲康唑纳米乳的粒径分布
2.3 伊曲康唑纳米乳中伊曲康唑含量的测定
2.3.1 检测波长的确定 稀释的伊曲康唑溶液(样品1)、伊曲康唑纳米乳(样品2)、空白纳米乳(样品3)在200~500 nm进行紫外扫描,结果见图5。由图5可见,伊曲康唑溶液的UV图显示双峰,表示ITZ在261和266 nm 2个波长处均有吸收。空白纳米乳在284,224和220 nm处有不同强度的吸收,为减少干扰,选择261 nm为检测波长。伊曲康唑纳米乳在284,266,261和213 nm处有紫外吸收。综合分析认为,检测波长选择261 nm时,纳米乳的各辅料(即空白纳米乳)对于测定伊曲康唑纳米乳中伊曲康唑含量无干扰,且该方法专属性良好。

图 5 伊曲康唑纳米乳中伊曲康唑含量测定的波长选择
2.3.2 标准曲线的建立 绘制的伊曲康唑溶液标准曲线见图6,所得方程为y=2.135 2x+0.054 9,相关系数R2=0.999 7。该结果显示,伊曲康唑标准液质量浓度为0.05~0.6 mg/mL时,其质量浓度与吸光度呈良好的线性关系。
2.3.3 回收率的测定 用空白纳米乳制备0.6,0.5,0.4 mg/mL伊曲康唑样品,检测结果(表1)表明,该伊曲康唑纳米乳的平均回收率是101.83%,相对标准偏差(RSD)是0.590 1%。说明所用检测方法的回收率高、准确性好,纳米乳中辅料(除伊曲康唑外的其他成分)对于伊曲康唑的测定干扰极小。
2.3.4 日内和日间精密度的测定 0.4,0.5,0.6 mg/mL 3个待测样品日内和日间精密度的平均相对标准偏差分别为0.619 2%和0.832%。表明所用检测方法精密度高,重现性好。
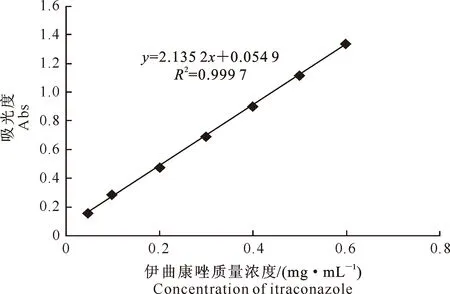
图 6 伊曲康唑纳米乳中伊曲康唑含量测定的标准曲线

表 1 伊曲康唑纳米乳回收率的测定
3 讨 论
纳米乳通常由水相、油相、表面活性剂和助表面活性剂组成。将药物溶解于油相中,制成O/W型纳米乳,可以增加水溶性较差药物的溶解度,提高制剂载药量。此外,在形成的纳米乳乳滴中,溶解有药物的油相包裹于内核中,可以保护药物,提高其稳定性。而将制备好的纳米乳通过皮肤给药时,可以产生较高的渗透浓度梯度,皮肤药物透过量较传统乳剂明显提高,Kreilgaard等[26]的研究证明了这一点。纳米乳配方中组分及它们之间比例的确定对于纳米乳的形成以及稳定性有决定作用。若组分和比例恰当,则制备的纳米乳澄清透明,且稳定性好;若组分不恰当,则不能形成纳米乳或者形成的纳米乳稳定性极差。本研究首先对油相进行了筛选,通过预试验发现,待选油相单独对伊曲康唑的溶解度均不理想,故考虑使用混合油相,将溶解度相对较好的乙酸乙酯与中药油肉桂醛按照设计好的不同质量比混合,发现当质量比为1∶1时,其溶解度较单一的油相有很大提高。肉桂醛作为混合油相中的一种,既可以与乙酸乙酯协同增加伊曲康唑的溶解度,又可以与伊曲康唑协同增强抗真菌效果。在确定表面活性剂和Km值时,均以伪三元相图中乳区最大为依据对配方进行优选,使最终确定的配方组分以及它们之间的质量比为最优。经过筛选,确定各组分(质量分数)为:伊曲康唑1.24%,肉桂醛4.58%,乙酸乙酯4.58%,EL-40 24.44%,异丙醇12.17%,蒸馏水52.99%,按此配方制备好的伊曲康唑纳米乳在透射电镜下呈圆球形且分散均一,其粒径极小,且分布范围狭窄,故形成的微小乳滴会加强药物的透皮作用,促进透皮吸收[27],从而增加药物的疗效,提高药物的生物利用度。用建立的紫外分光光度法测定伊曲康唑含量简单实用,精密度高。
综上所述,本试验成功制备了水包油(O/W)型伊曲康唑纳米乳,制备工艺简单、耗能低,含量测定方法精确有效,便于工业化生产,为临床上伊曲康唑外用制剂新剂型的制备提供了理论依据。
[参考文献]
[1] Saag S M,Dismukes W E.Azole antifungal agents: Emphasis on new triazoles [J].Antimicrob Agents Chemother,1988,32(1):1-8.
[2] Odds F C,Oris M,Dorsselaer P V,et al.Activities of an intravenous formulation of itraconazole in experimental disseminated Aspergillus,Candida,and Cryptococcus infections [J].Antimicrob Agents Chemother,2000,44(11):3180-3183.
[3] Fromtling R A.Recent trends in the discovery,development and evaluation of antifungal agents [M].Barcelona,Spain:J R Prous Science Publishers,1987:233-249.
[4] 王爱平,李若瑜.伊曲康唑胶囊上市16周年安全性资料回顾 [J].中国真菌学杂志,2010,5(1):40-43.
Wang A P,Li R Y.Safety data review of itraconazole capsule in 16 years [J].Chinese Journal of Mycology,2010,5(1):40-43.(in Chinese)
[5] 王 进,肖永红.伊曲康唑的药理作用和临床应用 [J].中国实用内科杂志,2006(3):387-388.
Wang J,Xiao Y H.Pharmacological effect and clinical application of itraconazole [J].Chinese Journal of Practical Internal Medicine,2006(3):387-388.(in Chinese)
[6] 李 飞.伊曲康唑凝胶剂的研制 [D].沈阳:沈阳药科大学,2004.
Li F.Studies on gels of the itraconazole inclusion [D].Shen-yang:Shenyang Pharmaceutical University,2004.(in Chinese)
[7] Verreck G,Six K,Denmooter G V,et al.Characterization of so-lid dispersions of itraconazole and hydroxypropyl methylcellulose prepared by melt extrusion:Part Ⅰ [J].International Journal of Pharmaceutics,2003,251(1/2):165-174.
[8] 陈江飞,苗彩云,朱素燕,等.抗真菌药伊曲康唑的临床药理学研究进展 [J].临床药理学杂志,2009,25(2):153-157.
Chen J F,Miao C Y,Zhu S Y,et al.Advance in search for clinical pharmacology on antifugal drug of itraconazole [J].Chin J Clin Pharmacol,2009,25(2):153-157.(in Chinese)
[9] 莫小路,王玉生,曾庆钱,等.几种药用植物精油的抗真菌活性研究 [J].天然产物研究与开发,2005,17(6):696-699.
Mo X L,Wang Y S,Zeng Q Q,et al.Antifungal activity study of several essential oils [J].Natural Product Research and Dvelepment,2005,17(6):696-699.(in Chinese)
[10] 姚 元.3种芳香植物单方及其复方精油的成分分析及抗真菌作用 [D].乌鲁木齐:新疆农业大学,2012.
Yao Y.Study on the antifungal effects of three individual essential oils and their given mixtures [D].Urumqi:Xinjiang Agricultural University,2012.(in Chinese)
[11] Cheng S S,Liu J Y,Chang E H.Antifungal activity of cinnamaldehyde and eugenol congeners against wood-rot fungi [J].Bioresource Technology,2008,99(11):5145-5149.
[12] Linda S M O,Li Y L,Kam S L,et al.Antimicrobial activities of cinnamon oil and cinnamaldehyde from the Chinese medicinal herb cinnamomum cassia blume [J].The American Journal of Chinese Medicine,2006,34(3):511-522.
[13] Zhou Y,Tao J D,Zhang J J.Study on antifungal role by Listea Cubeba and its primary component:The citral [J].Chin J Integrated Tradit Chin West Med,1984,4(9):558-559.
[14] Zhang W J.Ultra structure observation ofAspergillusflavusand anti-A.flavuseffect of cinnamaldehyde [J].J Beijing Med Univ,1995,27(5):374.
[15] Huang Q R,Yu H L,Ru Q M.Bioavailability and delivery of nutraceuticals using nanotechnology [J].Journal of Food Science,2010,75(1):50-57.
[16] Shakeel F,Ramadan W,Faisal M S,et al.Transdermal and topical delivery of anti-inflammatory agents using nanoemulsion/microemulsion:An updated review [J].Current Nanoscience,2010,6(2):184-198.
[17] McClemets D J,Rao J.Food-grade nanoemulsion:Formulation fabrication,properties,performance,biological fate,and potential toxicity [J].Critical Reviews in Food Science and Nutrition,2011,51(4):285-330.
[18] Acosta E.Bioavailability of nanoparticles in nutrient and nutraceutical delivery [J].Current Opinion in Colloid & Interface Science,2009,14(1):3-15.
[19] Mason T G,Wilking J N,Meleson K,et al.Nanoemulsion:Formation,structure,and physical properties [J].Journal of Physics:Condensed Matter,2006,18(41):635-666.
[20] Tadros T,Izquierdo R,Esquena J,et al.Formation and stability of nano-emulsions [J].Advances in Colloid and Interface Science,2004(108/109):303-318.
[21] Velikov K P,Pelan E.Colloidal delivery systems for micronutrients and nutraceuticals [J].Soft Matter,2008,4(10):1964-1980.
[22] Wooster T J,Golding M,Sanguansri P.Impact of oil type on nanoemulsion formation and Ostwald ripening stability [J].Langmuir,2008,24:12758-12765.
[23] Chen H B,Khemtong C,Yang X L,et al.Nanonization strategies for poorly water-soluble drugs [J].Drug Discovery Today,2011,16(7/8):354-360.
[24] Nornoo A O,Chow D S.Cremophor-free intravenous microemulsions for paclitaxel:Ⅱ.Stability,invivorelease and pharmaacokinetics [J].Int J Pharm,2008,349(1/2):117-123.
[25] 兰 莹.复方酮康唑纳米乳的制备及其药效学研究 [D].陕西杨凌:西北农林科技大学,2012.
Lan Y.Preparation of compound ketconazole nanoemulsion and its phamacodynamics [D].Yangling,Shaanxi:Northwest A&F University,2012.(in Chinese)
[26] Kreilgaard M,Kemme M J,Burggraaf J.Influence of a micro-emulsion vehicle on cutaneous bioequivalence of a lipophilic model drug assessed by microdialysis and pharmacodynamics [J].Pharm Res,2001,18(5):593-599.
[27] Bouchemal K,Briancon S,Perrier E,et al.Nano-emulsion formulation using spontaneous emulsification:Solvent,oil and surfactant optimization [J].International Journal of Pharmaceutics,2004,280:241-251.

