1株抗耐甲氧西林金黄色葡萄球菌放线菌的鉴定及其代谢产物活性分析
杨 静,易麟乙,刘 美,王刘庆,廖美德
(华南农业大学 天然农药与化学生物学教育部重点实验室,广东 广州 510642)
自1961年英国Jevons发现首例耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)以来[1],在欧美及亚洲相继出现有关MRSA所致的感染,到20世纪80年代,MRSA感染几乎遍及全球,成为临床上最常见的病原菌之一。近年来,MRSA感染疾病的流行病学发生了显著变化,由最初的医院获得性感染发展为社区获得性感染,自Saravolatz等[2]首次报道社区获得性耐甲氧西林金黄色葡萄球菌(community-acquired MRSA,CA-MRSA)感染后,CA-MRSA感染病例在全球陆续被报道,MRSA对人类健康的威胁日益严重。最近的研究结果表明,MRSA 一般具有多重耐药特征, 临床已经分离到对万古霉素耐药的菌株(VRSA)[3],从长期与患乳腺炎奶牛接触的工作人员体内分离得到了相同的MRSA菌株,表明MRSA 可能在人与动物之间相互传播[4]。MRSA已经成为临床抗菌感染治疗的首要难题,并与乙型肝炎、艾滋病一起被称为当今世界三大感染顽疾[5],因此,研发新型抗MRSA药物刻不容缓。
本项目组前期从原始森林土壤中分离、筛选得到1株放线菌菌株,本研究对其形态特征、生理生化特征、分类地位及其代谢产物的作用范围和抗菌活性物质的部分特性等进行了探讨,现将研究结果报道如下。
1 材料与方法
1.1 供试菌株
耐甲氧西林金黄色葡萄球菌菌株由广州医学院第一附属医院检验科赠送。
1.2 放线菌AF1菌株的分离与纯化
将从非洲原始森林收集的土壤样品系列稀释后,涂布在高氏1号培养基上。28 ℃培养10 d后挑取所有单菌落进行2次纯化,分离筛选到目标菌株,将其命名为AF1菌株。
1.3 培养基
所用的培养基有高氏1号培养基、LB培养基、琼脂培养基(ISP1)、胰蛋白胨琼脂培养基(ISP2)、甘油d门冬素琼脂培养基(ISP3)、L-酪氨酸琼脂培养基(ISP4)、察氏培养基(ISP5)、伊莫松培养基(ISP6)和瓦氏肉汁培养基(ISP7),7种ISP培养基的配方参见文献[6-7]。
1.4 AF1菌株的培养、发酵及其乙酸乙酯粗提物的制备
将AF1菌株接种到高氏1号固体培养基上,28 ℃培养10 d,取分生孢子制备孢子悬液,接种到装有高氏1号液体培养基的锥形瓶(150 mL/500 mL)中,于28 ℃、160 r/min摇瓶培养7 d,然后8 000 r/min 离心20 min,取上清液用双层滤纸过滤得发酵液。滤液用乙酸乙酯萃取3次,收集萃取液,减压蒸馏浓缩可得到发酵液的乙酸乙酯粗提物。
1.5 AF1菌株的鉴定
1.5.1 形态观察 在高氏1号培养基平板上铺单层透析袋膜,接种培养AF1孢子,培养10 d待分生孢子形成后,剪取透析袋膜粘台,经超临界干燥、喷镀后,用扫描电子显微镜观察菌丝和孢子形态[6]。
1.5.2 培养特征 按参考文献[7-8]的方法,将AF1菌株孢子分别接种到ISP1、ISP2、ISP3、ISP4、ISP5、ISP6和ISP7培养基上,在28 ℃恒温培养箱中培养30 d,观察记录其培养特征,按ISCC COLOR CHARTS色谱记录菌落颜色[9]。
1.5.3 生理生化特性 参照《链霉菌鉴定手册》[10]中的方法,测定AF1菌株的明胶液化、牛奶凝固和胨化、硫化氢产生、纤维素及碳源利用等生理生化特征。
1.5.4 16S rRNA序列分析及其系统发育分析 参照文献[11]的方法提取AF1菌株基因组DNA。PCR扩增采用通用引物F: 5′-AGAGTTTGATCCTGGCTCAG-3′,R:5′-ACGGCTACCTTGTTACGACT-3′。PCR 反应体系总体积25 μL,其中包括10×Buffer 2.5 μL,dNTP 0.2 μL,MgCl22.2 μL,Primer F 2 μL,Primer R 2 μL,Taq酶0.3 μL(3 U/μL),DNA 模板1.0 μL,ddH2O 14.8 μL。反应程序为: 94 ℃预变性5 min;95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,共33个循环;循环结束后,72 ℃再后延3 min。将PCR 产物送上海生工生物工程技术服务公司测序,测序结果用BLAST软件和Mega5.0[12]构建系统发育树。
1.6 AF1菌株代谢产物的生物活性
1.6.1 发酵液的稳定性 (1)热稳定性。参照文献[13],将待测发酵产物分别置于30(室温),50,70,80,90,100 ℃条件下水浴,水浴时间设30和60 min 2个处理,待降至室温后,分别取处理后的发酵液20 μL,采用琼脂平板打孔法(孔径为6 mm)[14]测定其对MRSA的抑菌活性,重复3次。以室温下放置的发酵液作为对照。相对抑菌活性计算公式为:
相对抑菌活性=(处理组抑菌圈直径-6 mm)/(对照组抑菌圈直径-6 mm)×100%。
(2)酸碱稳定性。用1 mol/L NaOH和1 mol/L HCl将发酵液pH值分别调节至2.5,3.5,5.5,6.5,7.3,8.9,9.8和10.2;常温静置30 min后,用1 mol/L NaOH和1 mol/L HCl溶液调节发酵液pH至7.3;取处理后的发酵液20 μL,采用琼脂平板打孔法测定其对MRSA的抑菌活性,重复3次。以发酵液作为对照,计算相对抑菌活性。
(3)对紫外线照射的稳定性。取10 mL发酵液5份,置于波长254 nm、功率30 W的紫外灯下20 cm处[15],照射时间为 20,30,40,50和60 min;分别取处理后的发酵液20 μL,采用琼脂平板打孔法测定对MRSA的抑菌活性,重复3次。以发酵液作为对照,计算相对抑菌活性。
1.6.2 代谢产物萃取溶剂的选择 将AF1菌株接种到高氏1号培养基上,置于29 ℃、160 r/min的摇床上进行发酵培养,培养7 d后用双层滤纸过滤,滤液分别用等体积的三氯甲烷、乙酸乙酯、石油醚、正丁醇在分液漏斗中进行萃取。上下颠荡10次,静置萃取20 min。分别取上、下层进行抑菌活性测定。
1.6.3 代谢产物的溶解性 将发酵液的乙酸乙酯粗提物溶于丙酮中,等体积分成15份,待丙酮挥发完全后,分别用2 mL的水、甲醇、乙醇、丙酮充分溶解,每处理重复3次。取处理后的发酵液20 μL,采用琼脂平板打孔法测定其对MRSA的抑菌活性。
1.7 AF1菌株发酵液乙酸乙酯粗提物对MRSA的最低抑菌质量浓度(MIC)
采用微量肉汤稀释法,测定AF1菌株发酵产物对MRSA的MIC[16]。将AF1菌株发酵液的乙酸乙酯粗提物用丙酮溶解制成质量浓度为1 088 μg/mL 的抗菌药物。将MRSA在LB琼脂板上活化,然后接种在LB液体培养基上培养12 h,作为指示菌。取无菌试管(12 mm×100 mm)12支,每管加1 mL LB培养基,在第1管中加入抗菌药物原液(1 088 μg/mL)1 mL混匀,按倍比稀释法依次稀释。然后在每管中加入制备好的MRSA接种物各1 mL。第1管至第11管药物质量浓度分别为544,272,136,68,34,17,8.5,4.25,2.125,1.06和0.53 μg/mL,每个梯度重复3次。将混合液置于温度30 ℃、转速160 r/min的摇床上培养5 h后,以未添加粗提物的培养管作为对照,测定MRSA培养液的吸光度(OD600),根据NCCL有关规定[17](后文列出),计算活性物质的MIC值。按上述方式测试相同体积丙酮对MRSA生长的抑制作用。
2 结果与分析
2.1 AF1菌株的分类鉴定
2.1.1 菌株形态和培养特征 图1-A显示,放线菌AF1在高氏1号培养基上培养10 d后,菌落表面呈浅灰色,有脊状褶皱,能产生棕红色可溶性色素;分生孢子丝直或呈波浪弯曲状,孢子成链呈松散螺旋状,不形成分生孢子包囊,分生孢子大小1.5 μm×0.45 μm,呈柱形,表面光滑(图1-B,C,D)。
AF1菌株在7种ISP培养基上培养30 d后,其特征观察结果见表1。由表1可以看出,AF1菌株在ISP1、ISP4和ISP5培养基上生长较慢,在其他4种培养基上生长良好,后期菌落边缘有轮纹现象;在7种培养基上均能产可溶性色素,其中在ISP1、ISP3和ISP5上为棕红色色素, 在ISP4和ISP7上为灰色色素,在ISP2、ISP6上分别为浅褐色和银灰色色素。
2.1.2 生理生化特性 AF1菌株的生理生化特性测定结果见表2。由表2可见,AF1菌株能利用葡萄糖、D-半乳糖、麦芽糖、鼠李糖和蔗糖,不能利用D-果糖、D-甘露醇和肌醇;能水解淀粉,但不能水解纤维素;在明胶液化、黑色素、牛奶凝固、产硫化氢及硝酸盐还原酶等试验中均呈阳性。
2.2 AF1菌株的16S rDNA序列测定及系统发育分析
测得AF1菌株的16S rDNA全长为1 242 bp,全序列已在GenBank中登记,登录号为KF059834.1。BLAST软件比对结果显示,AF1菌株与GenBank中加利利链霉菌XSD-102(StreptomycesgalileeXSD-102)菌株的同源率为100%,与StreptomycesboliliHBUM174851和Streptomycessp.SX-4的相似性均为99%。用Mega5.0软件构建的系统发育树(图2)显示,AF1与上述3种菌株的进化距离最近。
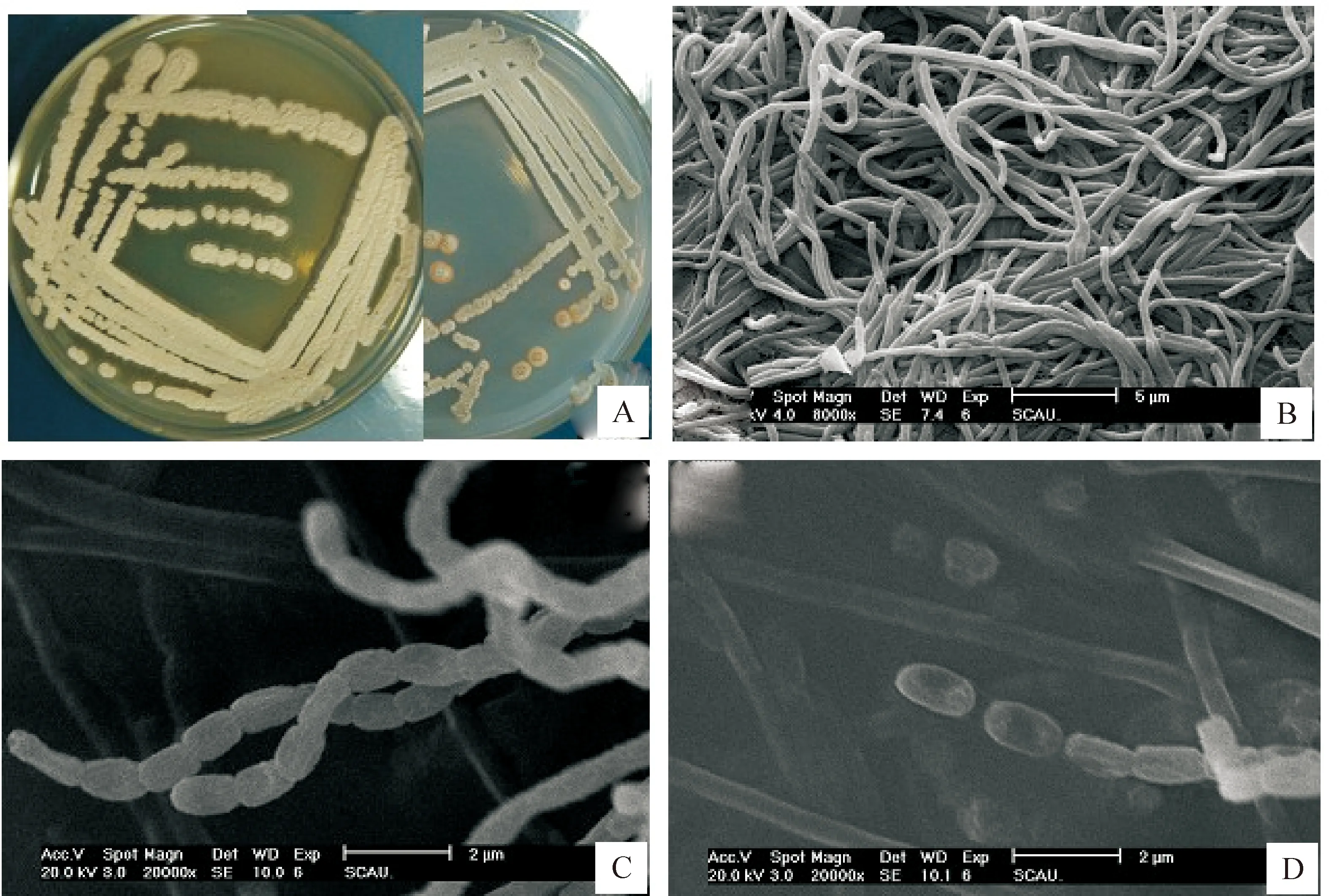
图 1 菌株AF1的形态特征

表 1 AF1菌株在7种ISP培养基上的培养特征

表 2 AF1菌株的生理生化特性

图 2 AF1菌株16S rDNA序列的系统发育树
2.3 AF1菌株代谢产物的稳定性
2.3.1 热稳定性 AF1发酵液中活性物质的热稳定性测定结果见图3。
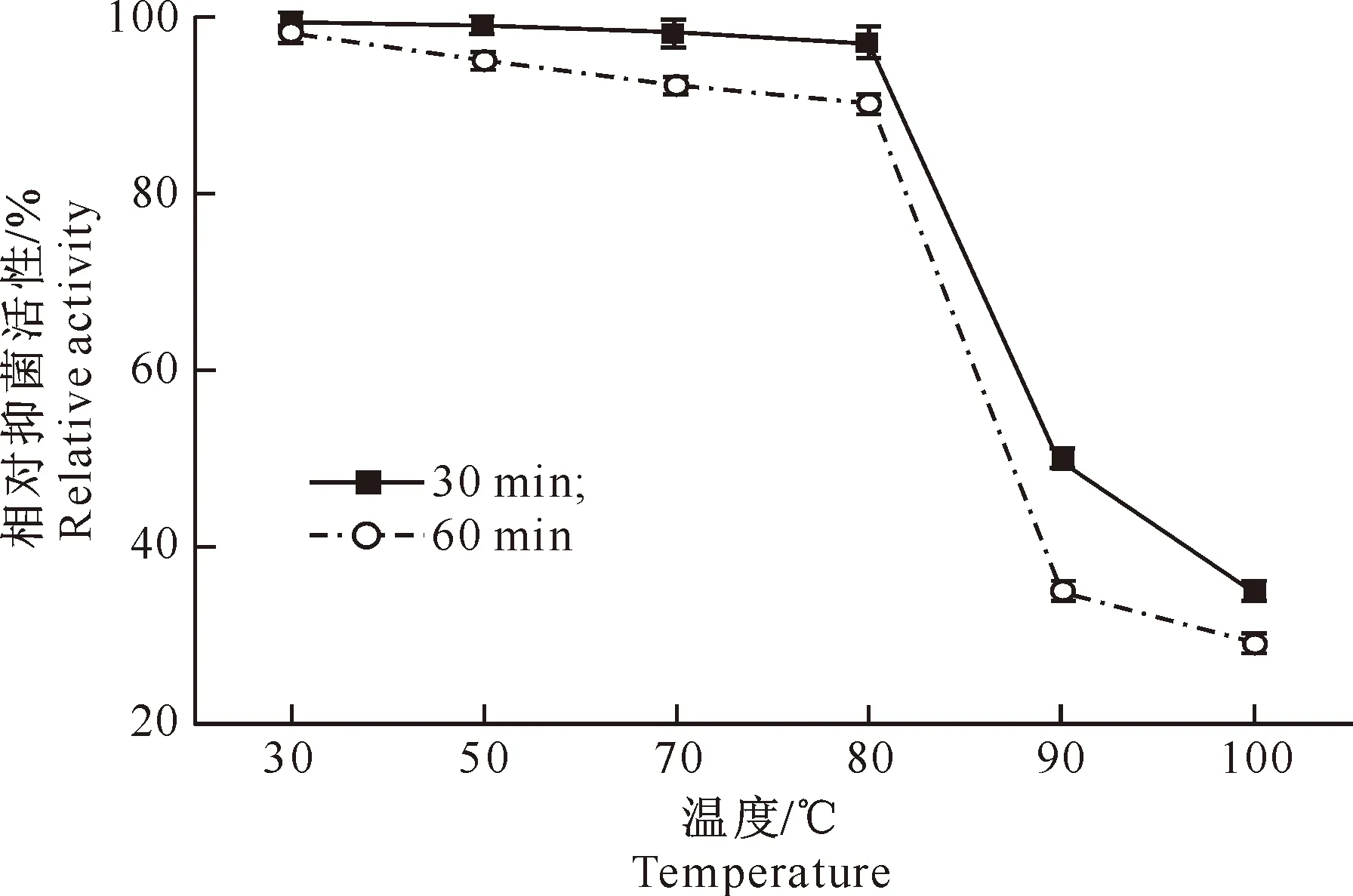
图 3 AF1菌株抑菌活性物质的热稳定性
由图3可知,在30~80 ℃下,AF1菌株代谢产物生物活性降低不明显,随着处理时间的延长,活性略有降低。90和100 ℃时生物活性明显下降,90 ℃处理60 min和100 ℃条件下活性几乎消失。
2.3.2 酸碱稳定性 不同pH处理条件下,AF1发酵液中物质的抑菌活性测定结果见图4。图4表明,在试验pH范围内,pH值对发酵液中物质的抑菌活性影响不明显,抑菌活性保持稳定。但随着pH值的改变,发酵液的颜色变化较大,在酸性条件下呈橘黄色,并逐渐过渡到棕红色。
2.3.3 对紫外线照射的稳定性 AF1发酵液对紫外线照射的稳定性测定结果见图5。图5表明,AF1发酵液经紫外线照射不同时间后,其生物活性有一定的降低但不明显,说明其抗菌活性物质具有一定的紫外线耐受性。
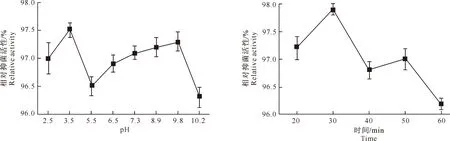
图 4 pH对AF1菌株发酵液中抑菌活性物质稳定性的影响
2.4 AF1菌株抑菌活性物质萃取溶剂的选择
由表3可见,在原始pH 条件下,AF1菌株发酵液中的生物活性物质大部分能被乙酸乙酯和正丁醇萃取,三氯四烷萃取效果相对较弱,石油醚几乎不能萃取。
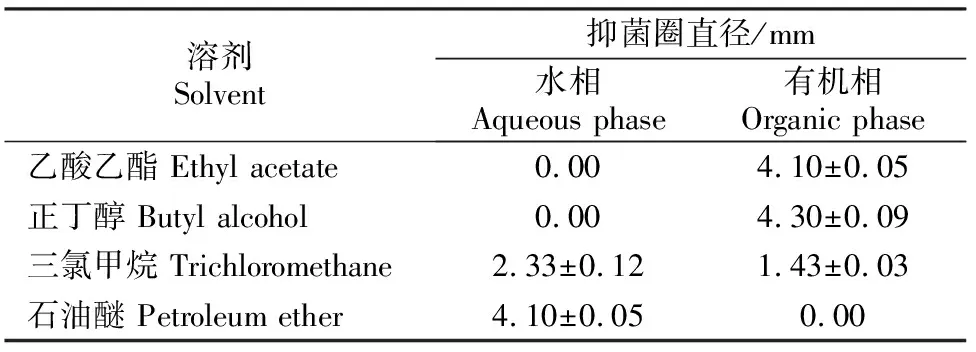
表 3 有机溶剂对AF1菌株发酵液活性物质的萃取效果
2.5 AF1菌株发酵液乙酸乙酯粗提物中活性物质的溶解性
由表4可知,AF1菌株发酵液乙酸乙酯粗提物中抗菌活性物质在丙酮和甲醇溶液中的溶解度较高,根据相似相溶原理,可初步判断AF1菌株发酵液中抗菌活性物质是一种中高度极性的物质。
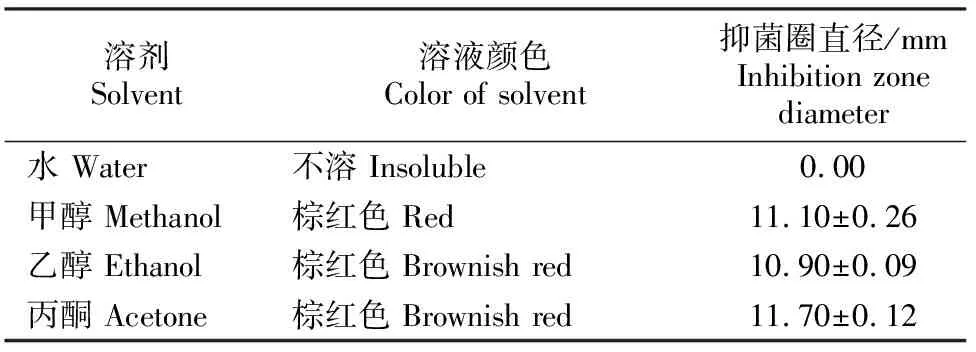
表 4 有机溶剂对AF1菌株发酵液活性物质的溶解性
2.6 AF1菌株发酵液乙酸乙酯粗提物对MRSA 的MIC
AF1菌株发酵液乙酸乙酯粗提物对MRSA的抑菌率见图6。
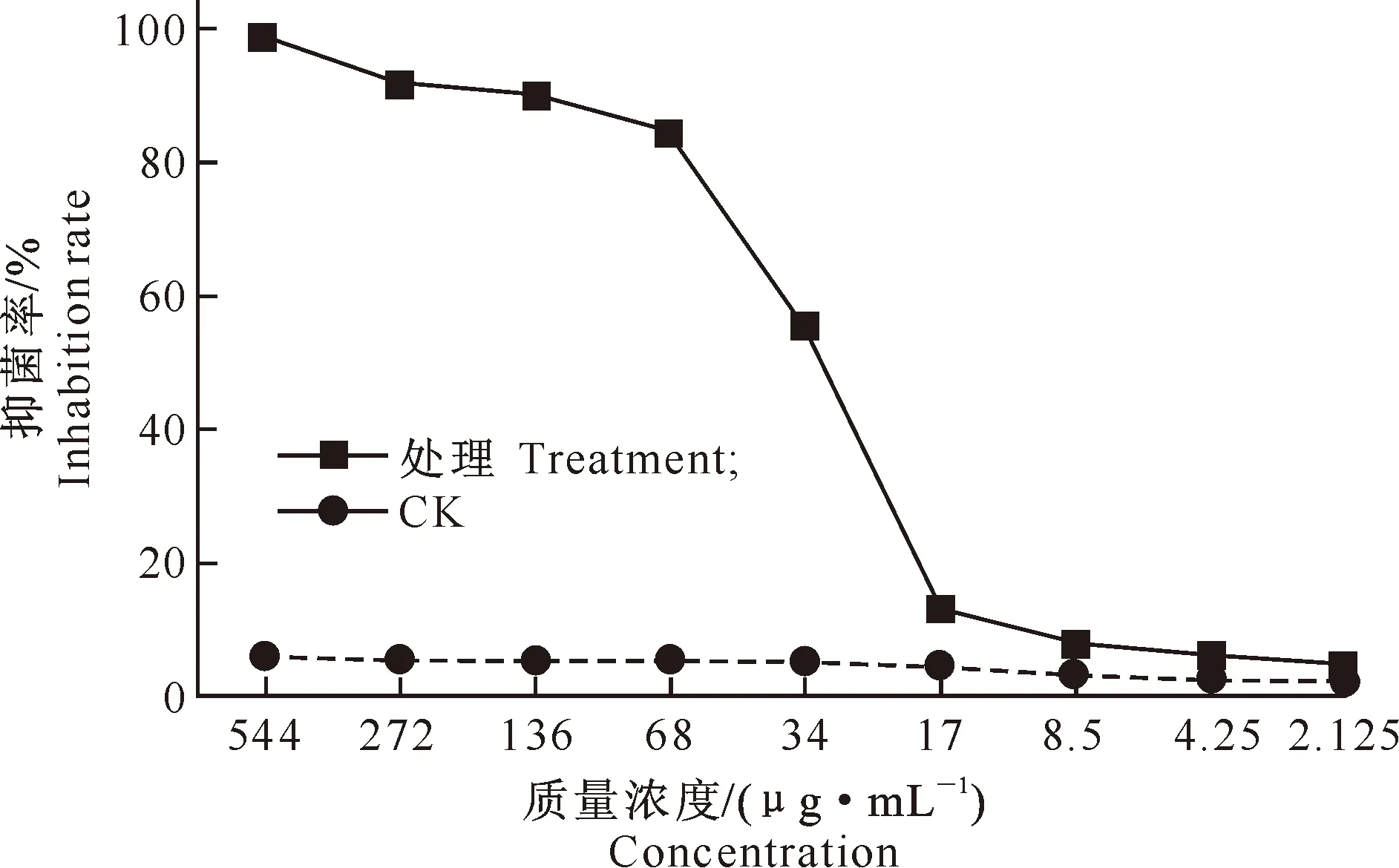
图 6 AF1菌株发酵液乙酸乙酯粗提物对MRSA的抑菌率
由图6可以看出,用质量浓度≥272 μg/mL的AF1菌株发酵液的乙酸乙酯粗提物处理MRSA时,菌株不再生长。当粗提物质量浓度在34~136 μg/mL 时,随着质量浓度提高,MRSA菌体生长受到明显抑制。粗提物质量浓度低于34 μg/mL时,菌体生长抑制不明显。参照NCCL[17]的规定,与阳性生长对照管比较,可以抑制80%细菌生长的药物质量浓度为受试菌的MIC。因此,AF1菌株发酵液乙酸乙酯粗提物对MRSA 的最小抑菌质量浓度为68 μg/mL。
3 讨 论
本研究分析结果表明,AF1菌株与加利利链霉菌XSD-102 16S rDNA序列的同源性达100%,故将AF1菌株暂定名为加利利链霉菌(S.galilaeusAF1)。现有资料表明,S.galilaeus为马铃薯疮痂病(Potato common scab)病原菌,张萌等[18]分析了中国不同地区的马铃薯疮痂病病原菌发现,病原菌的分布具有种特异性和分布多样性。Oki等[19]在S.galilaeusMA144-M1中发现了阿克拉霉素A和B(Aclacinomycin A and B)以及其他19种类似物,阿克拉霉素作为抗癌药物,因其较低的心脏毒性而获得极大关注[20]。范瑾[21]也从四川省的土壤中分离到1株产生蒽环类抗肿瘤抗菌素的链霉菌77-3082 。另有报道发现,在培养7 d后的加利利链霉菌菌丝体中发现了阿柔比星(Aclarubicin)[22-23],但未见有关其抑菌活性物质的研究报道。
MRSA对人类健康的威胁日益严重,目前用于治疗相关感染的药物有利奈唑烷(linezolid)[24]、达托霉素(daptomycein)[25]、泰利霉素(tigecycline)、替加环素(tigecycline)[26]等,还有一批处于临床研究阶段的药物如头孢吡普、达巴万星等。但是在新药研发过程中抗性菌也不断产生,且新药的研制速度不及耐药菌的产生速度,因此寻求作用方式新颖、不易产生耐药性的新品种迫在眉睫。本研究发现,AF1菌株发酵液及其乙酸乙酯粗提物具有良好的抗细菌活性,且只对革兰氏阳性菌敏感(将另文报道),能有效杀灭耐甲氧西林金黄色葡萄球菌。
[参考文献]
[1] Centers for Disease Control and Prevention.Staphylococcusaureusresistant to vancomycin:United States,2002 [J].Morbidity and Mortality Weekly Report,2002,51(26):565-567.
[2] Saravolatz L D,Markowitz N,Arking L,et al.Methicillin-resistantStaphylococcusaureusepidemiologic observations during a community-acquired outbreak [J].Annals of Internal Medicine,1982,96(1):11-16.
[3] 贺 宏,马 杰. 耐甲氧西林金葡菌的研究进展 [J].国外医药:抗生素分册,2007(4):175-177.
He H,Ma J.Research progress of methicillin-resistantStaphylococcusaureus[J].World Notes on Antibiotics,2007(4):175-177.(in Chinese)
[4] Juhasz-Kaszanyitzky E,Janosi S,Somogyi P,et al.MRSA transmission between cows and humans [J].Emerging Infectious Diseases,2007,13(4):630-632.
[5] 刘小平,樊尚荣,徐桂彪,等.168株金黄色葡萄球菌的临床分布及耐药性分析 [J].中国全科医学,2010(10):1121-1123.
Liu X P,Fan S R,Xu G B,et al.An analysis of antibiotic resistance of 168 strainsStaphylococcusaureus[J].Chinese General Practice,2010(10):1121-1123.(in Chinese)
[6] 徐丽华,李文均,刘志恒.放线菌系统学:原理、方法与实践 [M].北京:科学出版社,2007.
Xu L H,Li W J,Liu Z H,et al.Actinomycetes systematics:Principles,methods and practice [M].Beijing:Science Press,2007.(in Chinese)
[7] Shirling E T,Gottlieb D.Methods for characterization ofStre-ptomycesspecies [J].International Journal of Systematic Bacteriology,1966,16(3):313-340.
[8] Williams S T,Goodfellow M,Alderson G,et al.Numerical classification ofStreptomycesand related genera [J].Journal of General Microbiology,1983,129(6):1743-1813.
[9] Traquair J A.Conspecificity of an unidentified snow mold basidiomycete and a Coprinus species in the section Herbicolae [J].Canadian Journal of Plant Pathology,1980,2(3):105-115.
[10] 中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册 [M].北京:科学出版社,1975:658-665.
Group on Taxonomy of Actinomycetes in Institute of Microbiology of Chinese Academy of Science.Identification manual of streptomyces [M].Beijing:Science Press,1975:658-665.(in Chinese)
[11] 檀贝贝,孙 蕾,张克诚,等.武夷菌素产生菌Fosmid文库的构建及文库探针的获得 [J].生物技术通报,2011(6):116-121.
Tan B B,Sun L,Zhang K C,et al.Construction of a fosmid library of Wuyiencin’s producing strain and obtaining of the library probe [J].Biotechnology Bulletin,2011(6):116-121.(in Chinese)
[12] Kim O,Cho Y,Lee K,et al.Introducing EzTaxon-e:A prokaryotic 16S rRNA gene sequence database with phylotypes that represent uncultured species [J].International Journal of Systematic and Evolutionary Microbiology,2012,62(3):716-721.
[13] 龙中儿,朱跃进,黄运红,等.炭样小单孢菌JXNU-1广谱抗生素产物的分离及其理化性质 [J].微生物学通报,2008(9):1450-1454.
Long Z E,Zhu Y J,Huang Y H,et al.Isolation and purification of antibiotic from the fermentation broth of micromonospora carbonacea JXNU-1 and its physical-chemical properties [J].Microbiology China,2008(9):1450-1454.(in Chinese)
[14] Belofsky G N,Anguera M,Jensen P R,et al.Oxepinamides A-C and fumiquinazolines H-I:Bioactive metabolites from a marine isolate of a fungus of the genus acremonium [J].Chemistry-A European Journal,2000,6(8):1355-1360.
[15] 张武岗,冯俊涛,张锦恬,等.放线菌19G-317菌株发酵产物抑菌活性初步研究 [J].西北农林科技大学学报:自然科学版,2009,37(4):158-162.
Zhang W G,Feng J T,Zhang J T,et al.Studies on antifungal actions of actinomycete strain 19G-317 and secondary metabolites [J].Journal of Northwest A&F University:Nat Sci Ed,2009,37(4):158-162.(in Chinese)
[16] 王文莉,王端礼,李世荫,等.NCCLS方案检测氟康唑对酵母菌的最小抑菌浓度 [J].中华皮肤科杂志,1996(5): 374-376.
Wang W L,Wang D L,Li S Y,et al.The minimum bacteriostasis concentration of fluconazole to yeast according to NCCL [J].Chinese Journal of Dermatology,1996(5):374-376.(in Chinese)
[17] 张光艳,卓 超,黎晓强.2007-2009年金黄色葡萄球菌对万古霉素MIC值变化的研究 [J].中国抗生素杂志,2011(9):699-702.
Zhang G Y,Zhuo C,Li X Q.Vancomycin MIC shift in clinicalStaphylococcusaureusisolates from 2007 to 2009 [J].Chinese Journal of Antibiotics,2011(9):699-702.(in Chinese)
[18] 张 萌,刘 伯,于秀梅,等.中国马铃薯疮痂病菌生物学特性分析 [J].中国农业科学,2010,43(12):2603-2610.
Zhang M,Liu B,Yu X M,et al.Biological characteristics analysis of the pathogens caused potato common scab in China [J].Scientia Agriculture Sinica,2010,43(12):2603-2610.(in Chinese)
[19] Oki T,Shibamoto N,Matsuzawa Y,et al.Production of nineteen anthracyclic compounds byStreptomycesgalilaeusMA144-M1 [J].The Journal of Antibiotics,1977,30(8):683.
[20] Oki T,Kitamura I,Yoshimoto A,et al.Antitumor anthracycline antibiotics,aclacinomycin A and analogues:Ⅰ.Taxonomy,production,isolation and physicochemical properties [J].The Journal of Antibiotics,1979,32(8):791-800.
[21] 范 瑾.抗肿瘤抗菌素阿克拉辛霉素的研究:Ⅰ.加利利链霉菌思文变种的鉴定 [J].微生物学报,1979(4):365-369.
Fan J.Studies on the antitumour antibiotics aclacinomycin:Ⅰ.Taxanomical identification ofStreptomycesgalilaeusvar.siwenensis[J].Acta Microbiologica Sinica,1979(4):365-369.(in Chinese)
[22] Oki T,Yoshimoto A,Matsuzawa Y,et al.Biosynthesis of anthracycline antibiotics byStreptomycesgalilaeus:Ⅰ.Glycosidation of various anthracyclinones by an aclacinomycin-negative mutant and biosynthesis of aclacinomycins from aklavinone [J].The Journal of Antibiotics,1980,33(11):1331-1340.
[23] Räty K,Kunnari T,Hakala J,et al.A gene cluster fromStreptomycesgalilaeusinvolved in glycosylation of aclarubicin [J].Molecular and General Genetics MGG,2000,264(1/2):164-172.
[24] Tsiodras S,Gold H S,Sakoulas G,et al.Linezolid resistance in a clinical isolate ofStaphylococcusaureus[J].The Lancet,2001,358(9277):207-208.
[25] Fowler J V G,Boucher H W,Corey G R,et al.Daptomycin versus standard therapy for bacteremia and endocarditis caused byStaphylococcusaureus[J].New England Journal of Medicine,2006,355(7):653-665.
[26] Denis O,Deplano A,Nonhoff C,et al.Invitroactivities of ceftobiprole,tigecycline,daptomycin,and 19 other antimicrobials against methicillin-resistantStaphylococcusaureusstrains from a national survey of Belgian hospitals [J].Antimicrobial Agents and Chemotherapy,2006,50(8):2680-2685.

