马立克氏病病毒河南分离株Meq基因的克隆与序列分析
余祖华,滕 蔓,丁 轲,闵亚杰,禹乐乐,宿靖伟,程相朝,罗 俊
(1 河南科技大学 动物科技学院 动物疫病与公共卫生重点实验室,河南 洛阳 471003;2 河南省农业科学院,农业部动物免疫学重点实验室,河南省动物免疫学重点实验室,河南 郑州450002;3 洛阳普莱柯生物工程股份有限公司,河南 洛阳 471003)
马立克氏病病毒(Marek’s disease virus,MDV)是一种能引起其自然宿主发生肿瘤的致瘤性疱疹病毒[1],属于α疱疹病毒[2],具有高度的接触传染性。MDV感染鸡后能引起马立克氏病(Marek’s disease,MD),该病首次由Joszef Marek于1907年发现并报道[3],是一种主要以淋巴组织增生性紊乱、神经性、免疫抑制性为主要特征的疾病。MDV共有3种血清型[2],即MDV-1(Gallid herpesvirus 2,GaHV2)、MDV-2(Gallid herpesvirus 3,GaHV3)和MDV-3(Meleagrid herpesvirus 1,MeHV1),其中GaHV2包括对宿主具有毒力或致瘤性的强毒分离株及其致弱变异株;GaHV3没有致病性;MeHV主要是火鸡疱疹病毒(Herpesvirus of turkeys,HVT),也没有致病性,且可用于制备疫苗来预防MD。根据GaHV2毒株致病性的不同,可将MDV-1分为温和毒株(Mild MDV,mMDV)、强毒MDV(Virulent MDV,vMDV)、超强毒MDV(Very virulent MDV,vvMDV)以及特超强毒MDV(Very virulent plus MDV,vv+MDV)[4]。Meq基因是GaHV2毒株特有的基因,为MDV的致瘤基因,其N末端具有亮氨酸拉链结构(Basic region leucine zipper,bZIP),C末端具有富含脯氨酸重复区(Proline-rich repeats,PRRs)的转录激活域[5-6]。迄今为止,MD的预防与控制仍需通过疫苗免疫来进行。但是,随着集约化养禽业的不断扩大,MDV对常规疫苗的抵抗力也在逐渐增加,且能突破MDV疫苗的免疫保护,因此在疫苗免疫鸡群中常发生野毒株的感染,且致病力也呈逐渐增强趋势。2011-2012年,河南省某些疫苗免疫鸡群发生较大规模的MD流行[7],笔者对病例鸡进行了病毒分离,为了解这些分离株Meq基因的分子特性,本研究对17个MDV分离株的Meq基因进行了克隆测序,并将其与4种致病型MDV-1参考毒株进行了比较分析,旨在了解这些分离株的遗传变异特征及可能的致病性。
1 材料与方法
1.1 MDV毒株
17个MDV分离株分别为HNGS101、HNGS201、HNGS206、HNXZ101、HNXZ103、HNXZ106、HNLC107、HNLC202、HNLC203、HNLC401、HNLC502、HNLC503、HNLH302、HNLH303、HNLH304、 HNLH305和HNSC105,由河南省农业科学院动物免疫学重点实验室分离保存。MDV GX0101株为分离于中国广西产蛋鸡群的1株GaHV2野毒株,由山东农业大学崔治中教授馈赠。
1.2 主要试验材料
Premix Ex TaqTM、pMD19-T载体、E.coliJM109感受态细胞、DL2000 DNA Marker,均购自TaKaRa公司;DNA提取试剂盒、凝胶回收试剂盒,均购自北京天根生化科技有限公司。
1.3 参考毒株的Meq基因序列
4种不同致病性MDV-1Meq基因序列来自GenBank,其毒株及序列号分别为:mMDV CVI988(AF493555)和中国疫苗株814(AF493551)、vMDV GA(AF147806)、vvMDV RB1B(AY243332)、vv+MDV毒株648A(AY362725)。
1.4 分离株Meq基因的扩增
1.4.1 引物的设计与合成 根据GenBank 中发表的 MDV Md5株的全基因序列 (No.AF243438),应用Primer primer5.0软件设计1对扩增Meq基因全序列的引物,预计扩增片段长度为1 020 bp,引物由生工生物工程(上海)股份有限公司合成。
上游引物P1:5′-ATGTCTCAGGAGCCAGAG-3′(位于基因组134 867-134 884碱基处);
下游引物P2:5′-TCAGGGTCTCCCGTCACC-3′(位于基因组135 869-135 886碱基处) 。
1.4.2Meq基因的PCR扩增 用DNA提取试剂盒提取各MDV分离株感染的鸡胚成纤维(Chicken embryo fibroblast,CEF)细胞总DNA,用去离子水调整DNA至质量浓度为100 ng/μL后,进行各分离株Meq基因的PCR扩增。同时以MDV GX0101株感染CEF细胞的总DNA为阳性对照,以CEF细胞总DNA为阴性对照。PCR反应体系为20 μL,其中包括ExTaq酶10 μL,10 pmoL/μL的上、下游引物各l μL,DNA模板1 μL,去离子水7 μL。PCR反应条件为:94 ℃预变性3 min;94 ℃变性1 min,60 ℃ 复性1 min,72 ℃延伸2 min, 共30个循环;最后72 ℃延伸10 min。置于4 ℃保存。PCR扩增产物于10 g/L琼脂糖凝胶电泳后在凝胶成像系统下观察电泳条带大小。
1.5 Meq基因的克隆与测序
用凝胶回收试剂盒回收PCR产物,将其与pMD19-T载体于16 ℃连接过夜后,转化JM109感受态细胞,挑取在具有氨苄抗性的LB固体平板上生长的单克隆菌落,接种至具有氨苄抗性的LB液体培养基中振摇培养10~12 h,然后进行菌液PCR筛选阳性克隆。PCR鉴定阳性菌送样至上海生工生物工程有限公司进行测序。
1.6 Meq核苷酸及其编码氨基酸的序列分析
分别用DNAStar MegAlign软件和MEGA 4.0软件对各分离株和MDV参考毒株序列进行序列比对分析及遗传进化分析。
2 结果与分析
2.1 MDV分离株Meq基因的PCR扩增结果
经过PCR扩增,从17个MDV分离株中均扩增出特异性PCR产物,其中绝大部分分离株如HNGS101、HNXZ101和HNLC107等的PCR扩增产物与GX0101大小一致,片段长度约为1 020 bp,均与预期长度相符;另2个分离株HNGS201和HNLC503的PCR扩增产物较预期稍大,而阴性对照CEF细胞中未扩增出特异性产物(图1)。
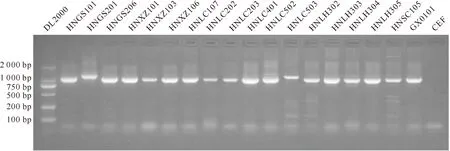
图 1 MDV Meq基因的PCR扩增
2.2 MDV分离株Meq基因的核苷酸序列分析
序列分析结果表明,大部分毒株的Meq基因DNA序列大小均为1 020 bp,但分离株HNGS201 和HNLC503的长度分别为1 200 bp和1 197 bp。对分离株与MDV参考毒株Meq基因的ORF核苷酸序列进行分析比较,发现这些MDV分离株之间或分离株与参考毒株之间的核苷酸同源性为99.0%~100%。
2.3 MDV分离株Meq蛋白的氨基酸序列分析
将MDV河南分离株与各参考毒株的Meq基因推导的氨基酸序列进行比较分析,结果显示,分离株与参考株之间氨基酸存在一定的差异(图2)。河南分离株与MDV参考毒株Meq基因推导的氨基酸在71, 77, 80,115,119,139,153,176,180和217共10个位点存在突变,这些位点分别是71(S→A),77(K→E),80(D→Y),115(V→A),119(R→C),139(T→A),153(Q→P),176(P→R),180(A→T)和217(P→A),大部分毒株在有些位点存在相似的突变。分离株HNGS201、HNLC503、HNLH304与mMDV 疫苗株CVI988、814具有相似的突变位点。vv+MDV 648A在119,153,176,180具有独特的突变位点,分别是119(C→R),153(P→Q),176(R→A)和180(T→A)。分离株HNGS101、HNGS206、HNLC107、HNXZ101、HNXZ103、HNXZ106、HNLC502、HNSC105 第139位的T突变成了A。除HNGS201、HNLH304和 HNLC503外,其他河南分离株176位的氨基酸突变为R而217/277位的氨基酸突变为A。HNGS201 和 HNLC503分别在194~253、194~252之间有60个氨基酸和59个氨基酸的插入(图2)。

图 2 MDV河南分离株与参考毒株Meq基因编码的氨基酸序列的比较
2.4 MDV河南分离株Meq基因的遗传进化分析
用MEGA(version4.0)分析软件构建MDV河南分离株和参考毒株的Meq基因系统进化树(图3),发现这些分离株和参考株共组成了3个分支,其中国外强毒株GA、RB1B和648A单独形成一个分支;绝大部分河南分离株如HNXZ101、HNGS101和HNLH302等组成一个较大的分支,而另外3个河南分离株HNGS201、HNLH304和HNLC503与mMDV 毒株CVI988和814位于同一分支上。
3 讨 论
近年来,MDV毒力不断增强并出现了vv+MDV的流行[4],但目前仍不清楚MDV野毒株毒力增强的主要原因。有研究者认为,毒力增强可能与免疫鸡群中MDV 毒力基因复制过程发生突变有关[8]。某些MDV毒株测序结果表明,MDV的毒力可能与Meq基因显著的多态性和点突变有关,破坏PRRs伸展的突变株往往有较高的毒力,且PRRs突变的次数越多毒力越强[9-11]。也有研究表明,Meq蛋白C末端转录激活区的A217和N末端亮氨酸拉链区的E77、Y80、A115的独特突变与Meq蛋白的转录激活增强有关,且115位点或碱性区域2(Basic region 2,BR2)的突变可能比PRRs突变的影响更大[12-13]。施维松等[14]研究发现,有3株中国分离毒株的Meq在139、176、217位氨基酸均发生了突变,并且有2处变化是近几年国内分离毒株特有的。本研究中使用的强毒、超强毒、特超强毒的几个参考毒株在E77、Y80、A115、A217均有相似的突变位点,且具有较近的遗传进化关系,这些氨基酸的突变可能影响Meq的转录激活且与毒株的毒力有一定关系。毒力最强的参考株648A在153和176位有2次突变破坏PRRs的伸展。而河南分离株中,HNLC202、HNLC203、HNLC401、HNGS101、HNGS206、HNLC107、HNXZ101、HNXZ103、HNXZ106、HNLC502、HNSC105等11个分离株在176和217位均有2 处突变破坏PRRs的伸展,HNLH302、HNLH303、HNLH305仅在217位1处突变破坏PRRs的伸展,这一突变是否与其毒力有关,还需进一步研究。另外,HNGS101、HNGS206、HNLC107、HNXZ101、HNXZ103、HNXZ106、HNLC502、HNSC105等8株河南分离株均具有一个独特的A139替换,这个位点的氨基酸突变是否与其毒力有关,还需要开展更多的研究来证实。Meq基因系统发生树分析表明,河南分离株HNGS201、HNLH304和HNLC503与mMDV 弱毒疫苗株CVI988、814位于同一分支,且它们的氨基酸突变位点也基本一致,说明这些分离株有可能是疫苗变异株或弱毒变异株。

图 3 MDV Meq基因的系统进化树
Meq基因内富含脯氨酸重复区的59个或60个氨基酸编码基因的扩增,主要出现在较低毒力的MDV毒株中,如CVI988 和CU-2[9],但对澳大利亚和波兰的MDV分离株的研究表明,这种插入也可能发生在强毒株[15-16]。也有研究表明,MDV致弱毒株Meq基因片段比致瘤毒株的片段长[17]。本研究发现,仅在HNGS201和HNLC503这2株可能为mMDV的毒株内出现Meq基因177或180 bp碱基的插入,而强毒株或其他弱毒株如HNLC304与疫苗株814株并没有插入。177或180 bp碱基的插入是否可以作为区分强弱毒株的参考及其在MDV致病性方面的潜在作用值得进一步研究。本研究结果表明,在河南省的鸡群中可能流行着不同毒力的MDV,一些毒株的Meq基因存在177或180 bp碱基的插入,这些毒株可能是mMDV毒株,但还需通过动物试验来进一步验证。本研究为河南省MDV的流行情况提供了重要的参考信息,同时也为今后更好地防控MD奠定了基础。
[参考文献]
[1] Witter R L,Schat K.Marek’s disease [M]//Saif Y M.In diseases of poultry.11th edition.Ames:Iowa State Press,2003:407-464.
[2] Davison A J,Eberle R,Ehlers B,et al.The order herpesvirales [J].Arch Virol,2009,154:171-177.
[3] Marek J.Multiple nervenentzuendung (polyneuritis) bei huehnern [J].Dtsch Tierarztl Wochenschr,1907,15:417-421.
[4] Witter R L.Increased virulence of Marek’s disease virus field isolates [J].Avian Dis,1997,41:149-163.
[5] Jones D,Lee L,Liu J L,et al.Marek’s disease virus encodes a basic-leucine zipper gene resembling the fos/jun oncogenes that is highly expressed in lymphoblastoid tumor [J].Proc Natl Acad Sci USA,1992,89(9):4042-4046.
[6] 杨庆利,韦 平.马立克氏病病毒meq基因细胞转化机制的最新研究进展 [J].病毒学报,2008,24(3):244-247.
Yang Q L,Wei P.The latest advances in research of mechanisms of cell transformation incluced bymeqgene of Marek’s disease virus [J].Chinese Journal of Virology,2008,24(3):244-247.(in Chinese)
[7] 禹乐乐,滕 蔓,罗 俊,等.河南商品蛋鸡群中鸡马立克氏病的流行病学研究 [J].华北农学报,2012,27(6):163-166.
Yu L L,Teng M,Luo J,et al.Epidemiology of Marek’s disease in commercial layer chickens in Henan province [J].Acta Agriculturae Boreali-Sinica,2012,27(6):163-166.(in Chinese)
[8] 张立杰.鸡马立克氏病疫苗研究进展及病毒毒力进化态势 [J].中国家禽,2009,31(22):5-10.
Zhang L J.Research advances on Marek’s disease vaccines and the virulence evolution trend [J].China Poultry,2009,31(22):5-10.(in Chinese)
[9] Shamblin C E,Greene N,Arumugaswami V,et al.Comparative analysis of Marek’s disease virus (MDV) glycoprotein,lytic antigen pp38-and tuansformation antigen Meq-encoding genes:Association of meq mutations with MDVs of high virulence [J].Vet Microl,2004,102:147-167.
[10] Renz K G,Cooke J,Clarke N,et al.Pathotyping of australian isolates of Marek’s disease virus and association of pathogenicity with meq gene polymorphism [J].Avian Pathol,2012,41:161-176.
[11] Spatz S J,Silva R F.Sequence determination of variable regions within the genomes of gallid herpesvirus-2 pathotype [J].Arch Virol,2007,152:1665-1678.
[12] Murata S,Okada T,Kano R,et al.Analysis of transcriptional activities of the Meq proteins present in highly virulent Marek’s disease virus strains,RB1B and Md5 [J].Virus Genes,2011,43:66-71.
[13] Murata S,Hashiguchi T,Hayashi Y,et al.Characterization of Meq proteins from field isolates of Marek’s disease virus in Japan [J].Infection,Genetics and Evolution,2013,16:137-143.
[14] 施维松,刘长军,张艳萍,等.4株鸡马立克氏病病毒国内分离株Meq基因的克隆与序列分析 [J].病毒学报,2008,24(2):117-125.
Shi W S,Liu C J,Zhang Y P,et al.Cloning and sequence analysis of theMeqgene of 4 Marek’s disease virus isolates from China [J].Chinese Journal of Virology,2008,24(2):117-125.(in Chinese)
[15] Renz K G,Cooke J,Clarke N,et al.Pathotyping of Australian isolates of Marek’s disease virus and association of pathogenicity withmeqgene polymorphism [J].Avian Pathol,2012,41:161-176.
[16] Wozniakowski G,Samorek-Salamonowicz E,Kozdrun W.Molecular characteristics of Polish field strains of Marek’s disease herpesvirus isolated from vaccinated chickens [J].Acta Vet Scand,2011,53:10.
[17] Lee S I,Takagi M,Ohashi K,et al.Difference in themeqgene between oncogenic and attenuated strain of Marek’s disease virus serotype 1 [J].Vet Med Sci,2000,64(3):287-292.

