浓缩苹果汁中高渗酵母的分离鉴定及耐糖性研究
刘灿灿,岳田利,袁亚宏
(西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100)
高渗酵母是指能够在较高渗透压环境(高糖或高盐)中较好地生长的酵母菌。根据国内外的报道,高渗酵母主要存在于接合酵母属(Zygosaccharomyces)、汉逊酵母属(Hansenula)、假丝酵母属(Candida)、毕赤酵母属(Pichia)、德巴利酵母属(Debaryomyces)、红酵母属(Rhodotorula)和酿酒酵母(Saccharomycescerevisiae)等[1]。目前,高渗酵母菌因其在食品工业以及生物工程方面的应用引起人们越来越多的关注[2-7]。此外,由于高渗酵母菌的细胞壁厚及细胞质中含耐渗透压的成分[8-10],传统的巴氏杀菌很难将其完全杀灭,因此高渗酵母严重威胁了食品工业的质量安全。近年来,高渗酵母导致的国际贸易受阻现象迅速增多,大规模退货、索赔现象屡屡发生,对中国苹果汁产业的经济和声誉产生了不良影响[11-13]。针对中国浓缩苹果汁行业所面临的高渗酵母污染问题,急需采取应对措施。因此,明确引起浓缩苹果汁腐败的高渗酵母菌株,并了解其生物学和遗传学特性,已成为实现高渗酵母快速检测及控制的关键,而这方面的研究还较少。为此,本研究以陕西海升果业发展股份有限公司提供的腐败浓缩苹果汁为材料,进行了高渗酵母的分离、筛选和纯化,并对分离菌株的形态学、生理与生化特性,以及耐糖性、厌氧性、产气性进行研究,以期为浓缩苹果汁中高渗酵母的控制提供科学依据。
1 材料与方法
1.1 材 料
腐败浓缩苹果汁由陕西海升果业发展股份有限公司提供。
1.2 培养基
YPD培养基:酵母粉10.0 g,葡萄糖20.0 g,蛋白胨20.0 g,琼脂20.0 g,蒸馏水1 000 mL。
高糖琼脂培养基[14]:酵母粉 10.0 g,葡萄糖 500.0 g,NaCl 0.1 g,琼脂 20.0 g,蒸馏水1 000 mL。
麦氏Meclary培养基:酵母膏2.5 g,葡萄糖 1.0 g,醋酸钠8.2 g,KCl 1.8 g,琼脂20.0 g,蒸馏水1 000 mL。
1.3 仪器与设备
BCN-1360B 生物洁净工作台,北京东联哈尔仪器设备制造有限公司生产;CX31显微镜,奥林巴斯公司生产;UV-2550型紫外可见分光光度计,日本岛津公司生产;HC-3018R高速冷冻离心机,安徽中科中佳科学仪器有限公司生产;DPX-G002B-1电热恒温培养箱,上海福玛实验设备有限公司生产;JA2003型电子天平,上海精密科学仪器有限公司生产;PH211 pH计,意大利Hanna Instruments公司生产;PTC-200型PCR仪,美国MJ Research公司生产;DYY-6C电泳仪,北京六一仪器厂生产;Dolphin-doc凝胶成像系统,美国Wealtec公司生产;KYC 100B摇床,上海福玛实验设备有限公司生产。
1.4 方 法
1.4.1 菌株的分离 将梯度稀释10-5,10-6,10-7的浓缩苹果汁分别涂布接种于含有0.1 g/L氨苄青霉素的YPD平板上进行分离培养。每个梯度3个平行,置于28 ℃恒温培养箱中培养2~4 d。
1.4.2 菌株的纯化与培养 当分离菌株在YPD培养基上进入生长旺盛期时,挑取不同形态的酵母菌菌株,在YPD培养基上做平板划线纯化,28 ℃恒温培养箱中培养2~4 d。按此方法连续划线直至单个平板上为形态单一的菌落时,挑取平板上的单菌落进行纯化培养。
对样品中分离到的单菌落进行涂片,经复红染色后,在光学显微镜下观察其形态和纯度。将含有杂菌的分离菌株用划线分离法再次进行纯化,将纯化后的菌株于4 ℃保存。
1.4.3 高渗酵母菌株的筛选 (1)耐高糖性检验。挑取平板上纯化的单菌落,在高糖琼脂培养基上做平板划线,置于28 ℃恒温培养箱中培养5~7 d,观察酵母菌的生长情况,能在葡萄糖质量浓度为500 g/L的高渗条件下生长的酵母菌菌株为高渗酵母。
(2)形态学观察。将高渗酵母在YPD固体培养基上划线,于28 ℃恒温培养箱中培养2~4 d,观察菌落形状、颜色、是否湿润、是否光滑、边缘是否整齐等特征。用美蓝进行简单染色后于显微镜下观察,记录高渗酵母的无性繁殖方式、细胞的形状和大小。将活化好的高渗酵母在麦氏Meclary培养基上划线接种,28 ℃培养3~5 d,镜检是否有子囊孢子。将活化好的高渗酵母在PDA平板上划线接种(每个平板2~3条),在菌线上盖上无菌盖玻片,28 ℃下培养3~7 d,显微镜下观察是否有假菌丝生成。
(3)生理学特性。为了预测温度、pH 值和摇床转速对菌株生长的影响,将菌株在液体YPD培养基中培养18 h,作为种子液。取1 mL种子液接种于100 mL YPD液体培养基中,分别考察温度(20,25,30,35,40 ℃)、pH值(2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0 )及摇床转速(90,120,150,180,210 r/min)对菌体生长的影响。培养24 h后于波长600 nm处测定菌体吸光度(OD600),获得最佳菌体培养条件。在最适温度、pH值和摇床转速下培养菌株,每隔2 h测定1次OD600,共培养24 h,绘制菌株生长曲线。
(4)生化特性。参照文献[15-17]的方法,对分离菌株进行发酵糖试验、同化碳源试验、同化氮源试验、脲酶试验、类淀粉化合物生成试验、明胶液化试验、硝酸盐还原试验、37 ℃生长试验、无维生素生长测试试验。
1.4.4 高渗酵母菌株的ITS序列分析与系统发育分析 (1)模板的制备。挑取斜面保存的高渗酵母菌株于YPD液体培养基中,摇床培养16~20 h,使菌液的OD600保持在1.0左右,取分离株纯培养物3 mL,按照D3370-01-E.Z.N.A.TMYeast DNA Kit酵母基因组DNA提取试剂盒说明书提取DNA。
(2)ITS区基因的PCR扩增。采用PCR扩增ITS序列时,所有试剂由Fungi Identification PCR Kit(50次量)(宝生物工程(大连)有限公司)提供。所用引物为Forward Primer和Reverse Primer,其中Forward Primer序列为:5′-CGCCAGGGTTTT-CCCAGTCACGAC-3′,Reverse Primer序列为:5′-GAGCGGATAACAATTTCACACAGG-3′。PCR反应体系为50 μL:模板DNA 10 μL,PCR Premix 25 μL,Forward Primer 0.5 μL,Reverse Primer 0.5 μL,dH2O补足50 μL。PCR 反应程序:94 ℃预变性5 min;94 ℃变性1 min,53 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃终延伸5 min。
(3)PCR扩增产物的检测和回收。PCR扩增完成后,采用10 g/L的琼脂糖凝胶电泳鉴定扩增的DNA片段,在UVP凝胶成像分析系统下切下目的条带,采用凝胶回收试剂盒(离心柱型)回收纯化PCR扩增产物。然后将纯化后的PCR扩增产物送至北京三博远志生物工程有限公司测序。
(4)ITS序列分析和系统发育树构建。将获得的高渗酵母菌株ITS序列与GenBank数据库中已有的酵母ITS序列进行Blast比对分析,找出与其相似性最高的菌株, 确定每株菌的生物学分类地位。将得到的高渗酵母菌株的ITS序列用Clustalx 1.8进行多重序列比对后, 用系统发育软件包Mega 4.0进行多序列比对分析和系统发育树的构建。
1.4.5 高渗酵母菌株耐糖能力的测定 将分离的高渗酵母菌株种子液分别接种到葡萄糖质量浓度分别为300,350,400,450,500,550,600,650,700 g/L的高糖液体培养基中,每处理3个平行,置于25 ℃下培养,分别在接种24,48,72,96,120,144,168 h后观察发酵情况,测定菌体OD600,观察不同葡萄糖质量浓度对分离菌株生长的影响。
1.4.6 高渗酵母菌株厌氧性的测定 将分离的高渗酵母菌株种子液分别接种于YPD液体培养基以及葡萄糖质量浓度分别为500,550,600,650,700 g/L 的高糖液体培养基中,每处理3个平行,用封口膜和保鲜膜将三角瓶瓶口密封,静置于25 ℃恒温培养箱中培养9 d,每天观察培养液的浑浊度,并与未接种的培养基进行比较,观察并记录液体培养基的浑浊程度。
1.4.7 高渗酵母菌株产气性的测定 将分离的高渗酵母菌株种子液,分别接种于装有YPD液体培养基以及葡萄糖质量浓度分别为500,550,600,650,700 g/L的高糖液体培养基的杜氏小管中,塞上硅胶塞,每个处理3个平行,静置于25 ℃恒温培养箱中培养8 d,每天观察杜氏发酵管内的产气情况,并记录产气量。
2 结果与分析
2.1 高渗酵母菌株的分离、纯化及其耐高糖性检验
通过分离与纯化,从陕西海升果业发展股份有限公司提供的腐败浓缩苹果汁样品中,得到了1株酵母菌株,将其命名为B-LCC-12-01。经过耐高糖性检验,该菌可在含500 g/L葡萄糖的高糖培养基上很好地生长,因此本试验分离得到的菌株为高渗酵母菌。
2.2 高渗酵母菌株的形态学特征
菌落特征:B-LCC-12-01在YPD培养基上呈圆形,乳白色,表面隆起、不光滑,呈蜡状,菌半湿润易挑取,边缘整齐;在高糖培养基上呈圆形,乳白色,表面隆起,菌株表面较YPD培养基的干燥(图1)。
显微形态:B-LCC-12-01细胞呈椭圆形,长 3.0~6.0 μm,宽2.0~5.0 μm,出芽生殖,有1~4个子囊孢子,孢子呈卵圆形,有假菌丝生成(图2),与酵母的形态特征一致。
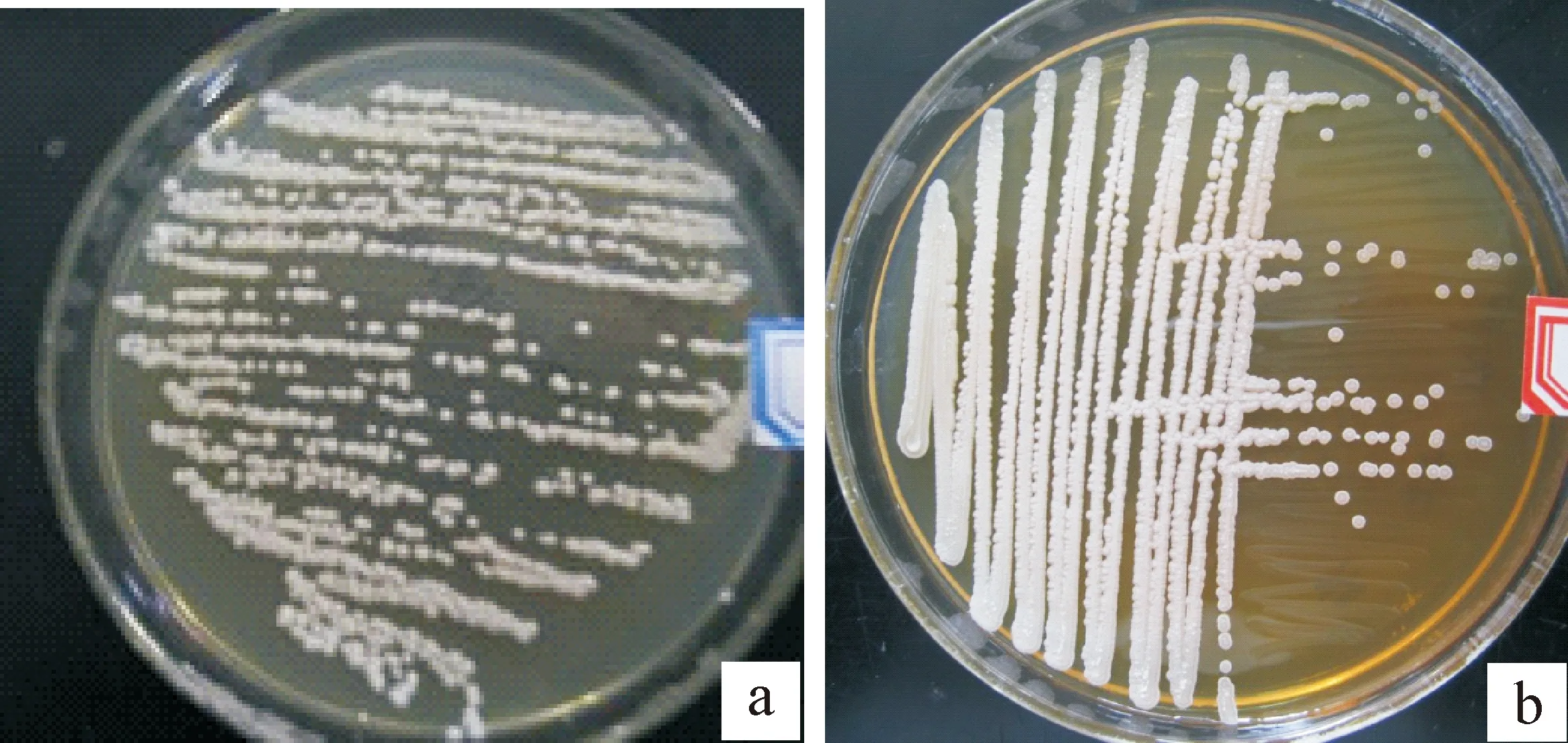
图 1 高渗酵母菌株B-LCC-12-01的菌落特征
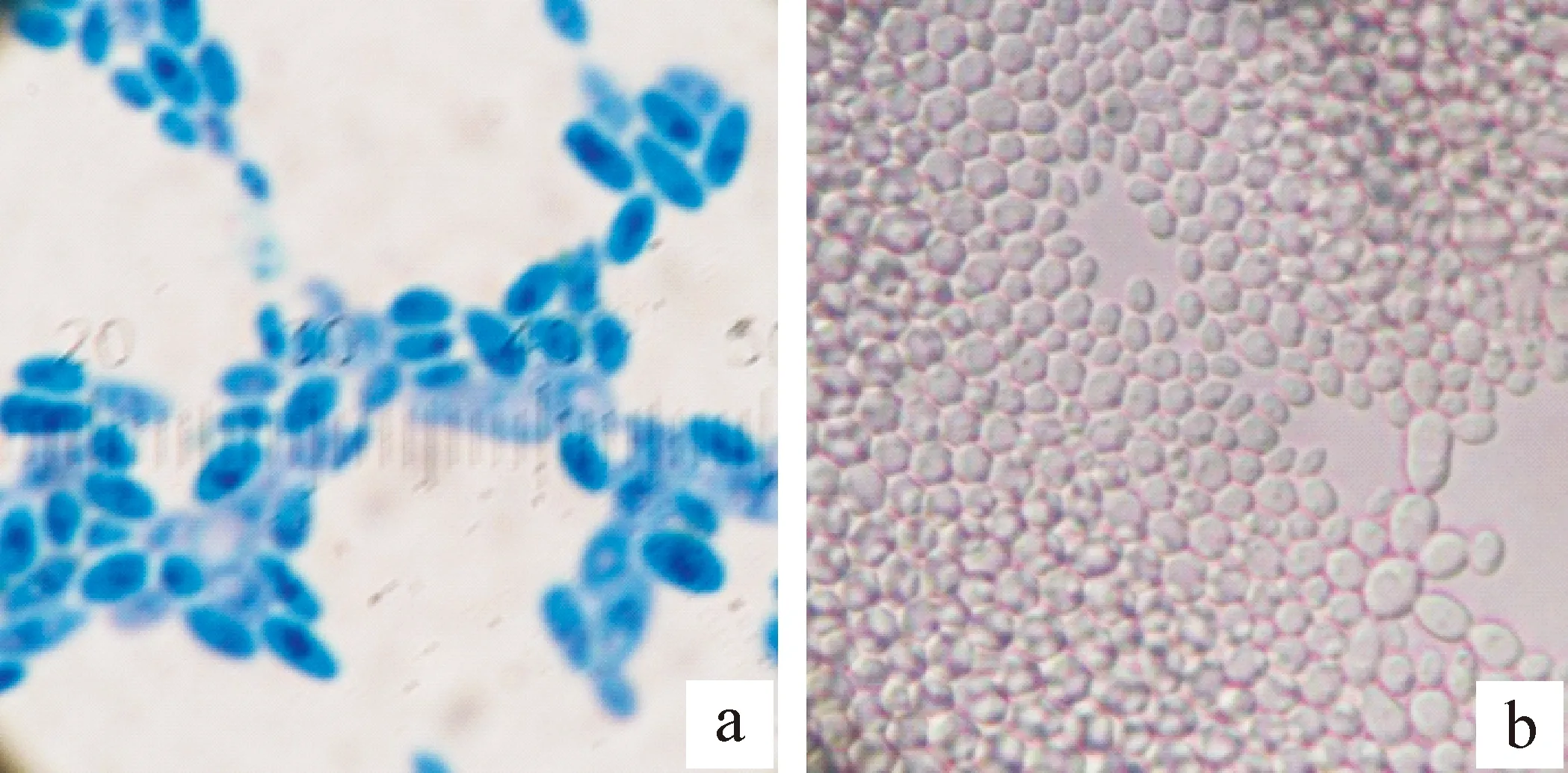
图 2 高渗酵母菌株 B-LCC-12-01显微观察结果(10×100)
2.3 高渗酵母菌株的最适生长条件及生长曲线
由图3可知,在20~40 ℃菌株B-LCC-12-01的 OD600呈先增加后降低趋势,最适生长温度为25 ℃,高于40 ℃未见生长。

图 3 温度对高渗酵母菌株B-LCC-12-01生长的影响
由图4可知,菌株B-LCC-12-01在pH 2.0~3.0 时生长呈增加趋势,之后随着pH的增加,B-LCC-12-01的生长变化幅度较小,pH为7.0时,菌株B-LCC-12-01的OD600较高,故菌株B-LCC-12-01生长的pH值范围较广,最适生长pH 值为7.0。
由图5可知,在摇床转速为90~150 r/min时,菌株B-LCC-12-01的OD600呈增加趋势;之后随着摇床转速的增加,B-LCC-12-01的OD600无明显变化,可知最适摇床转速为150 r/min。
综上所述,在温度25 ℃,pH值7.0和摇床转速150 r/min的最适培养条件下,菌株B-LCC-12-01在液体YPD培养基中的生长曲线如图6所示。由图6可知,菌株B-LCC-12-01在培养的4 h之前为调整期,4~12 h为对数生长期,12 h后进入稳定生长期,连续培养24 h未见菌株衰亡。

图 5 摇床转速对高渗酵母菌株B-LCC-12-01生长的影响
2.4 高渗酵母菌株的生化特性
菌株B-LCC-12-01的发酵糖试验结果见表1,同化碳源试验结果见表2,其他生理生化试验结果见表3。由表1~3可知,菌株B-LCC-12-01 可以发酵葡萄糖、蔗糖、麦芽糖、半乳糖、果糖及可溶性淀粉等糖类,而不能发酵乳糖和甘露醇;菌株B-LCC-12-01可以利用葡萄糖、蔗糖、麦芽糖、D-半乳糖、D-阿拉伯糖、D-木糖、山梨醇、甘露醇、甘油和体积分数3%乙醇作为碳源,而不能利用乳糖、肌醇、柠檬酸和可溶性淀粉作为碳源;菌株B-LCC-12-01可以利用硝酸盐、硫酸铵和L-赖氨酸作为氮源,有类淀粉化合物生成,可以在无维生素的培养基上以及37 ℃条件下生长。结合形态学和生理生化特征,参照《酵母菌的特征与鉴定手册》[15]将菌株B-LCC-12-01初步鉴定为异常毕赤酵母属。

表 1 高渗酵母菌株B-LCC-12-01的发酵糖试验结果

表 2 高渗酵母菌株B-LCC-12-01的同化碳源试验结果

表 3 高渗酵母菌株B-LCC-12-01的其他生理生化特性测定结果
2.5 B-LCC-12-01系统发育树的构建及菌种鉴定
通过对菌株B-LCC-12-01的 ITS基因两端序列的测定及拼接(647 bp),根据Blast比对分析结果,选择GenBank 中相关酵母菌株序列构建系统发育树,结果如图7所示。由图7可知,菌株B-LCC-12-01与异常毕赤酵母Pichiaanomala(EU380207.1)的ITS序列相似性最高,达到100%,可以判断 B-LCC-12-01属于异常毕赤酵母。这与形态学和生理生化特征鉴定的结果相符合。

图 7 基于ITS序列构建的高渗酵母菌株B-LCC-12-01与其他酵母菌株的系统发育树
2.6 高渗酵母菌株的耐糖能力、厌氧性和产气性
不同质量浓度葡萄糖对高渗酵母菌株 B-LCC-12-01生长的影响见图8。由图8可知,在同一培养时间下,随着葡萄糖质量浓度的增大,菌株B-LCC-12-01 的生长呈下降趋势;在同一葡萄糖质量浓度下,随着培养时间的延长,菌株B-LCC-12-01的生长呈增加趋势;葡萄糖质量浓度越高,菌株B-LCC-12-01生长速度越慢,延滞期越长。可见,葡萄糖质量浓度越高,对菌株的抑制作用越明显。菌株B-LCC-12-01能在葡萄糖质量浓度为300~650 g/L条件下生长,在葡萄糖质量浓度为700 g/L条件下不能生长,说明菌株B-LCC-12-01能耐受的最大葡萄糖质量浓度为650 g/L。
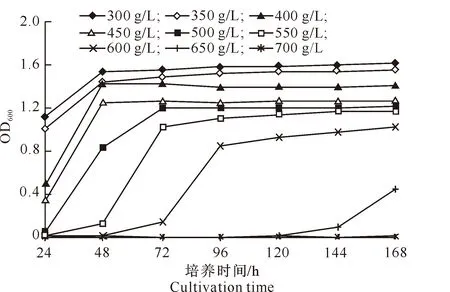
图 8 不同质量浓度葡萄糖对高渗酵母菌株B-LCC-12-01生长的影响
由表4可知,在厌氧条件下,菌株B-LCC-12-01能够在YPD液体培养基和葡萄糖质量浓度分别为500,550,600,650 g/L的高糖培养基中发酵,使液体培养基变浑浊;随着葡萄糖质量浓度的增加,发酵的速度逐渐减慢,使液体培养基变浑浊的时间延长,当葡萄糖质量浓度高于650 g/L之后B-LCC-12-01不再发酵,这与耐糖能力的测定结果相符。
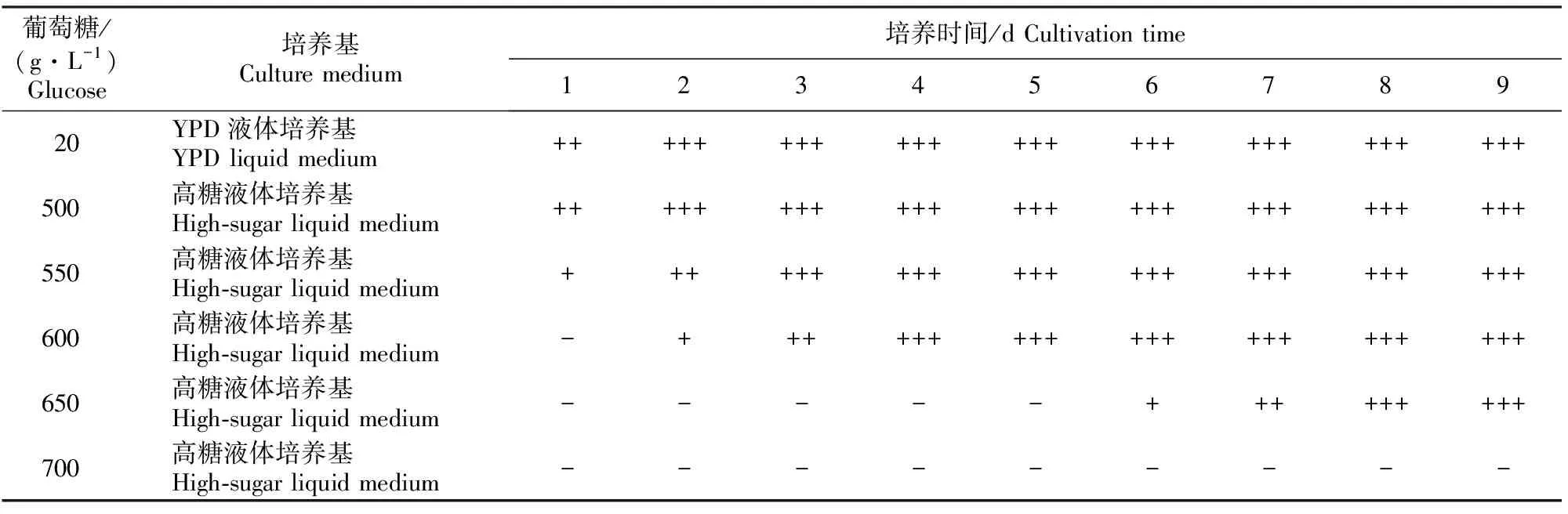
表 4 高渗酵母菌株B-LCC-12-01的厌氧性测定结果
由表5可知,菌株B-LCC-12-01在YPD液体培养基和葡萄糖质量浓度分别为500,550,600,650 g/L 的高糖培养基中能够发酵产气;随着葡萄糖质量浓度的增大,产气速度和产气能力逐渐减小,当葡萄糖质量浓度达到700 g/L时,B-LCC-12-01不产气,说明在葡萄糖质量浓度达到700 g/L的高糖培养基中菌株B-LCC-12-01已不能生长,这也与耐糖能力测定结果相符。结果表明,菌株B-LCC-12-01可在高糖厌氧条件下发酵产气,从而导致果汁胀罐,影响浓缩苹果汁的品质。

表 5 高渗酵母菌株B-LCC-12-01的产气性测定结果
3 讨论与结论
本研究从腐败的浓缩苹果汁样品中分离获得1株高渗酵母,将其命名为B-LCC-12-01。根据菌落的形态特征及生理生化特征,将B-LCC-12-01初步判定为异常毕赤酵母;经 ITS序列比对,B-LCC-12-01与异常毕赤酵母(Pichiaanomala)相似性达到100%,可判断其为异常毕赤酵母。经过耐糖性分析,菌株B-LCC-12-01能耐受的最大葡萄糖质量浓度为650 g/L。经厌氧性和产气性分析,在适宜的葡萄糖质量浓度下,菌株B-LCC-12-01能在厌氧的环境下发酵产气,导致胀罐,从而对浓缩苹果汁的品质产生影响。
国内外对高渗酵母的研究主要是其在食品行业和生物工程中的应用,以及寻找有效的控制方法控制高糖或高盐食品中高渗酵母的含量[18-19]。我国对高渗酵母的研究相对较少。本研究从腐败的浓缩苹果汁中分离得到1株异常毕赤酵母类高渗酵母,这对了解浓缩苹果汁中主要污染菌的种类有十分重要的意义。同时也说明,巴氏杀菌并不能将浓缩苹果汁中的高渗酵母完全杀灭,高渗酵母是引起果汁腐败的原因,残留的高渗酵母会对果汁品质造成严重威胁,是果汁生产厂家目前亟需解决的问题之一,因此目前的杀菌控制方法还需要进一步加强。
[参考文献]
[1] Tokuka K.耐糖和耐盐的酵母菌 [J].侯希君,译.齐齐哈尔师范学院学报:自然科学版,1993,13(4):38-43.
Tokuka K.Sugar-tolerant and salt-tolerant yeast [J].Hou X J.Journal of Qiqihar Teachers’ College:Natural Science,1993,13(4):38-43.(in Chinese)
[2] 赵红梅,刘景武,张 伟.耐高渗酵母的分离、筛选及鉴定 [J].食品研究与开发,2006(6):34-37.
Zhao H M,Liu J W,Zhang W.Screening of high glucose-endure yeast and identification [J].Food Research and Development,2006(6):34-37.(in Chinese)
[3] Groleau D,Chevalier P,Tse Hing Yuen.TLS,production of po-lyols and ethanol by the osmophilic yeast zygosaccharomyces rouxii [J].Biotechnology Letters,1995,17(3):315-320.
[4] Xie D M,Liu D H,Zhu H L,et al.Model-based optimization of temperature and feed control strategies for glycerol production by fed-batch culture of osmophilic yeastCandidakrusei[J].Biochemical Engineering Journal,2002(11):111-112.
[5] Zhang J A,Liu D H,Xie D M,et al.Production of glycerol by fermentation using osmophilic yeastCandidakruseiwith different starchy substrates [J].Enzyme and Microbial Technology,2002(30):758-762.
[6] Lin S J,Wen C Y,Lin H T,et al.Screening and production of erythritol by newly isolated osmophilic yeast-like fungi [J].Process Biochemistry,2001(36):1249-1258.
[7] Sahoo D K,Gopal P,Agarwal G P.An investigation on glycerol biosynthesis by an osmophilic yeast in a bioreactor [J].Process Biochemistry,2001(36):839-846.
[8] Park Y K,Koo M H,Oliveira I M.Biochemical characteristics of osmophilic yeasts isolated from pollens and honey [J].Biosci Biotechnol Biochem,1996,60(11):1872-1873.
[9] Miklos I,Sipiczki M,Benko Z.Osmotolerant yeasts isolated fr-om Tokaj wines [J].Basic Microbiol,1994,34(6):379-385.
[10] 乔代蓉,曹 毅,魏 亮,等.产甘油酵母菌株的分离与鉴定 [J].四川大学学报:自然科学版,2003,40(5):986-989.
Qiao D R,Cao Y,Wei L,et al.Isolation and Identification of produce glycerol-produced yeast [J].Journal of Sichuan University:Natural Science Edition,2003,40(5):986-989.(in Chinese)
[11] Koh T Y.Studies on the osmophilic yeastSaccharomycesrou-xiiand an obligate to osmophilic mutant [J].Gen Microbiol,1975(5):11-14.
[12] Munitis M T,Cabrera E,Rodriguez-Navarro.An bligate osmophilic yeast from honey [J].Appl Environ Microbiol,1976(9):320-323.
[13] 谢 勇,张建新,余清谋.浓缩苹果汁中耐高渗透压酵母菌的分离与培养条件优化研究 [J].中国酿造,2007(4):6-9.
Xie Y,Zhang J X,Yu Q M.Isolation of osmophilic yeasts from concentrated apple juice and optimization of their incubation conditions [J].China Brewing,2007(4):6-9.(in Chinese)
[14] 欧阳友生,谢小保,陈娇娣,等.胀罐酱油中耐渗透压酵母菌分离及鉴定 [J].微生物学通报,2005,32(4):120-123.
Ouyang Y S,Xie X B,Chen J D,et al.Isolation and identification of osmotolerant yeast from “Swollen Can” soy sauce [J].Journal of Microbiology,2005,32(4):120-123.(in Chinese)
[15] 巴尼特 J A.酵母菌的特征与鉴定手册 [M].胡瑞卿,译.青岛:青岛海洋大学出版社,1991:17-32.
Bant J A.Characteristic and identification manual of yeast [M].Hu R Q.Qingdao:Ocean University of Qingdao Publishing Company,1991:17-32.(in Chinese)
[16] Iwen P C,Hinrichs S H,Rupp M E.Utilization of the internal transcribed spacer regions as molecular targets to detect and identify human fungal pathogens [J].Med Mycol,2002,40:87-109.
[17] 程丽娟,薛泉宏.微生物学实验技术 [M].西安:世界图书出版公司,2000:221-222.
Cheng L J,Xue Q H.Experimental technique in microbiology [M].Xi’an:The World Books Publishing Company,2000:221-222.(in Chinese)
[18] 朱 玲.耐高渗透压腐败酵母的分离与控制研究 [D].广州:华南理工大学,2010.
Zhu L.Isolation and control of osmotolerant and spoilage yeast [D].Guangzhou:South China University of Technology,2010.(in Chinese)
[19] 胡海霞.蜂蜜高渗酵母菌分离及大蒜汁对其抑制作用研究 [D].西安:陕西师范大学,2009.
Hu H X.Study on the separation of hypertonic yeasts from honey and antibacterial action of garlic juice to it [D].Xi’an:Shaanxi Normal University,2009.(in Chinese)

