土霉素固体脂质纳米粒在家兔体内的药代动力学研究
申 芸,符华林,周 凤,张 伟,舒 刚,唐 文,卢朝成
(四川农业大学 动物医学院 药学系,动物疫病与人类健康四川省重点实验室,四川 雅安 625014)
土霉素(Oxytetracycline,OTC)是在土壤链霉菌(Streptomyces rimosus)的培养液中提取获得的四环素类广谱抗生素,对革兰阳性菌、革兰阴性菌、支原体、衣原体、立克次氏体等引起的感染有效,动物临床上广泛用于治疗畜禽的痢疾、肺炎、尿路感染和肠道感染,也可用于原虫引起的附红细胞体病、弓形虫病以及奶牛子宫内膜炎和乳房炎的治疗[1]。但由于土霉素分子中含有酚羟基、烯醇结构而导致其性质不稳定,内服吸收差,难以达到治疗浓度,且易形成“肝肠循环”,增加肝脏毒性。土霉素注射液多以有机溶剂配制,其注射给药时往往存在局部刺激性,顺应性较差,这使得土霉素的临床应用受到限制。为了改善土霉素普通制剂存在的问题,人们研制了土霉素聚乳酸微球[2]、盐酸土霉素泡腾片[3]等,但多因工艺复杂、材料不易得而难以推广。
固体脂质纳米粒(Solid lipid nanoparticles,SLN)亦称为固体脂质体,其研究始于20世纪90年代,是以三酰甘油、单硬脂酸甘油酯等脂质为载体材料,将药物包裹或镶嵌于类脂核中制成粒径50~1 000 nm的固体脂质微粒给药体系[4]。SLN主要用于包裹难溶性药物,其具有物理化学性质稳定、生物相容性好、可生物降解、缓释、靶向性强、成本低和可大规模生产等优点[5-7],但兽医临床尚未有固体脂质纳米粒的研究报道。
近年来,抗菌药物的缓释控释制剂研究受到广泛关注,特别对于时间依赖性抗生素,研究表明其体内药物浓度大于最低抑菌浓度(MIC)的持续时间须超过给药间期的40%~50%,抗菌活性才能到最大化[8],因此开发其缓释控释制剂具有十分重要的临床意义。土霉素属于时间依赖性抗生素,其抑菌效果主要取决于其与细菌的接触时间,因此研发土霉素固体脂质纳米粒(Oxytetracycline solid lipid nanoparticles,OTC-SLN)不仅可以使土霉素缓慢释放,延长其作用时间,提高生物利用度,而且由于纳米粒独特的渗透效应还有利于对细胞内感染的治疗。本课题组研制了土霉素固体脂质纳米粒,为了进一步明确固体脂质纳米粒对土霉素在体内作用过程的影响,本试验对其在家兔体内的药代动力学进行了研究,并采用非房室数学模型统计矩方法计算了主要的药代动力学参数,以期为临床用药及给药方案的设计提供依据。
1 材料与方法
1.1 材 料
1.1.1 药品与试剂 土霉素对照品,河北圣雪大成制药有限责任公司生产,含量99.05%;色谱甲醇、乙腈,天津科密欧化工试剂厂生产;土霉素注射液和土霉素固体脂质纳米粒(OTC-SLN)为四川农业大学药物制剂工程技术实验室自制,其注射液符合中国兽药典要求。其他试剂均为分析纯级试剂。
1.1.2 主要仪器 岛津SHIMADZU LC-2010C HT(CLASS-VP 6.13 multi)高效液相色谱系统(岛津国际贸易上海有限公司),XW-80A漩涡混合器(上海青浦沪西仪器厂),高速冷冻离心机(美国科峻仪器公司)。
1.1.3 试验动物 家兔10只,体质量(2.5±0.2) kg/只,由四川农业大学实验动物中心提供,使用许可证号:scxk(川)-10-2006。
1.2 试验设计
将10只家兔随机分成2组,即土霉素注射液组和土霉素固体脂质纳米粒组。试验前用专用饲料饲养7 d,给药前采血作为空白对照,之后2组均采取腹腔注射的方法给药,给药剂量均相当于土霉素原药20 mg/kg。给药后,分别于0.083,0.25,0.5,1,2,4,6,8,12,24,36,48,60,72,84和96 h采取每只家兔耳缘静脉血1 mL,加入肝素钠抗凝, 4 000 r/min 离心15 min,取上层血浆,置于-20 ℃冰箱中保存。
1.3 血浆样品中土霉素质量浓度测定方法的建立
1.3.1 HPLC色谱条件 色谱柱:KromasilC18柱(4.6 mm×150 mm, 5 μm);流动相:0.01 mol/mL草酸-乙晴(V(草酸)∶V(乙腈)=89∶11);流速:1.0 mL/min;柱温:35 ℃;紫外检测波长:276 nm;进样量:50 μL。
1.3.2 方法专属性 取家兔空白对照血浆、加有土霉素的空白对照血浆样品(土霉素含量100 μg/mL)、家兔腹腔注射土霉素注射液和土霉素固体脂质纳米粒后的血浆样品各500 μL,加入2.0 mL的EP管中,再分别加入体积分数20%高氯酸100 μL和甲醇400 μL,漩涡振荡60 s混匀,13 000 r/min 离心5 min,吸取全部上清液于40 ℃水浴中氮气吹干,残余物加500 μL流动相溶解,13 000 r/min 离心3 min,取上清液经0.45 μm微孔滤膜过滤,进样50 μL进行HPLC分析,记录色谱图,以考察血浆内源性物质对土霉素质量浓度的测定是否有干扰。
1.3.3 标准曲线的建立及最低检测限的测定 精密称取一定量土霉素对照品,加入0.01 mol/mL盐酸溶解,配成质量浓度为500 μg/mL的标准储备液,4 ℃保存备用。分别移取储备液适量于10 mL容量瓶中,用0.01 mol/mL盐酸定容配成2.5,5,10,20,40,80,160和320 μg/mL的标准溶液。取空白对照血浆400 μL,分别加入不同质量浓度的土霉素标准溶液100 μL,使血浆土霉素标准质量浓度分别为0.5,1,2,4,8,16,32和64 μg/mL。各血浆标准溶液按1.3.2节方法处理,取上清液50 μL进样,记录色谱图和峰面积。以土霉素质量浓度为横坐标、峰面积为纵坐标绘制标准曲线,得出回归方程。用空白对照血浆制成低质量浓度的药物样品,经处理后测定,以引起3倍基线噪音(S/N=3)的药物质量浓度为最低检测限。
1.3.4 精密度和回收率试验 将土霉素标准储备液加入空白对照血浆中,制得土霉素质量浓度分别为1,8和32 μg/mL的高、中、低3个血样,按照 1.3.2 节方法处理后进行HPLC测定,记录色谱图和峰面积,根据标准曲线计算土霉素质量浓度,进行日内和日间精密度(RSD)试验。同法制备土霉素高、中、低质量浓度样品,不同质量浓度做5个重复,以标准曲线测得量与土霉素加入量的比值计算回收率。另外取数份家兔空白对照血浆,每份400 μL,分别精密加入1,8和32 μg/mL 3种质量浓度的土霉素标准液,按照 1.3.2 节方法处理后进行HPLC分析,并与生理盐水稀释的高、中、低样品的峰面积进行比较,计算提取回收率。
1.3.5 稳定性试验 同法配制低、中、高3个质量浓度的土霉素血浆样品各1份,按照1.3.2节方法处理后,分别于0,3,6和9 h进行HPLC分析,根据标准曲线计算土霉素质量浓度,考察土霉素的稳定性。
1.4 血浆样品中土霉素质量浓度的测定
参考文献[9]处理血浆样品。取出冷冻保存的血浆样品,室温下自然解冻,准确吸取500 μL血浆样品于2.0 mL的EP管中,然后按照1.3.2节方法处理后进行HPLC分析,记录色谱图和峰面积进行定量分析,根据标准曲线计算出血样中土霉素的质量浓度。
1.5 数据处理
试验数据采用DAS3.1.0药动学软件进行处理,根据非房室模型的统计矩计算药物腹腔注射后的药代动力学参数[10]。根据测得的血药浓度和计算的相关药代动力学参数,用SPSS 17.0单因素ANOVA法分析各药代动力学参数的差异性。
2 结果与分析
2.1 家兔血浆中土霉素HPLC测定方法的建立
在本试验条件下,家兔空白对照血浆、加有土霉素的空白对照血浆样品、家兔腹腔注射土霉素注射液和土霉素固体脂质纳米粒后血浆样品的HPLC结果见图1和图2。由图2可知,土霉素保留时间为13 min左右,血浆峰与土霉素峰分离完全,血浆内源性杂质对土霉素含量的测定无干扰。以土霉素质量浓度为横坐标(x)、峰面积为纵坐标(y)进行回归分析,得到标准曲线回归方程为:y=61 142.1x-3 051.4,R2=0.998 8,说明在土霉素质量浓度为0.5~64 μg/mL时,土霉素质量浓度与峰面积线性关系良好。血浆中土霉素的最低检测限为0.15 μg/mL。
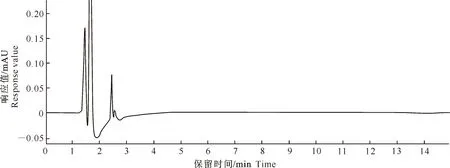
图 1 家兔空白对照血浆的HPLC色谱图
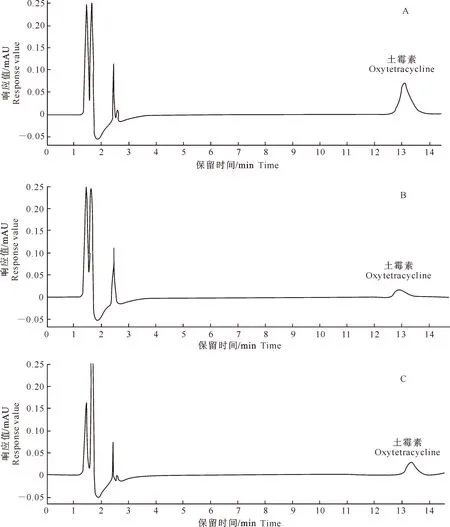
图 2 家兔血浆中土霉素的HPLC色谱图
精密度试验、回收率试验和样品稳定性试验结果见表1。由表1可知,日内、日间精密度的相对标准偏差均小于10%,回收率均在80%~120%,表明该检测方法的准确度、精密度较高,血浆样品在9 h内稳定,重现性较好,可满足生物样品中土霉素测定的要求。
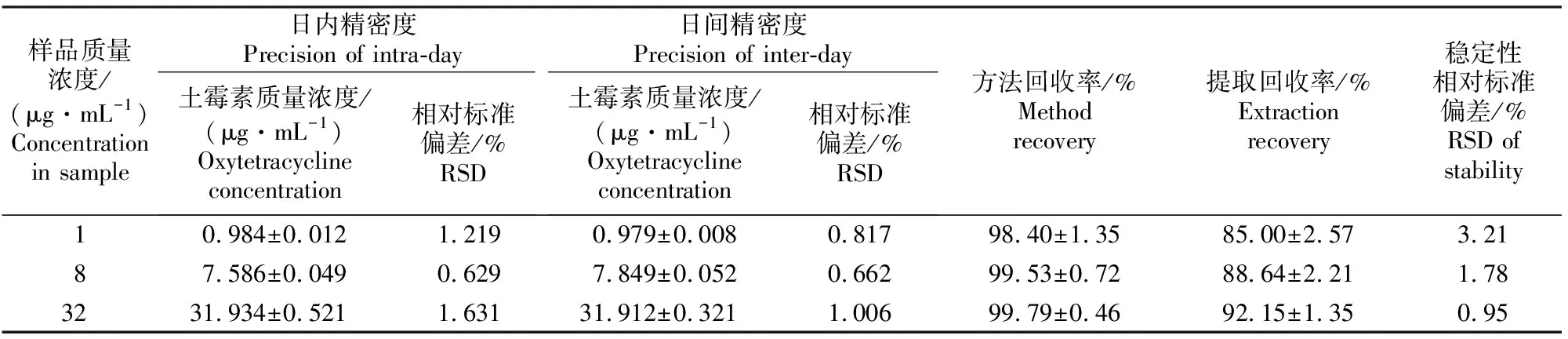
表 1 家兔血浆土霉素质量浓度HPLC检测方法的精密度、回收率和血浆样品稳定性试验结果(n=5)
2.2 血药质量浓度测定结果及药代动力学参数
家兔腹腔注射土霉素注射液和土霉素固体脂质纳米粒后,2组家兔的血药质量浓度见表2。根据2组试验所得家兔血药质量浓度数据,用DAS3.1.0进行智能化分析,以非房室模型的统计矩计算腹腔注射土霉素的药代动力学参数,结果见表3。由表3可以看出,家兔腹腔注射土霉素注射液和土霉素固体脂质纳米粒后,表观分布容积(V1/F)分别为(9.581±0.301)和(3.676±0.258) L,土霉素固体脂质纳米粒表观分布容积更低,反映了血浆药物质量浓度更高,因而土霉素制成纳米粒后促进了药物的吸收。测得血浆中土霉素吸收半衰期(T1/2Ka)分别为(18.570±0.851)和(27.871±1.767) h,说明土霉素固体脂质纳米粒具有明显的缓释效应,吸收半衰期更长;血药质量浓度达峰时间(Tmax)分别为1和4 h,达峰质量浓度(Cmax)分别为(3.676±0.376)和(3.699±0.562) mg/L,平均滞留时间(MRT(0-t))分别为(17.245±0.289)和(35.750±1.376) h。二者达峰质量浓度差异不大,但固体脂质纳米粒的半衰期(T1/2)更长,清除率(CL/F)也更低,因而平均滞留时间显著延长(P<0.05),这对于时间依赖性的抗生素土霉素发挥其抗菌作用具有重要价值。药时曲线下面积(AUC(0-t))分别为(60.766±2.974)和(153.563±8.390) mg/(L·h);AUC(0-∞)分别为(83.955±3.720)和(170.15± 10.403) mg/(L·h)。由此说明,土霉素制成固体脂质纳米粒后,其生物利用度也得到了显著提高(P<0.01)。
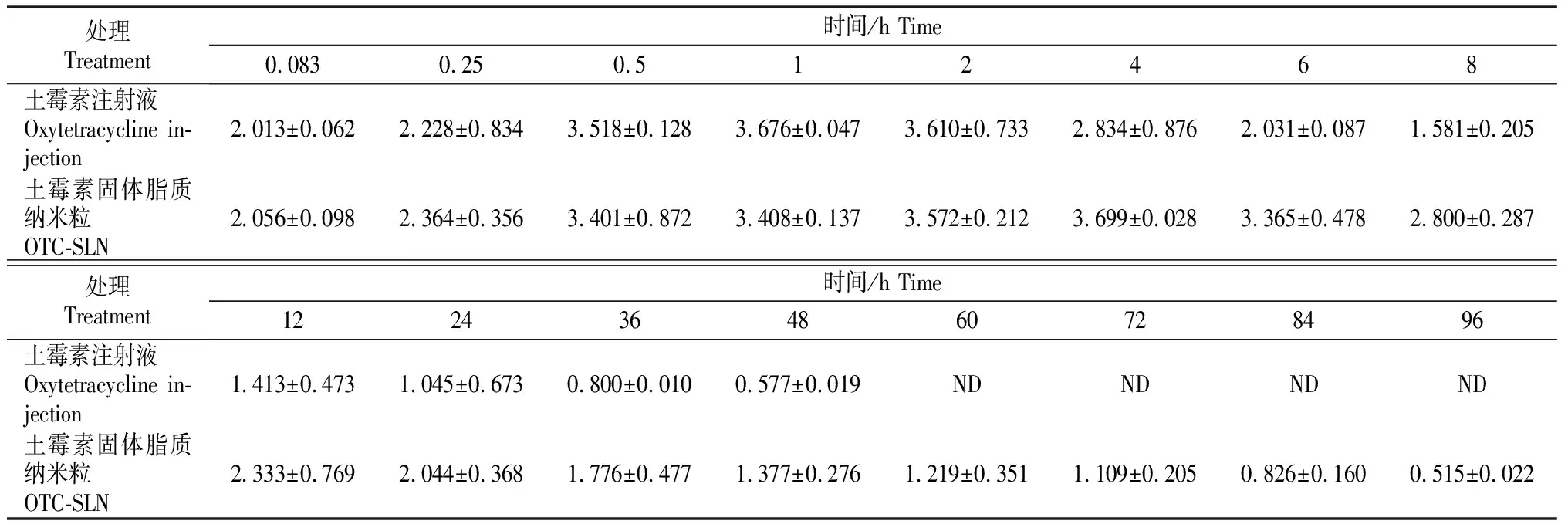
表 2 土霉素注射液和土霉素固体脂质纳米粒在家兔体内血药质量浓度的比较(n=5)
3 讨 论
固体脂质纳米粒近年来备受药剂学研究者的关注,其缓释、靶向、稳定的药剂学性质使其应用越来越广泛,而且其使用的载体材料单硬脂酸甘油酯性质稳定,体内降解途径固定,生物相容性好,细胞毒性低,可克服乳剂和脂质体的不稳定问题。近年来,多种药物的固体脂质纳米粒相继被报道,如氯诺昔康[11]、齐墩果酸[12]、胰岛素[13]等,分别起到了缓释、靶向、稳定的作用。本研究利用单硬脂酸甘油脂制备了土霉素的固体脂质纳米粒,也起到了缓释长效的作用,达到了预期的研究目的,说明固体脂质纳米粒也是一种很有前景的兽医药物新剂型。
文献[14]报道采用四氢呋喃-0.025 mol/mL草酸(V(四氢呋喃)∶V(草酸)=15∶500)、0.2 mol/mL 草酸(pH 6.88)-乙腈(V(草酸)∶V(乙腈)=20∶80)、0. 01 mol/ L 磷酸二氢钠溶液-乙腈(V(磷酸二氢钠溶液)∶V(乙腈)=75∶25) 等作为流动相测定血浆中土霉素的质量浓度,但经预试验发现,上述流动相条件并不适应本实验室的HPLC系统,主要表现为土霉素出峰时间延后,峰形不规则以及拖尾等。最后经过多次预试验筛选得到的色谱条件,土霉素出峰时间较合理,峰形良好,明显与蛋白峰分离,也不受其他杂质干扰,灵敏度高。在处理血浆样品时,曾对比甲醇和体积分数20%高氯酸不同比例混合后沉淀血浆蛋白的效果,结果表明,甲醇和体积分数20%高氯酸以体积比4∶1混合后沉淀蛋白的效果比较理想。本研究所建立的HPLC方法专属性强,精密度、方法回收率及提取回收率均符合生物供试品分析的要求。
本试验应用统计矩分析方法对2种土霉素制剂的药代动力学参数进行了求算,这是根据药物体内过程的随机变量总体效应考虑的。当一定量的药物进入体内后,具有相同化学结构的各个药物分子在体内的转运是一个随机过程,存在一定概率。因此不需要对药物设定专门的隔室,也不需要考虑药物的房室模型特征,是一种对药物在体内吸收、分布、代谢及排泄过程的研究方法。在给药方式上,本研究最初拟以肌肉注射或者静脉注射来考察土霉素纳米粒的药代动力学特征,但按照本研究制备的固体脂质纳米粒的载药量来换算剂量,给药体积太大,因而选择了给药方便而且吸收也较快的腹腔注射来进行试验。试验结果证明,土霉素制成纳米粒后进行家兔腹腔注射,尽管开始吸收速率较慢,但其AUC、MRT均明显提高。研究表明,固体粒子摄取的主要途径是细胞转运、细胞间转运及淋巴转运,其中以淋巴转运的速度最快,转运的前提是药物直接接触或粘附在黏膜表面。本课题组以单硬脂酸甘油酯为载体制备的纳米粒平均粒径在100~350 nm,比表面积大,从而增加了纳米粒与腹腔系膜的接触面积,提高了腹腔系膜对粒子的摄取量。同时,本课题组制备的纳米粒中用到了辅助乳化剂卵磷脂,其可促进脂质载体的淋巴吸收[15],这在一定程度上增加了纳米粒对腹腔黏膜的渗透性及生物粘附作用,使药物的滞留时间延长,从而提高了粒子的摄取量,增加了药物的生物利用度,增强了疗效。
[参考文献]
[1] 马玉红,史海燕.土霉素的研究概况 [J].青海畜牧兽医杂志,2007,37(4):45-46.
Ma Y H,Shi H Y.Overview of oxytetracycline [J].Chinese Qinghai Journal of Animal and Veterinary Sciences,2007,37(4):45-46.(in Chinese)
[2] 李 良,李国明.W/O法制备盐酸土霉素/聚乳酸微球及其释药性能 [J].中国现代应用药学,2005,22(1):49-52.
Li L,Li G M.Preparation of oxytetracycline hydrochloride containing polylactic acid by water-in-oil and drug-relaeasing performance [J].Chinese Journal of Modern Applied Pharmacy,2005,22(1):49-52.(in Chinese)
[3] 张 瑾. 盐酸土霉素泡腾片的制备及其药效学研究 [D].陕西杨凌:西北农林科技大学,2010.
Zhang J.Preparation of oxytetracycline hydrochloride sffervescent tablet and study on its pharmacodynamic [D].Yangling,Shaanxi:Northwest A&F University,2010.(in Chinese)
[4] 徐元龙,李学明,张 琪,等.固体脂质纳米粒的研究新进展 [J].中国新药杂志,2005,14(7):838-843.
Xu Y L,Li X M,Zhang Q,et al.Advances in solid lipid nanoparticles [J].Chinese Journal of New Drugs,2005,14(7):838-843.(in Chinese)
[5] Harivardhan R L,Sharma R,Chuttani K,et al.Influence of administration route on tumor uptake and biodistribution of etoposide loaded solid lipid nanoparticles in Dalton’s lymphoma tumor bearing mice [J].Journal of Controlled Release,2005,105(3):185-198.
[6] Blasi P,Giovagnoli S,Schoubben A,et al.Solid lipid nanoparticles for targeted brain drug delivery [J].Advanced Drug Delivery Reviews,2007,59(6):454-477.
[7] 贺小玲,王东凯,李林穗.静脉注射用固体脂质纳米粒的应用前景分析 [J].中国药剂学杂志,2009,7(2):52-58.
He X L,Wang D K,Li L S.Perspectives on the application of solid lipid nanoparticles for intravenous injection [J].Chinese Journal of Pharmaceutics,2009,7(2):52-58.(in Chinese)
[8] 刘学红,郭瑞臣,黄明慧.抗菌药物的药代动力学和药效学参数对临床用药的意义 [J].中国医院药学杂志,2006,25(2):154-155.
Liu X H,Guo R C,Huang M H.Clinical value of pharmacokinetic and pharmacodynamic parameters of antimicrobial drugs [J].Chinese Journal of Hospital Pharmacy,2006,25(2):154-155.(in Chinese)
[9] 毕秀丽,黄桂华,张 娜,等.替莫唑胺固体脂质纳米粒在动物体内药代动力学及组织分布研究 [J].中国药学杂志,2008,42(21):1655-1660.
Bi X L,Huang G H,Zhang N,et al.Study on pharmacokinetics in rabbit and body distribution in mice of temozolomide solid lipid nanoparticles by intravenously injection [J].Chinese Pharmaceutical Journal,2008,42(21):1655-1660.(in Chinese)
[10] 刘建平,李 高.生物药剂学与药物动力学 [M].北京:人民卫生出版社,2011.
Liu J P,Li G.Biopharmaceutics and pharmacokinetics [M].Beijing:People’s Health Publishing House,2011.(in Chinese)
[11] 解 斐,张 栋,刘天华,等.氯诺昔康固体脂质纳米粒的实验研究 [J].山东大学学报:医学版,2010,48(4):155-159.
Xie F,Zhang D,Liu T H,et al.Experiment on lornoxicam-loaded solid lipid nanoparticles [J].Journal of Shandong University:Health Sciences,2010,48(4):155-159.(in Chinese)
[12] 王婧雯.齐墩果酸固体脂质纳米粒肝靶向性及药效学研究 [D].西安:第四军医大学,2007.
Wang J W.Study of liver targeted characteristics and pharmacodynamic role of oleanolic acid solid lipid nanoparticles [D].Xi’an:Fourth Military Medical University,2007.(in Chinese)
[13] 张继明,胡富强,应晓英,等.胰岛素固体脂质纳米粒的制备及其理化性质研究 [J].中国药学杂志,2004,39(8):605-634.
Zhang J M,Hu F Q,Ying X Y,et al.Studies on insulin-loaded stearylamine nanoparticles: preparation and physicochemical properties [J].Chinese Pharmaceutical Journal,2004,39(8):605-634.(in Chinese)
[14] 蔡金华,顾 欣,刘雅妮.长效土霉素注射液在猪体内的药代动力学研究 [J].中国兽药杂志,2006,40(7):17-21.
Cai J H,Gu X,Liu Y N.Study on pharmacokinetics of long-action oxytetracycline injection in swine [J].Chinese Journal of Veterinary Drug,2006,40(7):17-21.(in Chinese)
[15] Holm R,Mullertz A,Christensen E,et al.Comparison of total oral bioavailability and the lymphatic transport of halofantrine from three different unsaturated triglycerides in lymph-cannulated conscious rats [J].European Journal of Pharmaceutical Sciences,2001,14(4):331-337.

