干旱胁迫对马铃薯品种生理特性的影响
海梅荣,陈勇,周平,王丽,刘福翠,唐天向,达布希拉图
(1.云南农业大学农学与生物技术学院,云南昆明650201;2.维西县农业技术推广中心,云南维西674600;
3.云南农业大学资源与环境学院,云南昆明650201)
栽培生理
干旱胁迫对马铃薯品种生理特性的影响
海梅荣1,陈勇2,周平1,王丽1,刘福翠1,唐天向1,达布希拉图3*
(1.云南农业大学农学与生物技术学院,云南昆明650201;2.维西县农业技术推广中心,云南维西674600;
3.云南农业大学资源与环境学院,云南昆明650201)
干旱是最严重的自然灾害之一,影响植物的生长、发育和繁殖等生命活动。干旱逆境可引起植物生理生化方面的一系列变化。近几年,云南省干旱问题愈加严重,因此,本研究以云南省主栽马铃薯(Solanum tuberosum L.)品种‘会-2’为试验材料,研究干旱胁迫对马铃薯抗氧化酶活性和光合特性的影响,以期在干旱情况下为稳定马铃薯的生产、提高产量提供理论依据。结果表明,随着干旱胁迫的加剧块茎干重下降比较明显;在光合特性方面,净光合速率、气孔导度、蒸腾速率和细胞胞间隙CO2浓度降低,干旱胁迫下,细胞失水,气孔关闭,限制CO2吸收,蒸腾速率减弱,从而影响光合作用的速率;干旱胁迫会诱导抗氧化酶活性的降低,减弱抗氧化酶对活性氧的清除能力,导致危害植物的丙二醛大量积累。
干旱胁迫;马铃薯;抗氧化酶活性;光合特性
由于云南省的生态环境、气候条件适宜马铃薯的生长,可多季栽培,周年生产,使云南省成为中国马铃薯的主产区之一。马铃薯是云南省的第四大粮食作物,常年种植面积在22万hm2左右,单产13 t/hm2[1]。马铃薯块茎含有多种营养成分,丰产性好,适应性广,是人类重要的粮食、蔬菜、饲料和工业原料,还是我国的出口物资[2]。
干旱是最严重的自然灾害之一,影响植物的生长、发育和繁殖等生命活动。中国是世界严重干旱的国家之一,干旱半干旱地区占国土面积的47%,占总耕地面积的51%,被世界水资源与环境发展联合会列为13个贫水国之一[3]。干旱逆境可引起植物生理生化方面的一系列变化。在生化方面,植物正常生长条件下,体内普遍有一套抗氧化系统,能有效清除过量的自由基,保护细胞免受活性氧自由基的损伤。干旱胁迫能打破这个平衡,导致活性氧的积累,活性氧的积累会导致膜脂、蛋白质和核酸发生氧化,对细胞造成伤害,但它同时也可作为信号分子来激发植物的胁迫响应和保护性反应,因此植物内抗氧化系统活性可能在其适应逆境环境中具有一定作用[4-6];在生理方面,光合作用是植物生长发育的基础和生产力高低的决定性因素,同时又是一个对环境条件变化很敏感的过程,因此经常受到外界环境条件的影响[7-10],在干旱胁迫下,当植物的叶片相对水含量和叶片的水势降低时,保卫细胞失水,引起气孔关闭,限制CO2进入叶片,从而限制光合作用速率。因此,研究逆境对马铃薯光合特性的影响能阐述逆境对植物生长发育的影响。
目前,国内外有关马铃薯抗旱生理的研究已经取得了突破性的进展[11-17],但关于干旱胁迫对马铃薯抗氧化酶活性和光合特性的影响的研究还较为少见。近几年,云南省干旱问题愈加严重,为此,本文通过盆栽试验,研究干旱胁迫对马铃薯抗氧化酶活性和光合特性的影响,以期在干旱情况下为稳定马铃薯的生产、提高产量提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为云南省主栽马铃薯品种‘会-2’。
1.2 试验地点
试验于2013年5~9月在云南农业大学教学试验农场(25°18′N,102°45′E,海拔高度1 930 m)进行。
1.3 试验方法
采用盆栽试验,每盆约装土5kg,每盆种1株,于5月份播种。试验设5个干旱胁迫处理,对照(CK)为充分灌溉水分保持土壤田间最大持水量,其它4个处理土壤含水量分别为土壤田间最大持水量的80%、60%、40%和20%,每个处理5次重复,随机排列。干旱胁迫处理的时间为7月22日至8月2日,共12d,用TZS-1型土壤水分速测仪(杭州托普仪器有限公司)每天上午10:00测定土壤水分,使每个处理的土壤含水量保持在各处理的水分含量范围内,处理结束后进行正常供水,直到收获。
1.4 生化指标的测定
1.4.1 超氧化物歧化酶(SOD)活性的测定
取马铃薯叶片0.5g于研钵中,加1 mL磷酸缓冲溶液研磨成浆,加缓冲溶液总体积为5mL,取1.5~2.0mL于10000 r/min下离心20min,上清液即为SOD提取液。在325nm波长处测定光吸收值,每隔30s读数一次,测定4 min中每分钟光吸收值的变化,要求自氧化速率控制在每分钟的光吸收值为0.07。
1.4.2 过氧化物酶(POD)活性的测定
取1g马铃薯叶片,切碎放入研钵中,加适量磷酸缓冲溶液研磨成浆。将匀浆全转入离心管中,于3000r/min下离心10min,上清液转入到25 mL容量瓶中,用磷酸缓冲溶液定容至刻度。
在3mL的反应体系中,包括0.3%H2O21mL、0.2%的愈创木酚0.95mL和pH7.0的PBS1mL,最后加入0.05mL酶液启动反应,记录470nm处OD增加速度,将每分钟OD增加0.01定义为1个活力单位。
1.4.3 丙二醛(MDA)含量的测定
称取0.2g马铃薯叶片,剪碎,加入2mL蒸馏水,研磨成浆,将匀浆转移到20 mL的刻度管中,即为提取液,再加入5mL巴比妥酸摇匀,于沸水浴上反应15min,取出试管,冷却后,转入离心管中,在3000 r/min下离心10 min,用吸管取上清液于1cm比色皿中,测定其在450,532和600nm波长下的吸光度。
1.5 光合作用相关指标的测定
干旱胁迫处理前后各进行一次叶片光合指标的测定,采用LI-6400系列光合仪(美国LI-COR公司)测定,于上午9∶00开始至下午16:30测定植株上部叶片的净光合速率、蒸腾速率、气孔导度、细胞胞间隙CO2浓度,测定时,每株取上层叶三片进行测定[18]。
1.5.1 生物产量的测定
生物产量主要测定马铃薯不同器官的生物量鲜重和干重。
收获时,取各个处理中进行光合作用相关指标的植株,用测重法测定各单株块茎鲜重并记录。然后采用烘干法测干重,把马铃薯块茎切成小块放在105℃烘箱中杀青2h,再将烘箱温度调至80℃烘干至恒重,将材料取出,称量干重并记录。
1.6 数据分析
采用Excel 2007计算试验数据,采用SPSS17.0(SPSS Inc.,USA)软件统计分析试验数据,利用Duncan’s多重比较法进行差异显著性分析,当P值小于0.05时视为差异显著[19]。
2 结果与分析
2.1 干旱胁迫对马铃薯品种产量的影响
图1为干旱胁迫对马铃薯品种块茎产量的影响。由图1可以看出,马铃薯块茎干重随着干旱胁迫程度的加深有所下降,土壤含水量为土壤田间最大持水量的60%时马铃薯干重有显著下降,土壤含水量为土壤田间最大持水量的40%和20%两个处理下块茎产量有大幅度地下降。表明块茎干重随胁迫程度加深,下降程度加大。
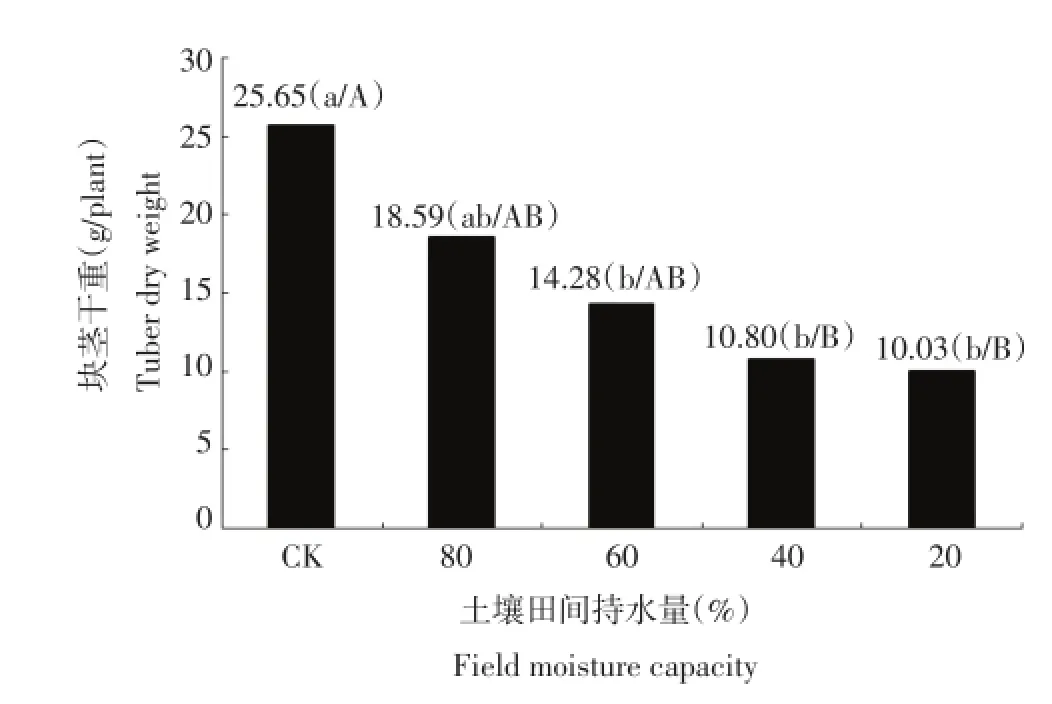
图1 干旱胁迫对每个处理块茎干重的影响Figure 1Effect of drought stress on tuber dry weight in each treatment
2.2 干旱胁迫对马铃薯抗氧化酶活性的影响
2.2.1 干旱胁迫对马铃薯叶片超氧化物歧化酶(SOD)活性的影响
超氧化物歧化酶(SOD)是植物体内的天然清除剂,是免除自由基损伤的主动防御酶。由图2可以看出,由于干旱胁迫的加剧,各个处理的SOD活性呈下降趋势,其中土壤含水量为土壤田间最大持水量的80%和60%两个处理的SOD活性与对照相比分别下降0.68%和6.22%,降低不明显;土壤含水量为土壤田间最大持水量的40%处理的SOD活性比对照下降了16.42%,下降显著;土壤含水量20%处理的SOD活性比对照下降25.87%,极显著低于对照。说明随着干旱胁迫的加深,马铃薯植株内的SOD活性下降,马铃薯受自由基损伤加重。
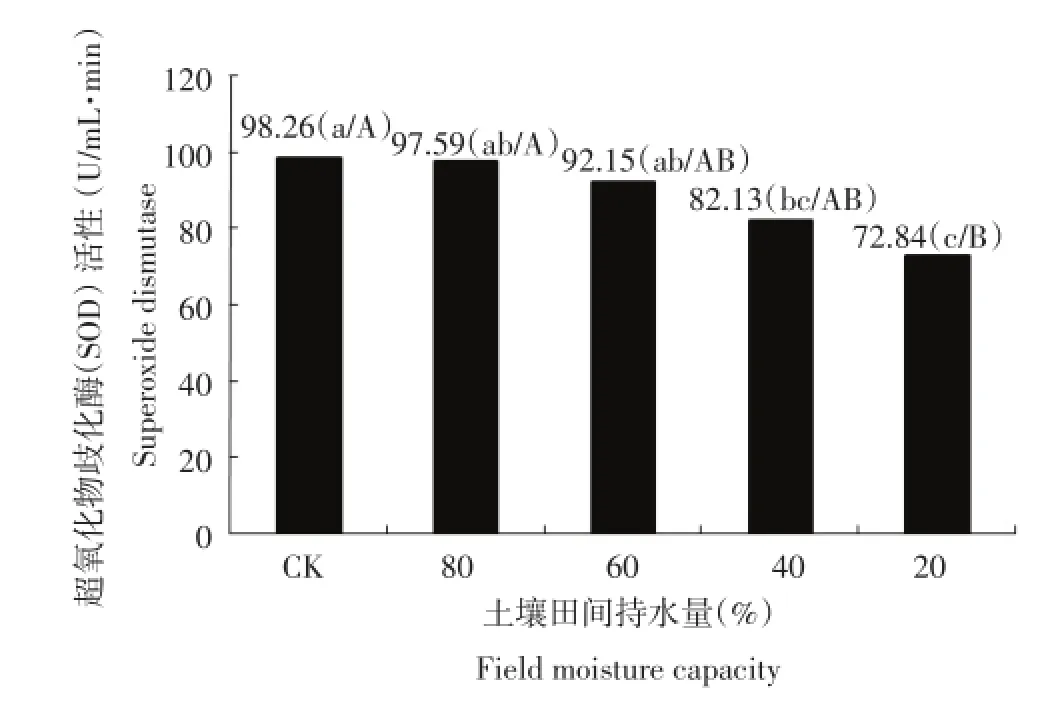
图2 干旱胁迫对每个处理超氧化物歧化酶(SOD)活性的影响Figure 2Effect of drought stress on superoxide dismutase(SOD)activity in each treatment
2.2.2 干旱胁迫对马铃薯叶片过氧化物酶(POD)活性的影响
由图3可以看出,随着干旱胁迫的加剧,各个处理的POD活性逐渐下降,其中土壤含水量为土壤田间最大持水量的80%和60%两个处理的POD活性与对照相比分别下降了23.21%和23.46%;土壤含水量为土壤田间最大持水量的40%和20%两个处理的POD活性与对照相比分别下降49.13%和50.75%,下降极显著。说明随着干旱胁迫的加重,马铃薯植株加速老化,使得POD活性下降,从而无法起到保护细胞、去除活性氧自由基的作用。
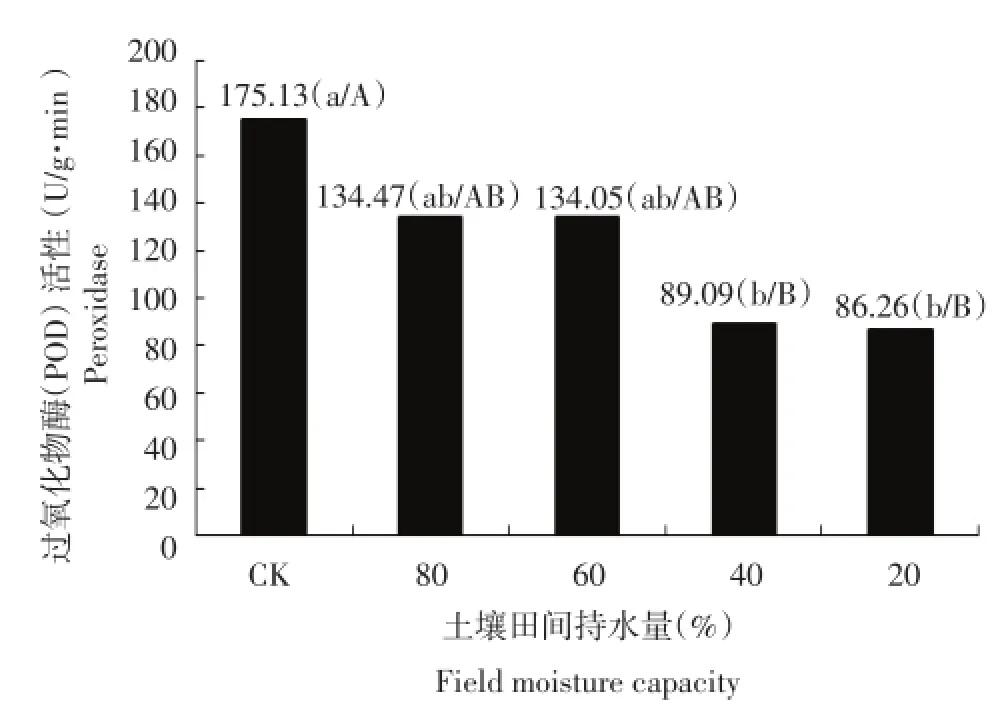
图3 干旱胁迫对每个处理过氧化物酶(POD)活性的影响Figure 3Effect of drought stress on activity of peroxidase(POD)in each treatment
2.2.3 干旱胁迫对马铃薯叶片丙二醛(MDA)含量的影响
丙二醛(MDA)是细胞膜脂过氧化的产物,在正常情况下细胞内的MDA含量很低,当细胞受到逆境胁迫时,细胞膜发生氧化分解,MDA大量积累,会严重损伤生物膜,所以MDA含量可以作为细胞受自由基伤害的重要指标。由图4可以看出,随着干旱胁迫的加剧,各个处理比对照都有所升高,其中干旱胁迫较为严重的土壤含水量40%和20%两个处理的MDA浓度上升极显著,说明随着干旱胁迫的加剧,植物体内产生的MDA含量积累增高。
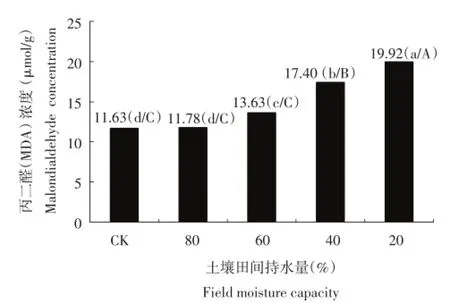
图4 干旱胁迫对每个处理丙二醛(MDA)浓度的影响Figure 4Effect of drought stress on malondialdehyde (MDA)concentration in each treatment
2.3 干旱胁迫对马铃薯叶片光合特性的影响
2.3.1 干旱胁迫对马铃薯叶片净光合速率的影响
由图5可看出,干旱胁迫后的净光合速率呈下降趋势,土壤含水量为80%时的净光合速率与对照基本持平,土壤含水量为土壤田间最大持水量的40%和20%时的净光合速率极显著低于对照,土壤含水量为土壤田间最大持水量的60%的净光合速率与正常供水情况下变化不大。说明随着干旱胁迫的加剧,马铃薯的净光合速率急剧下降,光合作用能力下降,根系吸收营养物质减少,光合产物减少,有机物质积累下降。
2.3.2 干旱胁迫对马铃薯叶片蒸腾速率的影响
蒸腾作用是植物对水分吸收和运输的一个主要动力,能促进植物对矿物质的吸收和运输,并能降低植物体和叶片的温度。由图6可知,干旱胁迫处理后土壤含水量为土壤田间最大持水量的80%时蒸腾速率与对照之间变化不大,各处理的蒸腾速率呈下降趋势,土壤含水量为土壤田间最大持水量的40%处理的蒸腾速率显著的低于对照,土壤含水量为土壤田间最大持水量的20%处理的蒸腾速率极显著低于对照。说明随着土壤水分的减少蒸腾作用随之减弱。
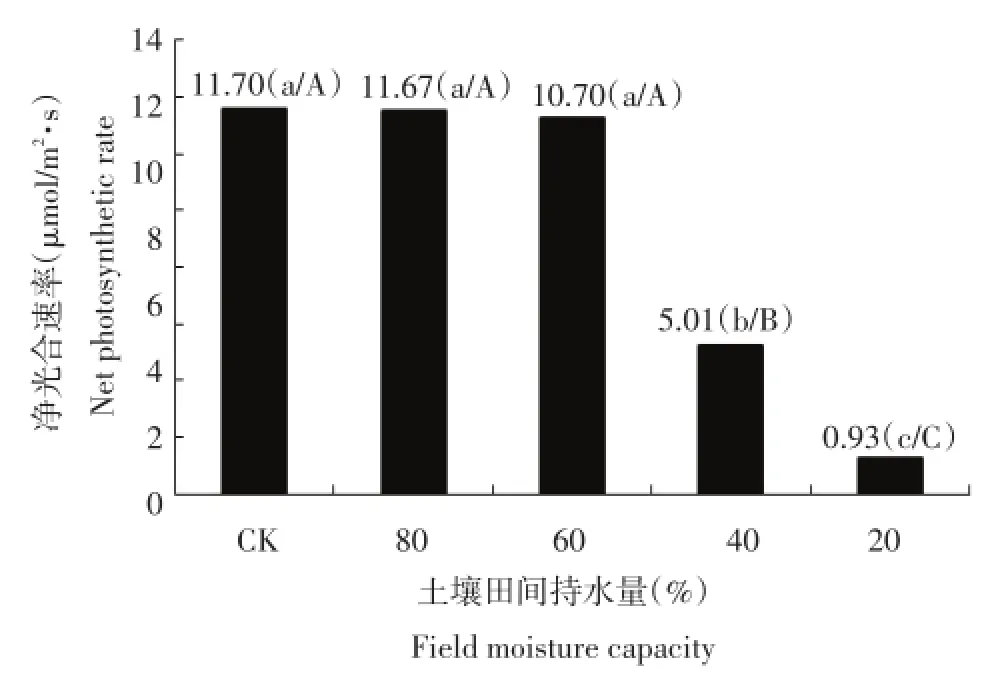
图5 干旱胁迫对每个处理净光合速率的影响Figure 5Effect of drought stress on net photosynthetic rate in each treatment
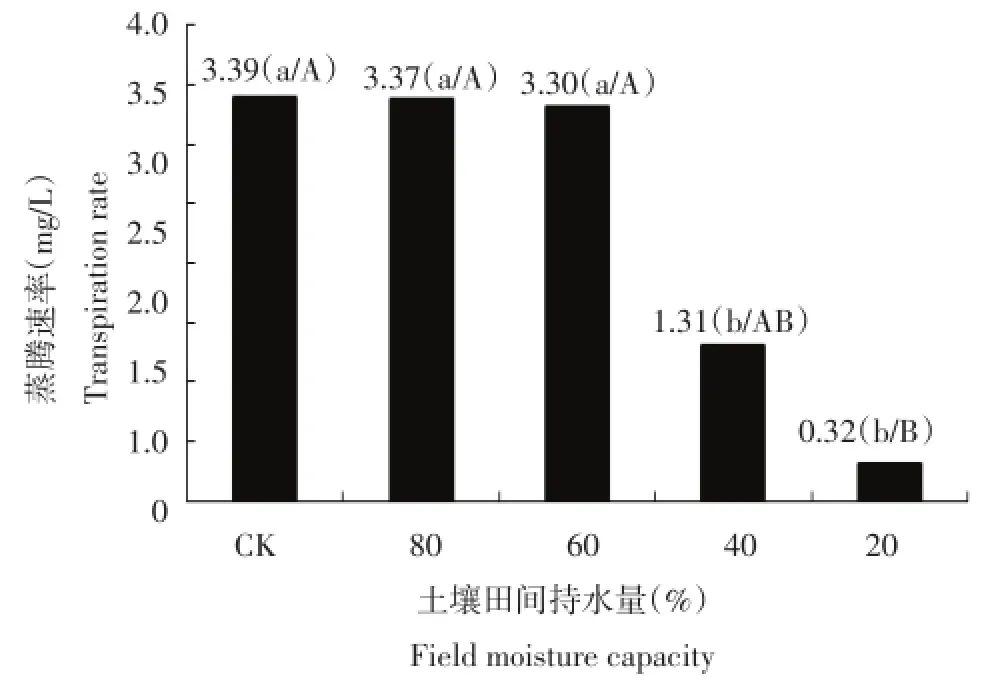
图6 干旱胁迫对每个处理蒸腾速率的影响Figure 6Effect of drought stress on transpiration rate in each treatment
2.3.3 干旱胁迫马铃薯叶片气孔导度的影响
气孔是植物叶片与外界进行气体交换的主要通道,气孔导度表示气孔张开的程度,影响光合作用,呼吸作用和蒸腾作用。结合图5、图6和图7可知,干旱胁迫处理后气孔导度呈下降趋势,土壤含水量为土壤田间最大持水量的80%时的气孔导度比较接近对照,土壤含水量为土壤田间最大持水量的40%和20%两个处理的气孔导度显著低于对照,表明水分影响气孔的开度,水分急剧减少时,植物为了维持自身的水分平衡,气孔开度减小,气孔导度降低。
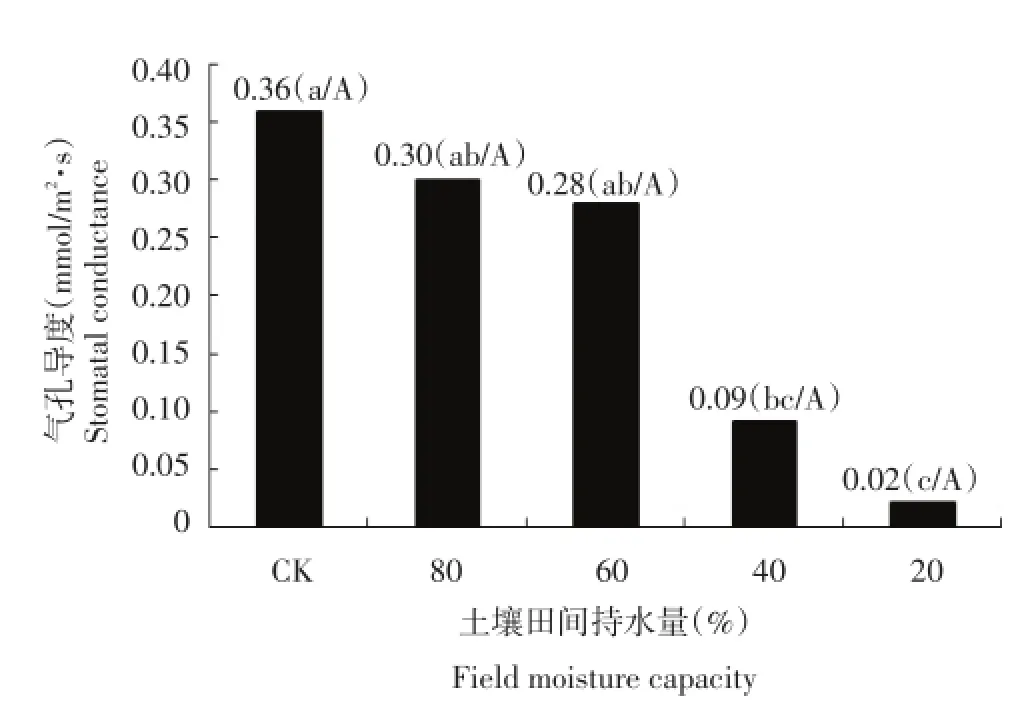
图7 干旱胁迫对每个处理气孔导度的影响Figure 7Effect of drought stress on stomatal conductance in each treatment
2.3.4 干旱胁迫对马铃薯叶片细胞胞间隙CO2浓度的影响
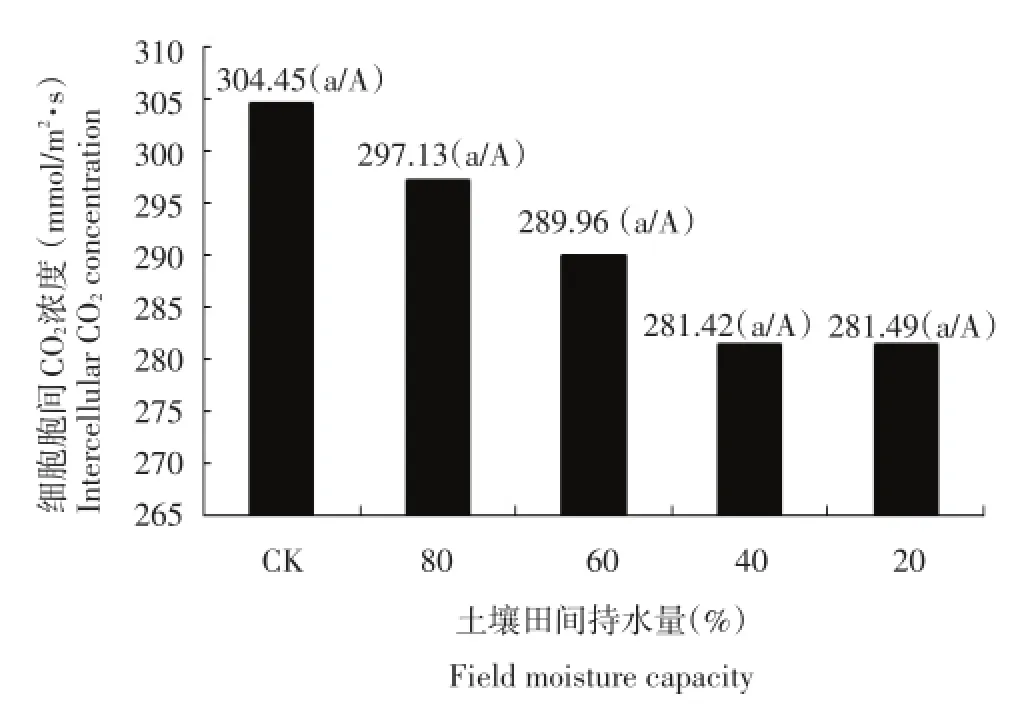
图8 干旱胁迫对每个处理细胞胞间CO2浓度的影响Figure 8Effect of drought stress on CO2concentration in each treatment
CO2是植物光合作用的原料。由图8可以看出,土壤含水量为土壤田间最大持水量的80%的细胞胞间CO2浓度与对照相比变化不大,随着干旱胁迫的加剧,细胞胞间隙CO2浓度随之下降,低于对照。说明随着干旱胁迫加剧,光合作用减弱,气孔导度降低,细胞胞间隙CO2浓度减小。在土壤含水量达到20%时,引起光合结构破坏或光合过程受阻,从而使植株对CO2的同化能力明显减弱,表现为叶肉细胞间的CO2浓度小幅增加。
3 讨论
作物的产量和品质受环境条件的影响,结合图1和图2,说明随着干旱胁迫的加剧,马铃薯块茎的产量下降,这与杨贵羽等[20]的研究结果相一致。干旱胁迫下,光合产物运输与分配受阻,阻碍了马铃薯的生长,最终导致产量下降[21]。
由图2~4可以看出,干旱胁迫下马铃薯细胞内清除活性氧的保护性酶(SOD和POD)的活性发生变化,马铃薯SOD的活性降低,在土壤含水量为土壤田间最大持水量的20%处理条件下下降极显著,说明植株内缺乏SOD保护植物细胞,使得植物在干旱胁迫加剧的情况下受到自由基的损伤加重;马铃薯的POD活性下降,且随着干旱胁迫的加剧并在土壤含水量为土壤田间最大持水量的40%和20%时下降极为显著,POD的下降充分说明,随着干旱胁迫的加剧,植株体内活性氧自由基增加,POD活性降低,无法去除活性氧自由基;MDA在干旱胁迫加剧的情况下极显著增高,大量积累。
由图4~7可以看出,植物生长特征的变化是干旱过程中植物外部形态上对干旱胁迫的响应。干旱胁迫降低了云南省主栽马铃薯品种‘会-2’的净光合速率、气孔导度、蒸腾速率和细胞胞间CO2浓度,试验中土壤含水量为土壤田间最大持水量的40%和20%的干旱胁迫处理土壤水分较少,气孔导度降低,导致净光合速率和蒸腾速率同时下降,以阻碍进一步失水,并且细胞中的CO2累积减少,这是植物对水分不足的一种适应性水分生理调节现象[22]。所以,干旱胁迫对马铃薯品种‘会-2’的净光合速率、气孔导度、蒸腾速率和细胞胞间CO2浓度有负面影响[23]。
本研究以云南省主栽马铃薯品种‘会-2’为材料,通过对盆栽马铃薯划分5个土壤含水量进行干旱胁迫,并通过对生物产量性状、净光合速率、蒸腾速率、气孔导度、细胞胞间隙CO2的浓度、SOD活性、POD活性、MDA浓度的测定,研究干旱胁迫对马铃薯抗氧化酶活性和光合特性的影响。结果表明:随着干旱胁迫的加剧,马铃薯块茎产量下降比较明显,干旱胁迫下有机物积累下降,植物生长受到限制;在光合特性方面,净光合速率、气孔导度、蒸腾速率和细胞胞间隙CO2浓度降低,干旱胁迫下,细胞失水,气孔关闭,限制CO2吸收,蒸腾速率减弱,从而影响光合作用的速率;干旱胁迫会诱导抗氧化酶活性的降低,减弱抗氧化酶对活性氧的清除能力,导致危害植物的MDA大量积累。
[1]杨万林.云南省马铃薯生产现状及资源组成分析[J].中国马铃薯,2004,18(3):187-188.
[2]孙茂林,李云海,李先平.云南马铃薯栽培历史、耕作制度和民族特色的地方品种资源[J].中国农史,2004,23(4):13-17.
[3]康绍忠.新的农业科技革命与21世纪我国节水农业的发展[J].干旱地区农业研究,1998,16(1):11-17.
[4]周党卫,朱文琰,滕中华,等.不同海拔珠芽蓼抗氧化系统的研究[J].应用与环境生物学报,2003,9(5):489-492.
[5]Wildi B,Lutz C.Antioxidant composition of selected high alpine plant species from different altitudes[J].Plant,Cell and Environment, 1996,19:138-146.
[6]罗海平.水稻光合作用特性研究进展[J].湖南农业科学,2007 (3):43-45.
[7]杨丽涛,陈超君,李杨瑞.田间生长条件甘蔗光合特性的研究[J].西南农业学报,2001,14(2):69-74.
[8]卢存福,贲桂英.高海拔地区植物的光合特性[J].植物学通报, 1995,12(2):38-42.
[9]栗忠飞,郑征.西双版纳不同海拔4种雨林幼苗的光合特性和生物量[J].热带亚热带植物学报,2009,17(6):519-527.
[10]王婷,海梅荣,罗海琴,等.水分胁迫对马铃薯光合特性和产量的影响[J].云南农业大学学报,2010,25(5):737-743.
[11]范敏,金黎平,刘庆昌,等.马铃薯抗旱机理及其相关研究进展[J].中国马铃薯,2006,20(2):101-107.
[12]任光俊,陆贤军,高方远,等.作物光合作用的遗传与产量改良[J].西南农业学报,2004,17(1):102-105.
[13]Летухов С Н,陶金萍,张相英.马铃薯抗旱性状的遗传[J].杂粮作物,2O00,20(6):11-13.
[14]关义新,戴俊英.水分胁迫下植物光合叶片的气孔与非气孔限制[J].植物生理学通讯,1995,31(4):293-297.
[15]高占旺,庞万福,宋伯符.水分胁迫对马铃薯的生理反应[J].马铃薯杂志,1995,9(1):1-5.
[16]杨先泉,张佳,倪苏,等.持续干旱胁迫对不同马铃薯基因型产量形成的影响[J].西南农业学报,2011,4(3):854-857.
[17]朱永平.生物统计学试验教程[M].云南:云南科技出版社, 2006.
[18]Bush P S,Ashoo S,Sukumaran N P.Photosynthetic rate and chlorophyll fluorescence in potato leaves induced by water stress [J].Photosynthetica,1998,35(1):13-19.
[19]抗艳红,赵海超,龚学臣,等.不同生育期干旱胁迫对马铃薯产量及品质的影响[J].安徽农业科学,2010,38(30):16820-16822.
[20]杨贵羽,罗远培,李保国.苗期土壤含水率变化对冬小麦根、冠、生物量累积动态的影响[J].农业工程学报,2004,20(2): 83-87.
[21]Schneider A,Salamini F,Gebhardt C.Expression patterns and promoter activity of the cold-regulated gene ci21A of potato[J]. Plant Physiology,1997,113(2):335-345.
[22]Zhu L H,Xing Y X,Yang L T,et al.Effects of water stress on leaf water and chlorophyll fluorescence parameters of sugarcane seedling[J].Agricultural Science&Technology,2010,11(5): 17-21.
[23]Kirch H H,Jochen V B,Heike G,et al.Structural organization, expression and promoter activity of a cold-stress-inducible gene of potato Solanum tuberosum L.[J].Plant Molecular Biology, 1997,33:897-909.
大庆金辉农业科技开发有限公司
大庆金辉农业科技开发有限公司成立于2012年3月15日,是一家以农业科技开发、农业机械设备、化肥研发与销售为项目的私营公司,总部位于大庆国家级高新技术产业开发区。公司以服务三农为宗旨,以质量和诚信求生存,以科技创新求发展,以广交天下朋友为理念,以农民增收为己任,始终以农业生产者的市场需求为导向,以解决生产中出现的实际问题为立足之本。
公司本着节约就是增效的观念,重点研究并生产的产品有信丰圆牌马铃薯中微量元素水溶肥;防治早晚疫病高效、低成本新型复配药剂(亩成本低于10元/次);防治除草剂药害(包括前茬、封闭及苗后除草剂使用不当引起的)的专用药剂;马铃薯种薯繁育专用播种机、收获机等;脱毒马铃薯,品种有鲜薯食用型中晚熟品种‘克新13号’、‘克新18号’;淀粉加工专用型品系‘ND0702-49’;早熟品种‘早大白’、‘尤金’、荷兰系列、‘中薯5号’和‘龙引薯1号’等。
此外,公司还重点发展以下几方面的业务:
针对各地区的土壤类型及养分含量,结合马铃薯的需肥规律,为客户制订一整套科学合理的立体化平衡施肥技术体系。
根据各地区的气候特点制订早晚疫病综合防治技术体系(包括高效低成本早晚疫病防治药剂)。
致力于马铃薯种薯繁育技术体系及种薯质量控制技术研究,可根据客户的需求,对马铃薯种薯生产进行全程指导。
联系地址:大庆市高新区火炬新街40号邮编:163310
联系人:金光辉邮箱:dqjhny@163.com
联系电话:0459-6280535 13946967350
Effects of Drought Stress on Physiological Characteristics of Potato(Solanum tuberosum L.)
HAI Meirong1,CHEN Yong2,ZHOU Ping1,WANG Li1,LIU Fucui1,TANG Tianxiang1,DABU Xilatu3*
(1.College of Agronomy and Biotechnology,Yunnan Agricultural University,Kunming,Yunnan 650201,China;
2.Weixi Agricultural Technique Extension Center,Weixi,Yunnan 674600,China;
3.College of Resources and Environment,Yunnan Agriculture University,Kunming,Yunnan 650201,China)
Drought stress is one of the most serious natural disasters,affecting the growth,development and reproduction of plants.It could also lead to the plant physiological and biochemical changes.Drought in Yunnan Province occurs more frequently in recent years,and an experiment was designed thereafter using potato(Solanum tuberosum L.) variety‘Hui-2’as experimental material to investigate the effects of drought stress on the activity of antioxidant enzymes and photosynthetic characteristics in potato,which might provide a theoretical base for stable and high yielding production of potato in a drought environment.The results showed that yield decreased with the drought stress deteriorating.Also, the net photosynthetic rate in leaf reduced due to the decline in stomatal conductance,transpiration rate and intercellular CO2concentration.The results indicated that drought stress reduced antioxidant enzyme activity,and its scavenging capacity of active oxygen,resulting in a large number of malondialdehyde,which might harm the potato plants.
drought stress;potato;antioxidant enzyme activity;photosynthetic characteristic
S532
B
1672-3635(2014)04-0199-06
2014-04-22
国家自然科学基金(31201147)。
海梅荣(1973-),女,副教授,博士,主要从事马铃薯生理生态研究。
达布希拉图,副教授,博士,主要从事植物营养学研究,E-mail:49024470@qq.com。

