2类多巴胺受体对心肌缺血后处理保护作用的影响及机制*
李鸿珠,高 君,郝晓敏,张丽敏,陈俊亭
缺血后处理(ischemic postconditioning,PC)是指心肌缺血后,在再灌注早期,对心脏进行重复几次短暂的再灌注/缺血循环的处理方法[1]。动物实验已证实此方法能减轻再灌注后心肌的损伤[2]。
多巴胺受体(dopamine receptor,DR)属于七个跨膜区域组成的G蛋白偶联受体家族[3],根据多巴胺受体的生化和药理学特性,将其分为D1样和D2样受体,其中D1样受体又可分为D1和D5受体亚型,主要位于突触后,受体与腺苷酸环化酶正性耦联,与G蛋白中刺激亚单位(Gs)结合,激活腺苷酸环化酶(AC),使cAMP增高,刺激磷脂酶C,从而激活钙通道,使细胞内钙增高[3]。D2样受体可分为 D2、D3、D4受体亚型,分别位于突触前和突触后,与腺苷酸环化酶负性耦联,与 Gi/Gq作用,抑制AC,使 cAMP降低,抑制钙通道,调节钾通道[3]。当今国内外对于DR的研究多集中在精神神经系统,心血管系统对于DR的研究较少,主要涉及其对高血压、心脏骤停等影响[4]。我们在前期研究中发现,在大鼠心肌缺血/再灌注损伤过程中,DR2表达增加[5];DR2激活通过抑制线粒体、死亡受体途径及MAPK通路减轻乳鼠心肌细胞缺血/再灌注损伤及通过促进PKCε转位参与大鼠缺血后处理的心肌保护作用[6-9]。但是,DR2激活在培养的乳鼠心肌细胞的缺血后处理中的作用及机制尚未见报道。因此,本实验利用原代培养乳鼠心肌细胞建立缺血后处理模型,探讨DR2激活在心肌缺血后处理中的作用及相关机制,这将为缺血性心脏病的防治提供新思路和新靶点。
1 材料与方法
1.1 实验动物
Wistar乳鼠(2~3 d,雄性,8~15 g),由哈尔滨医科大学实验动物中心提供。
1.2 主要试剂
Bromocriptine(Bro)和 Haloperidol(Hal,Sigma),Western及IP细胞裂解液(Beyotime),DMEM培养液(Hyclone),DR2抗体(Satan),p38、p-p38、JNK、p-JNK抗体(Cell Signaling Technology),LDH、SOD、MDA测定试剂盒(南京建成),Anexin-V凋亡检测试剂盒(北京宝赛),其它试剂均为分析纯。
1.3 主要器材
高速低温离心机(Beckman),US-640型紫外分光光度计(Beckman),倒置相差显微镜(Olympus),培养箱 MCO-17AICO2(SANYO),Western blot电泳槽(美国BIO-RAD),S-1300-U净化工作台等。
1.4 原代心肌细胞培养
用70%的酒精浸泡消毒Wistar乳鼠,开胸取心,D-Hank’s液清洗2次,剪碎放入10 ml离心管中;加入心肌5倍体积的0.25%胰酶,37℃水浴消化12min,共消化4~5次;除第一次外,每次收集的细胞悬液,放入等体积的高糖DMEM培养液终止消化后,1500 r/min离心 15 min,弃上清,用含 10%胎牛血清的高糖DMEM培养液将沉淀吹打为单细胞悬液,经200目筛网过滤去除未消化组织块。用差速贴壁分离法去除成纤维细胞,将纯化心肌细胞计数后,以 5×106cells/cm2接种于培养皿中,37℃、5%CO2条件下孵育培养。隔天换液,取第4天的细胞进行实验。
1.5 心肌细胞缺血后处理模型的建立及分组
正常对照组(Control):细胞正常培养,未施加任何因素,培养时间同实验组;模拟缺血/再灌注组(ischemia/reperfusion,I/R):心肌细胞模拟缺血 3 h,再灌6 h处理。(模拟缺血缺氧液为无血清、无糖培养基,pH=6.8,置于缺氧罐中,通入 95%N2,5%CO2);模拟缺血后处理组(ischemic postconditioning,PC):方法同缺血/再灌注组,在缺血结束再灌前连续进行3次5 min间隔的再灌注/再缺血处理,继之恢复持续灌注;PC+DR2激动剂(Bromocriptine,Bro)组(PC+Bro):同缺血后处理组,在再灌注前10 min加入 Bro,后同 PC组;PC + DR2抑制剂(Haloperidol,Hal)组(PC+Hal):同缺血后处理组,在再灌注前10min加入Hal,后同PC组;PC+DR2抑制剂+DR2激动剂组(PC+Hal+Bro):方法同缺血后处理,在再灌注前20 min加入Hal,在再灌注前10min注入 Bro。
1.6 Western blot检测蛋白表达情况
取各组心肌细胞,PBS洗涤后加入全细胞裂解液,冰浴 40 min,4℃,15 000 r/min离心 15 min,取上清进行蛋白质定量。取50μg蛋白样品于10%SDSPAGE凝胶电泳;随后转印于 PVDF滤膜上,用5%脱脂奶粉,37℃封闭1 h;用封闭液稀释一抗,4℃震荡过夜;TBST稀释二抗(1/2 000的羊抗兔IgG二抗,碱性磷酸酶标记),室温振荡孵育2 h;最后显色,凝胶成像系统下拍照,计算条带光密度值,蛋白表达水平以其与GAPDH光密度比值来表示。
1.7 LDH、SOD活力及 MDA含量的测定
取各组细胞的培养液,用考马斯亮蓝法测定蛋白浓度:标准品为牛血清白蛋白;按试剂盒说明书操作;紫外分光光度计上读出吸光度(OD)值,计算细胞的LDH和SOD活力以及MDA水平。
1.8 透射电镜观察心肌细胞形态学改变
用0.25%胰酶消化细胞 4 min,PBS洗涤1次,2 000 r/min离心 10 min后弃上清收集细胞;4℃,2.5%戊二醛固定;1%锇酸固定,常规乙醇、丙酮逐级脱水,环氧树脂包埋,超薄切片,铅铀双重染色,透射电镜下观察心肌细胞的超微结构并摄片。
1.9 流式细胞仪检测细胞凋亡情况
取各组心肌细胞,0.25%胰酶消化,PBS洗涤2次后调整细胞密度为1×106cells/L,制成单细胞悬液;加入由100μl Binding Buffer和 FITC标记的Annexin-V(20μg/ml)10μl,室温避光 30min;加入 PI(50 μg/ml)5μl,避光 5 min;加入 400μl Binding Buffer,立即用流式细胞仪(FACScan)进行定量检测。
1.1 0 统计学分析
实验数据以均值±标准差(¯x±s)表示,全部数据统计采用SPSS 10.1统计软件包进行,采用方差分析及配对t检验判断其差异显著性。
2 结果
2.1 不同组DR2蛋白表达变化
(1)DR2蛋白表达变化用 DR2/GAPDH表示,与Control组(0.49±0.06)相比,I/R组 DR2蛋白表达增加(0.74±0.11,P<0.01);(2)与 I/R组比较,PC组 DR2蛋白表达进一步增加(1.19±0.10,P<0.01);(3)Bro上调 PC引起的 DR2蛋白表达增加(1.86±0.07),Hal则可取消 Bro的这种作用(0.77±0.08,图 1)。

Fig.1 Protein levels of DR2(n=4)I/R:Ischemia/reperfusion;PC:Ischemic postconditioning;PC+Bro:Ischemic postconditioning+Bromocriptine;PC+Hal:Ischemic postconditioning+Haloperidol;PC+Hal+Bro:Ischemic postconditioning+Haloperidol+Bromocriptine**P<0.01 vs controlgroup;##P<0.01 vs I/R group;△△P<0.01 vs PC group;▲▲P<0.01 vs PC+Bro group
2.2 不同组LDH和SOD活性以及MDA含量的变化
(1)与 Control比较,I/R显著增加 LDH活性和MDA含量,降低 SOD活性(P<0.01);(2)与 I/R组比较,PC显著降低LDH活性、MDA含量,升高SOD活性(P<0.01);(3)与 PC组比较,Bro进一步降低LDH活性、MDA含量,升高 SOD活性(P<0.01),Hal则可取消Bro的这种作用(表1)。
2.3 各组心肌细胞超微结构变化
Control组:核膜清楚,染色质均匀分布,线粒体结构完好;I/R组:线粒体肿胀和空泡化,肌丝溶解,脊断裂,细胞核固缩,染色质高度凝聚、边缘化;PC组:核膜结构较完好,染色质部分凝聚,少量线粒体空泡化;PC+Bro组:细胞损伤程度较PC组减轻;PC+Hal和PC+Hal+Bro组:细胞超微结构变化同PC组相似(图 2)。

Tab.1 Changes of LDH and SOD activity and MDA content in cellmedium(¯x±s,n=8)

Fig.2 The ultrastructure of cardiomyocytes using transmission electronmicroscopy(×8 000)A:Control;B:Ischemia/reperfusion(I/R);C:Ischemic postconditioning(PC); D: Ischemic postconditioning+Bromocriptine(PC+Bro);E:Ischemic postconditioning+Haloperidol(PC+Hal);F:Ischemic postconditioning+Haloperidol+Bromocriptine
2.4 流式细胞仪检测细胞凋亡率
(1)正常组心肌细胞凋亡率仅为 6.53%±0.57%;(2)I/R组心肌细胞凋亡率为 65.63% ±2.89%,明显高于正常对照组(P<0.01);(3)与 I/R组比较,PC组心肌细胞凋亡率明显减少(54.50%±1.72%,P<0.01);(4)与 PC组比较,Bro进一步降低细胞凋亡率(30.71%±2.41%,P<0.01);Hal则取消 Bro的这种作用(41.81%±2.63%,图 3)。
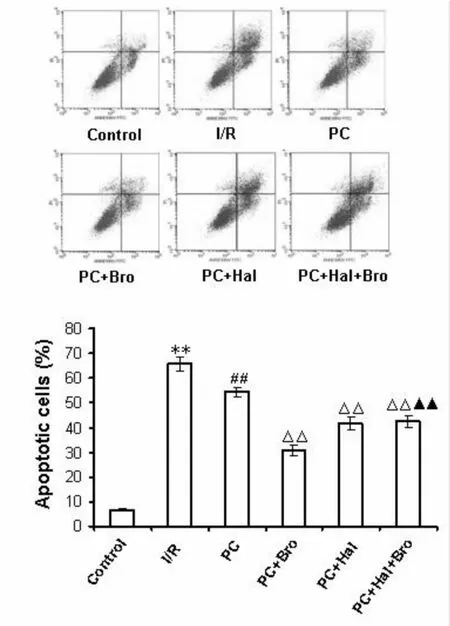
Fig.3 Detection the apoptosis rate of cardiomyocytes by FCM(n=6)I/R:Ischemia/reperfusion;PC:Ischemic postconditioning;PC+Bro:Ischemic postconditioning+Bromocriptine;PC+Hal:Ischemic postconditioning+ Haloperidol;PC+Hal+Bro:Ischemic postconditioning+Haloperidol+Bromocriptine**P<0.01 vs control group;##P<0.01 vs I/R group;△△P<0.01 vs PC group;▲▲P<0.01 vs PC+Bro group
2.5 Western blot检测各组p-p38和p-JNK活性的变化
(1)与正常组相比,I/R增加 p-p38和 p-JNK的活性(P<0.01);(2)与 I/R组比较,PC降低 p-p38和p-JNK的活性(P<0.01);(3)与 PC组比较,Bro进一步降低p-p38和p-JNK的活性,Hal则可取消Bro的这种作用(图 4,表 2)。

Fig.4 The changes of p-p38 and p-JNK activities in defferent groups(n=4)C:Control;I/R:Ischemia/reperfusion;PC:Ischemic postconditioning; PC + Bro: Ischemic postconditioning +Bromocriptine; PC+ Hal: Ischemic postconditioning +Haloperidol;PC+Hal+Bro:Ischemic postconditioning+Haloperidol+Bromocriptine

Tab.2 Results analysis of p-p38 and p-JNK expressions in cardiomyocytes from different groups(¯x±s,n=4)
3 讨论
缺血性心脏病严重危害人类健康,尽早恢复血流是减轻缺血心肌损伤的关键,但是再灌注疗法受缺血组织血管再通时间的限制,并存在再灌注损伤等问题。因此,减轻再灌注损伤成为医学界亟待解决的重大问题[10,11]。2003年,Zhao等在犬心肌缺血后再灌注前进行3次30 s的再灌注,保护冠状动脉内皮功能,限制心肌梗死范围,称为缺血后处理[1]。目前已在多种属动物模型上证实缺血后处理是在缺血后实施的强有力的内源性心脏保护现象,但机制不详。本实验利用乳鼠心肌细胞建立缺血后处理模型,观察DR2激活在心肌缺血后处理中的作用并探讨其机制。
透射电镜结果显示:在I/R后乳鼠心肌细胞出现线粒体肿胀和空泡化,肌丝溶解,脊断裂,细胞核固缩,染色质高度凝聚、边缘化;同时,细胞培养液中LDH漏出增多。这些结果均表明I/R导致心肌细胞发生明显的损伤。LDH外漏程度可反映细胞损伤程度;SOD活性可反映机体清除自由基和抗脂质过氧化的能力;MDA含量可反映氧自由基产生和组织的受损程度。本研究结果显示:与Control组相比,I/R组培养液中MDA含量显著增加、SOD活性明显降低,这表明I/R性心肌损伤与自由基生成增多有关。与I/R组比较,PC组LDH活性和MDA含量显著降低,SOD活性明显升高;并且透射电镜结果显示:核膜结构较完好,染色质部分凝聚,少量线粒体空泡化;这说明PC可减轻心肌细胞I/R损伤,其机制与清除自由基相关。
大量动物实验和临床研究证明,PC可诱导触发因子释放,经多条细胞内信号转导途径的介导,作用于多种效应器,影响氧自由基产生、钙超载等I/R损伤的关键环节而发挥心肌细胞保护作用[11]。主要的信号通路包括磷脂酰肌醇3激酶(phosphoinositide-3 kinase,PI3K)、丝裂素活化蛋白激酶(mitogenactivated protein kinases,MAPKs)、蛋白激酶 C(protein kinase C,PKC)、蛋白激酶 G(protein kinase G,PKG)、蛋白激酶A(protein kinase A,PKA)、酪氨酸激酶和JAK/STAT等[11]。
MAPKs通路是生物体内重要的信号转导系统之一,参与细胞生长、分裂、分化、增殖、凋亡等多种生理过程[7],其主要包括 ERK、p38和 JNK三条途径,其中,ERK被激活后主要与细胞增殖与分化相关,p38与 JNK被激活后主要与细胞凋亡相关[12]。本研究结果显示:I/R组心肌细胞凋亡率显著升高,p-p38和p-JNK活性均明显上调,而PC降低细胞凋亡率,下调p-p38、p-JNK的活性,这表明 PC通过抑制p-p38和p-JNK的活性减轻心肌细胞I/R损伤诱导的细胞凋亡。
本实验结果还显示:Bro(DR2的激动剂)可进一步增加PC减轻心肌I/R诱导的细胞损伤和凋亡以及增强机体的抗氧化能力;另外,Bro也可增强PC抑制p-p38和p-JNK活性的能力。
本实验过程中,PC处理的各组比Control和I/R组所用时间延长15 min,但是众所周知,PC对 I/R损伤具有保护作用,因此,与I/R组相比,PC处理的各组的心肌损伤是减轻的。
综上所述,DR2激活参与PC减轻心肌I/R诱导的细胞损伤和凋亡,其机制与下调p-p38和p-JNK的活性有关。结合我们前期实验结果,激活心肌DR2有望为缺血性心脏病的防治提供新靶点。
[1] Zhao ZQ,Corvera JS,Halkos ME,et al.Inhibition ofmyocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003,285(2):H579-H588.
[2] Yang XM,Proctor JB,Cui L,et al.Multiple brief coronary occlusions during early reperfusion protect rabbit hearts by targeting cell signaling pathways[J].J Am Coll Cardiol,2004,44(5):1103-1110.
[3] LiHZ,Han LP,Jiang CM,etal.Effectof dopamine receptor-1 on apoptosis of cultured neonatal rat cardiomyocytes in simulated ischemia/reperfusion[J].Basic Clin Pharmacol Toxicol,2008,102(3):329-336.
[4] 李鸿珠,高 君,白淑芝,等.1类多巴胺受体活性变化对细胞凋亡 Fas/Fas-L通路的影响 [J].哈尔滨医科大学学报,2011,45(2):103-108.
[5] 李鸿珠,徐长庆,韩丽萍,等.大鼠心肌多巴胺受体在缺氧-复氧时表达变化及其意义 [J].中国病理生理杂志,2007,23(12):2322-2326.
[6] LiHZ,Guo J,Gao J,etal.Role of dopamine D2 receptors in ischemia/reperfusion induced apoptosisof cultured neonatal rat cardiomyocytes[J].JBiomed Sci,2011,18:18.
[7] 高 君,魏 璨,陈爱东,等.2类多巴胺受体激活对细胞凋亡的影响及与MAPK通路的关系[J].中华临床医师杂志(电子版),2013,7(11):4878-4882.
[8] Gao J,Guo J,LiH,etal.Involvementof dopamine D2 receptors activation in ischemic post-conditioning-induced cardioprotection through promoting PKC-εparticulate translocation in isolated rathearts[J].Mol Cell Biochem,2013,379(1-2):267-276.
[9] 魏 璨,高 君,陈爱东,等.多巴胺受体(DR2)激活对乳鼠心肌细胞缺氧再灌注损伤的保护作用及其机制[J].中国应用生理学杂志,2013,29(4):289-293.
[10]景友玲,王艳蕾,段国贤,等.缺血预处理对肢体缺血/再灌注时肺损伤的保护作用[J].中国应用生理学杂志,2011,27(1):19-22.
[11]刘秀华.缺血后处理内源性心脏保护的研究进展[J].生理学报,2007,59(5):628-634.
[12]陈建勇,王 聪,王 娟,等.MAPK信号通路研究进展 [J].中国医药科学,2011,1(8):32-34.

