心房肌胞内钙浓度变化对心房颤动患者小电导钙激活钾通道电流的影响*
王 华,李 涛,张 丽,李妙龄,杨 艳,曾晓荣
心房颤动(atrial fibrillation,AF)的临床发病率逐年增加,严重危害人类的健康。目前对AF的主要治疗方法有药物治疗、介入治疗、手术治疗,但治疗效果并不理想,这与AF机制不明有关。AF发生机制包括:“折返”学说、“驱动伴颤动样传导”学说、“肺静脉波”学说和“房颤致房颤”理论。
AF的发生与动作电位的时程和形态密切相关,而动作电位时程和形态则由心肌细胞上不同的离子通道活动决定。小电导钙激活钾通道(small conductance Ca2+-activated K+channels,SK)是钙激活钾通道中的一种,具有钾离子选择性、钙敏感性、电压不依赖的特性。SK2通道是SK通道的一种亚型,分布在多种组织和器官,如脑组织、平滑肌、骨骼肌和心肌,在哺乳动物心房中的表达比心室更为丰富[1]。在SK2通道的特异性阻断剂apamin作用下,心房肌细胞动作电位的终末期形态发生改变,动作电位时程明显延长,表明SK2通道在心脏动作电位的复极末期发挥着重要作用[2]。因此,SK2通道在AF发生发展中的作用机制已成为当今研究的热点。本文以人心房肌细胞为研究对象,采用β-escin与二性霉素B作为穿孔液的穿孔膜片钳技术,通过改变电极液内的钙离子浓度,研究SK2通道的钙依赖特性,以及在不同的胞内游离钙离子浓度时AF患者与窦性心律(sinus rhythm,SR)患者SK2通道钙依赖的差异,阐明SK2通道钙敏感性的改变在AF发生和维持中的病理生理学意义,为防治心房颤动提供新靶点。
1 材料与方法
1.1 溶液与试剂
V型胶原酶、XXIV型蛋白酶、牛血清白蛋白、apamin、二性霉素 B、β-escin、DMSO均为 Sigma公司生产,其余试剂为国产分析纯。
1.2 患者资料
实验采用泸州医学院附属医院心胸外科行体外循环术的患者常规切除的右心耳组织作研究对象,获取标本是通过医院伦理委员会和病人家属同意。根据患者心电图结果对其分组:SR组21例(细胞 n=31),AF组 8例(细胞 n=11)。
1.3 急性酶分离人心房肌细胞
收集的新鲜标本采用改良的两步急性酶分离方法获得人心房肌细胞[3]。将分离的细胞置于KB液中4℃保持,待细胞贴壁后即可进行膜片钳实验。
1.4 通道电流的记录
本研究采用的是穿孔膜片钳的记录方式,分别配置 30mg/ml的二性霉素 B和 27.2μg/ml的β-escin的母液。实验前用电极液将β-escin和二性霉素B稀释成6.88μg/ml、150μg/ml的终浓度,混合的穿孔电极液置于4℃冰箱备用。本电极液DMSO在浴液中的终浓度为0.2%,预试实验证实对实验结果无明显影响[4]。
全 细 胞 浴 液 (mmol/L):N-methyl-glucamine(NMG)140,KCl4,MgCl21,Glucose5和 HEPES10,用HCl调至 pH 7.4。全细胞电极内液(mmol/L):Potassium gluconate 144,MgCl21.15,EGTA 5,HEPES 10,用KOH调至pH 7.25,电极液游离钙浓度用WINMAXC V2.50软件进行计算。经计算可得,当电极液中EGTA浓度是 5 mmol/L,电极液中钙浓度分别为0.86,0.92mmol/L时,游离钙离子浓度分别为 5×10-7,10-6mol/L。
将细胞悬液置于浴槽中,加入全细胞浴液待细胞贴壁后即可进行电生理实验,倒置相差显微镜下寻找贴壁、立体感强、横纹清晰、细胞膜完整、长梭形、无收缩的心肌细胞进行膜片钳实验。电流刺激方案:保持电位-55 mV,+10 mV一个阶跃,从-130 mV去极化到+50mV,脉冲持续时间200ms,在电压钳的模式下记录电流。浴液中加入SK2电流的特异性阻断剂apamin,将加药前后分别记录的具有内向整流特性的电流相减即为apamin敏感的SK2通道电流。Apamin对SK2电流最敏感,因此低浓度的apamin只能抑制SK2电流,对SK1和SK3电流不影响。
1.5 统计学处理
实验结果以均数±标准差(¯x±s)表示。膜片钳实验所得数据采用Clampex 10.1软件系统采集后储存于计算机中,经分析程序Clampfit 10.1计算出电流密度(pA/pF),用 OriginPro 8.0进行分析作图。膜片钳实验结果采用Originpro 8.0对数据进行统计分析,细胞加药前后采用自身配对 t检验,组间比较采用独立样本t检验或独立样本方差分析。
2 结果
2.1 SR组SK2通道电流的内向整流性及apam in敏感性
当电极内液的游离钙浓度为5×10-7mol/L时,给予刺激方案后,在人心房肌细胞上可以记录到一个内向整流混合电流,I-V曲线可观察到随细胞膜电位逐渐增加,电流逐渐偏离欧姆定律的线性关系。在浴液中加入10-7mol/L apamin后,内向整流混合电流逐渐减小,将加药前后分别记录的具有内向整流特性的电流相减即为apamin敏感的SK2通道电流(图 1)。
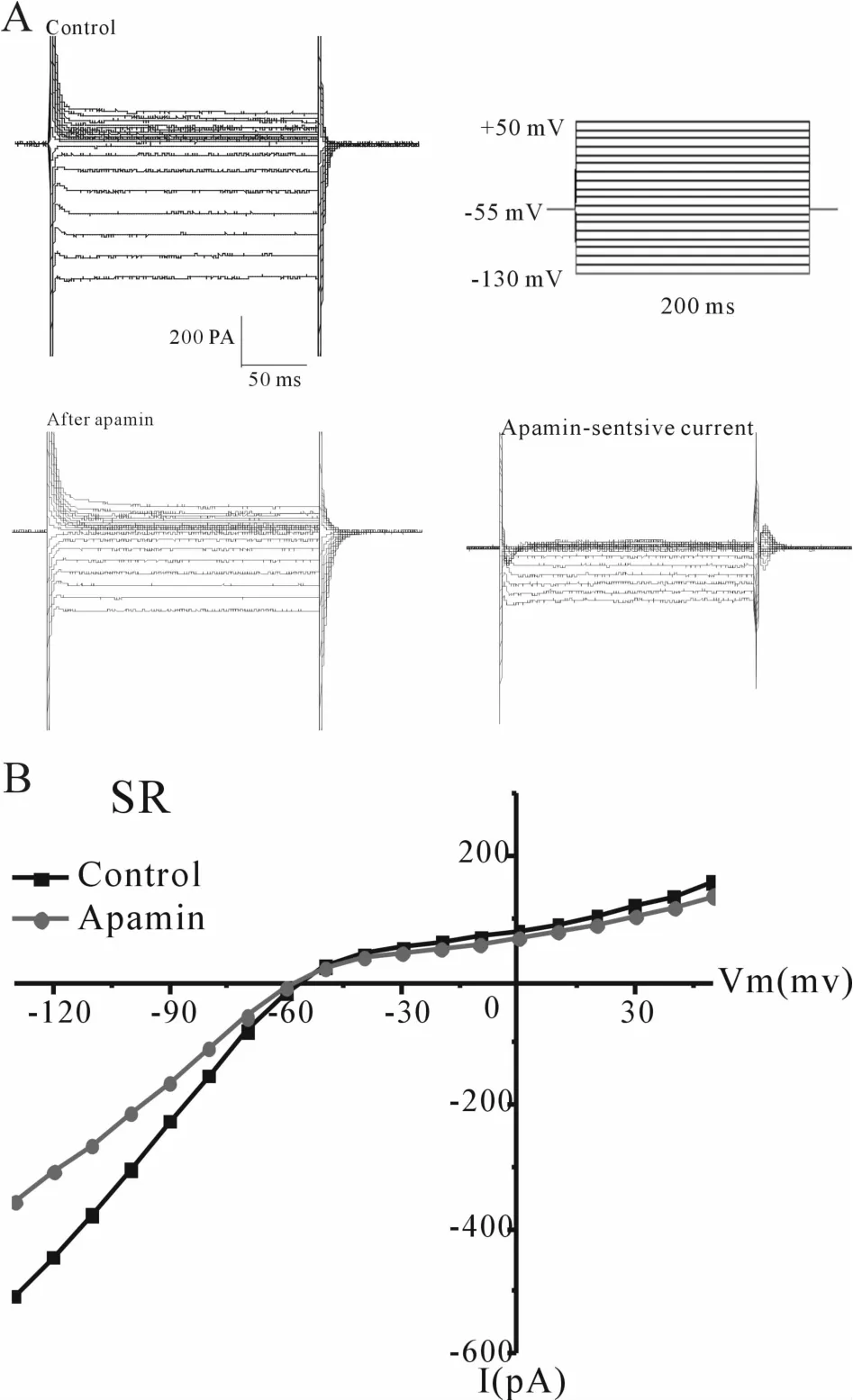
Fig.1 SK2 currents A:Inwardly rectifying and apamin-sensitive properties of SK2 currentswere recorded in SR group;B:Integrated inward currents recorded before and after application of apamin are depicted;SK2:Small conductance Ca2+-activated-K+ channels;SR:Sinus ryhthm
2.2 AF组SK2通道电流的内向整流性及apam in敏感性
在AF组患者心房肌细胞给予上述相同刺激方案和实验条件下,可以记录到一个内向整流混合电流,在浴液中加入10-7mol/L apamin后,内向整流混合电流逐渐减小,在AF患者的心肌细胞记录的SK2通道电流同样具有apamin敏感性、内向整流特性(图 2)。
2.3 SR组与AF组的SK2通道电流比较
SR组与AF组的SK2通道电流都具有内向整流性、apamin敏感性。将两组的电流密度进行统计学分析,结果证实,AF组的SK2通道电流密度明显大于SR组(nSR=6,nAF=3),差异有统计学意义(图3)。
2.4 SR组患者心房肌细胞SK2通道电流的钙敏感性
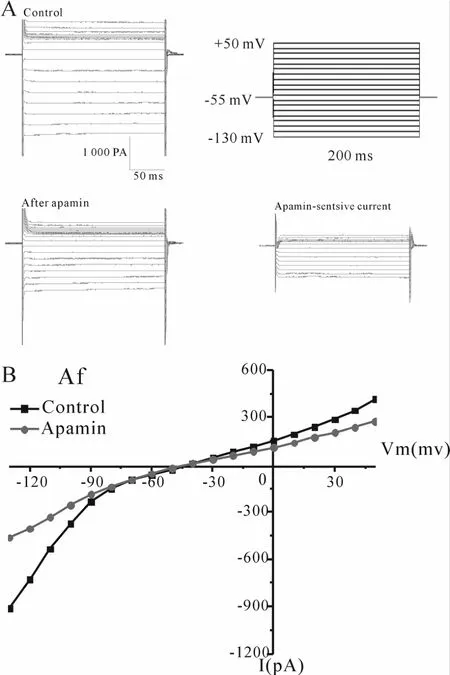
Fig.2 SK2 currents A:Inwardly rectifying and apamin-sensitive properties of SK2 currentswere recorded in AFgroup;B:Integrated inward currents recorded before and after application of apamin are depicted;SK2:Small conductance Ca2+-activiated-K+ channels;AF:Atrial fibrillation
在SR组心房肌细胞,当电极内游离钙离子浓度接近0mol/L时,有较小的SK2通道电流被激活;当电极内游离钙离子浓度靠近5×10-7mol/L,SK2通道电流不仅被激活,而且在原有的基础增大,超级化方向更为显著;当电极内游离钙离子浓度超过生理浓度达到10-6mol/L左右时,SK2通道电流在超级化方向增大极为显著(图4)。这说明SR组患者心房肌细胞的SK2通道电流具有钙依赖性,随着电极内游离钙离子的增加SK2通道电流的激活明显,通道功能增强(n0=7,=6,=8)。当电极内游离钙离子浓度达到10-6mol/L左右时,SK2电流密度与前两组相比有统计学差异(P<0.05,P<0.01)。
2.5 AF组心房肌细胞SK2通道电流的钙敏感性
在AF组心房肌细胞,当电极内游离钙离子浓度接近0mol/L时,有较小的SK2通道电流被激活;当电极内游离钙离子浓度靠近5×10-7mol/L,SK2通道电流不仅被激活,而且在原有的基础增大,超级化方向更为显著;当电极内游离钙离子浓度超过生理浓度达到10-6mol/L左右时,SK2通道电流在超级化方向增大极为显著(图5)。这说明AF组患者心房肌细胞的SK2通道电流也具有明显钙依赖性。当电极内游离钙离子浓度达到10-6mol/L左右时,SK2电流密度与前两组相比有统计学差异(n0=4,n5×10-7=3,n10-6=4,P<0.05,P<0.01)
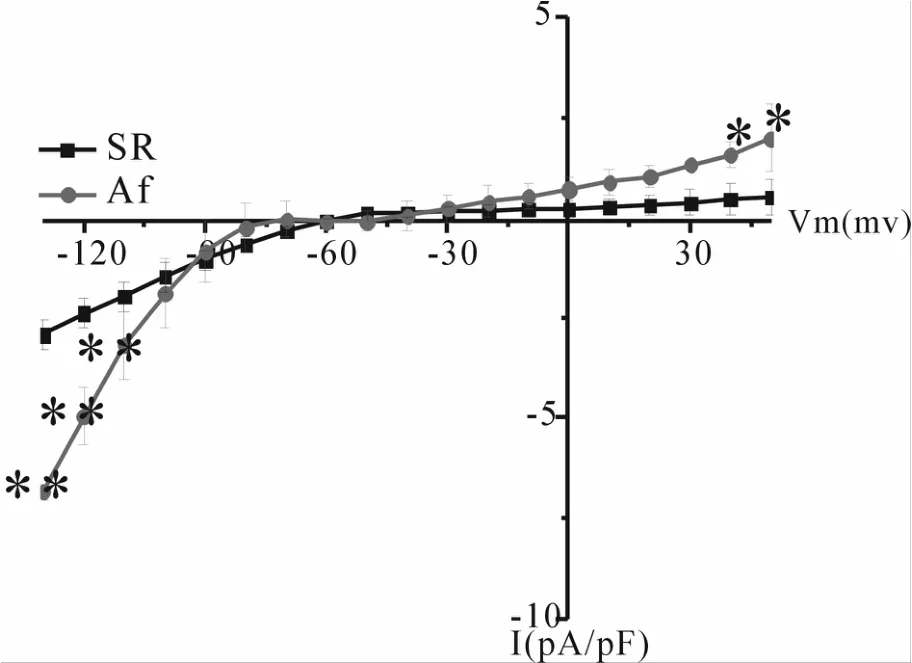
Fig.3 Differences of SK2 currents between AF and SR groups SK2:Small conductance Ca2+-activiated K+ channels;AF:Atrial fibrillation;SR:Sinus rhythm*P<0.05,P<0.01 vs SR group

Fig.4 Ca2+-dependence properties of SK2 currents in SR group SK2:Small conductance Ca2+-activiated K+ channels;AF:Atrial fibrillation;SR:Sinus rhythm*P<0.05 vs 5×10-7 group
2.6 SR组与AF组心房肌细胞SK2通道钙离子敏感性的差异
SR组与AF组心房肌细胞SK2通道电流都具有钙离子敏感性,本实验对电极内游离钙离子在各浓度时(0mol/L、5×10-7mol/L、10-6mol/L)的实验数据进行比较,经统计学分析发现:AF组的SK2通道电流密度在后两种浓度时明显大于SR组,差异有统计学意义(P<0.05,P<0.01,图 6,nSR=8,nAF=4)。
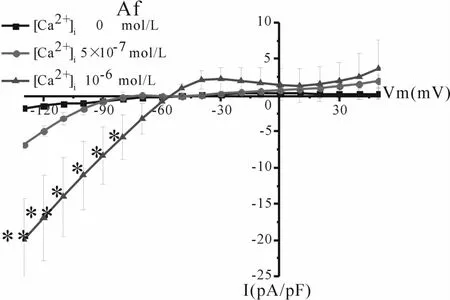
Fig.5 Ca2+-dependence properties of SK2 currents in AF group SK2:Small conductance Ca2+-activiated-K+ channels;AF:Atrial fibrillation represent the SK2 current density in different calcium concentration*P<0.05,**P<0.01 vs 5×10-7 group

Fig.6 Difference of Ca2+-dependence properties of SK2 currents density between SR and AF groups SK2:Small conductance Ca2+-activiated K+ channels;SR:Sinus rhythm;AF:Atrial fibrillation*P<0.05,**P<0.01 vs SR group
3 讨论
功能性SK通道包括两种亚单位:α亚基和与之相连的钙调蛋白(CaM)亚基,SK通道以四聚体形式存在:4个CaM亚基分别与4个α亚基相连。SK通道具有电压不敏感性,其门控调节不由膜电位决定。SK通道对apamin敏感,且三种亚型对apamin的敏感程度不同,因此常将apamin作为SK通道特异性阻断剂。
SK通道对钙离子的高选择性大于其他二价离子,SK通道的开放与关闭与胞内钙离子浓度有关。生理状态下,细胞内的钙离子浓度300~700 nmoL/L可将SK通道激活。SK通道功能对胞内钙离子存在依赖性,可随胞内钙离子浓度的增高而增大。2009年,Weiyan Li等在卵母细胞上表达SK通道,在inside-out模式下记录通道电流,随着钙离子浓度的增加,SK通道电流增大[5]。稀土元素离子 Tb3+、Eu3+等同样可以激活SK2通道,镁离子、锶离子和钡离子等二价阳离子可抑制rSK2通道。因此,可利用这些特性来研究SK通道与二价离子之间的依赖关系。
我们的研究结果证实SK2通道电流具有以下特点:(1)通道电流具有明显的钙离子浓度依赖性。(2)通道的 Apamin敏感性:apamin是 SK2通道特异性阻断剂,常用于对SK2通道的鉴别。本实验所记录的内向整流混合电流,浴液中加入10-7mol/L apamin后明显减小,经浴液洗脱电流可以基本恢复。这些结果提示该通道为2型小电导钙激活钾通道(SK2),其通道特性与上述文献报道一致。
SK2通道的结构决定其对钙离子敏感而电压依赖性不明显,当细胞外钙离子进入胞内诱发肌浆网释放钙离子,使胞内游离钙离子浓度增加,激活SK2通道开放,诱导细胞膜电位超极化。KCa通道与胞内游离钙离子之间的关系并不简单。当胞内钙离子发生动态变化,动态的胞内钙信号可以调节KCa通道。在过表达KCa通道的HEK293细胞上,利噜唑(SK通道激动剂)处理可引起胞内钙震荡,导致13%~50%的细胞通道激活,但是50%~76%的细胞内钙离子浓度的变化与通道电流的变化不同步,即出现钙不依赖电流和电流不依赖钙离子现象[6]。而这些复杂事件的机制还有待深入研究。
为研究钙离子对人心房肌细胞SK2通道电流的调节作用,本实验使用二性霉素B和β-escin来配制穿孔电极液,进行穿孔膜片钳实验,改变电极液中钙的浓度,观察钙离子对人心房肌细胞SK2通道的调控作用。当穿孔全细胞模式形成后,电极内液中的钙离子进入胞内,细胞内钙浓度被电极内液稀释,此时的细胞内钙浓度约等于电极内液中钙的浓度,这种穿孔全细胞的记录模式适用于胞内游离钙离子对 SK2通道调控的研究[4]。
本实验结果证明电极内钙离子浓度为5×10-7mol/L和10-6mol/L时,AF组 SK2通道电流明显大于SR组,差异具有显著性。结果提示AF时SK2通道对钙离子的敏感性增强。
AF是临床常见的持续性心律失常,AF患者心房肌细胞内钙离子浓度升高。AF发生时,动作电位频率加快,通过 L-型钙通道进入胞内的钙离子增多,造成胞内钙超载。胞内钙超载可通过代偿即钙依赖式失活机制,使钙通道失活;同时负反馈调节使L-型钙通道密度降低,电流减小。但上述代偿机制可导致动作电位时程缩短,诱发AF。
本实验室之前研究报道持续性心房颤动患者心房肌细胞SK2通道电流明显增强[7]。有研究报道SK2通道在心肌细胞复极化过程中发挥着重要作用,间歇性快速起搏兔肺静脉肌袖细胞能引起SK2通道基因、蛋白表达及电流水平增加,SK2通道向膜上的转运增多,说明SK2通道参与快速心律失常的发生。SK2通道电流增加,对Ca2+敏感性增加,导致APD明显缩短,更易诱发房性心律失常[8]。本实验结果证明SK2通道具有明显的钙依赖性,胞内钙浓度超过生理范围时AF组SK2通道对钙离子更敏感,表明AF的发生发展与SK2通道的功能变化可能相关。
Diness等研究发现 SK通道的两种阻滞剂NS8593和UCL1684可以降低SK通道对钙离子的敏感性,影响SK通道特性。SK通道阻滞剂可以延长心房动作电位ERP,能够预防和终止离体和在体的房颤模型[9]。但是,Li Ning等研究发现SK2基因敲除的小鼠心房肌细胞复极化末期延长,这种情况下也容易诱发房颤,其机制是AP终末期对外源兴奋敏感导致迟后去极化的发生[10]。这提示AF的发生不仅与SK2通道有关,而且与SK通道功能变化密切相关。
房室结组织的也有SK通道表达,SK通道的抑制剂或许可调节AF时的心室率,同样SK通道的抑制剂对窦性心动过速也能发挥作用。
[1] Tuteja D,Xu D,Timofeyev V,etal.Differential expression of small-conductance Ca2+-activated K+channels SK1,SK2,and SK3 in mouse atrial and ventricularmyocytes[J].Am JPhysiol HeartCirc Physiol,2005,289(6):H2714-2723.
[2] Xu Y,Tuteja D,Zhang Z,et al.Molecular identification and functional roles of a Ca2+-activated K+channel in human and mouse hearts[J].J Biol Chem,2003,278(49):49085-49094.
[3] 李妙龄,曾晓荣,杨 艳,等.一种改进的人体心房肌细胞分离方法[J].生理学报,2007,59(6):858-864.
[4] 王 华,李 涛,雷 明,等.二性霉素B与β-escin混合穿孔电极液在人心房肌细胞SK2电流记录中的应用[J].中国应用生理学杂志,2012,28(3):214-218.
[5] LiW,Richard W.Activation of the SK potassium channelcalmodulin complex by nanomolar concentrations of terbium[J].Proc Natl Acad SciUSA,2009,106(4):1075-1080.
[6] Millership JE,Heard C,Fearon IM,etal.Differential regulation of calcium-activated potassium channels by dynamic Intracellular calcium signals[J].JMembrane Biol,2010,235(3):191-210.
[7] 李妙龄,李 涛,雷 明,等.持续性心房颤动患者心房肌细胞小电导钙激活钾通道电流的增强[J].中华心血管病杂志,2011,39(2):147-151.
[8] Özgen N,Dun W,Sosunov EA,et al.Early electrical remodeling in rabbit pulmonary vein results from trafficking of intracellular SK2 channels tomembrane sites[J].Cardiovascular Research,2007,75(4):758-769.
[9] Diness JG,Srensen US,Nissen JD.et al.Inhibition of small-conductance Ca2+-activated K+channels terminates and protests againstatrial fibrillation[J].Circ Arrhythm Electrophysiol,2010,3(4):380-390.
[10]Li N,Timofeyev Va,Tuteja D,et al.Ablation of a Ca2+-activated K+channel(SK2 channel)results in action potential prolongation in atrialmyocytes and atrial brillation[J].J Physiol,2009,587(5):1087-1100.

