淫羊藿总黄酮对实验性糖尿病大鼠肾脏保护作用*
钱 虹,杨钧杰,潘定一,唐文涛,许可佳,齐敏友
糖尿病肾病(diabetic nephropathy,DN)是糖尿病严重而常见的慢性并发症,同时也是糖尿病患者中最常见的微血管病变之一[1]。大量研究表明:血流动力学途径、纤维化和炎症因子、激酶途径以及氧化应激介质等在糖尿病肾病的发生发展过程中起重要作用[2],其中纤维化因子、转化生长因子β(transforming growth factor beta,TGF-β)受到广泛关注[3]。淫羊藿总黄酮(total flavonoids of epimedium,TFE)是从淫羊藿茎叶中提取的黄酮类成分,是淫羊藿的主要有效成分,现代药理学研究表明,TFE对免疫系统、心血管系统、神经系统、骨骼系统等疾病均有一定作用[4],同时也表现出较好的降血糖作用,但 TFE在DN发展过程中是否可以通过抑制肾脏TGF-β1蛋白表达从而抗肾脏纤维化尚无报道。本实验通过链脲佐菌素(streptozocin,STZ)建立糖尿病大鼠肾病模型,研究TFE对糖尿病大鼠肾病的作用及其机制,为其临床新用途提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性 SD大鼠,体重180~200 g,由浙江医学科学院实验动物中心提供,动物许可证号:SCXK(浙)-2008-0033。
1.1.2 药物与主要试剂 淫羊藿总黄酮由西安小草植物科技有限公司提供;链脲佐菌素,由Sigma公司生产;SOD、MDA、BUN、Cr、考马斯亮蓝试剂盒,均由南京建成生物工程有限公司提供;兔抗大鼠TGF-β1抗体,由博士德生物技术有限公司提供;兔抗Envision抗体,由DAKO公司提供。
1.1.3 仪器 血糖测试仪(美国强生);AL204型电子天平(Made by Mettler-Toledo Group);高速冷冻离心机(Biofuge stratos,德国 Thermo);MICROM轮转式石蜡切片机(HM325型,德国美康)。
1.2 方法
1.2.1 模型建立 雄性SD大鼠,分笼饲养。禁食不禁水12 h后,一次性尾静脉注射 STZ(40 mg/mg),STZ以柠檬酸缓冲液溶解(pH 4.5),现配现用。72 h后,取尾静脉血测血糖,两次血糖均高于16.7mmol/L者视为糖尿病大鼠模型。大鼠随机分为3组(n=10):对照组、模型组、TFE组。造模第 5周开始灌胃,TFE以0.5%羧甲基纤维素钠(CMC-Na)配成混悬液,给药剂量 100 mg/(kg·d),对照组与模型组给予相同体积的0.5%CMC-Na溶液,连续8周。
1.2.2 生化指标测定 末次给药后,空腹12 h,尾静脉采血,血糖仪测定各组血糖。内眦取血,静置,4℃离心(3 500 r/min,10 min),取上清,按照试剂盒说明书测定血尿素氮和肌酐含量。处死大鼠,快速取出肾脏,剔除周围结缔组织和脂肪,生理盐水洗净,滤纸吸干后称取肾脏质量,根据末次体重计算肾脏脏器系数(肾脏重/体重)。取适量右侧肾脏组织,冷生理盐水冰浴条件下制成10%匀浆液,4℃离心(3 000 r/min,10 min),取上清液,-20℃保存。严格按照试剂盒说明书检测超氧化物歧酶(superoxide dismutase,SOD)活 性 和 丙 二 醛 (malondialdehyde,MDA)含量。
1.2.3 组织学检测 左侧肾脏组织,4%多聚甲醛固定,石蜡包埋切片,经Masson染色后于光镜下观察肾小球的病理改变和胶原纤维增生情况。
1.2.4 免疫组化检测 采用免疫组化 Envision法检测TGF-β1在各组大鼠肾组织的分布和表达,DAB显色,苏木素复染。TGF-β1阳性表达半定量方法参考本实验室前期的研究[5],取 10个视野点(100倍),取均值。
1.3 统计学处理
实验数据以均数 ±标准差(¯x±s)表示,采用SPSS 13.0软件进行统计学处理,并作组间俩俩比较。
2 结果
2.1 淫羊藿总黄酮对糖尿病大鼠一般体征和肾脏脏器系数的影响
对照组大鼠饮食及尿量正常,精神状态良好,反应灵敏,毛色洁白有光泽,体重稳定增加。模型组大鼠表现为多饮、多食、多尿症状,体重逐渐减轻,肾脏脏器系数显著增大(P<0.01)。TFE组大鼠一般体征与对照组接近,肾脏系数得到改善(P<0.01,表1)。

Tab.1 Body weight,ratio of kidney/body weight improved after interventions with TFE for 8 weeks(¯x±s,n=10)
2.2 淫羊藿总黄酮对大鼠血糖和肾功能BUN、Cr的影响
模型组大鼠血糖、尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)水平较对照组均显著升高(P<0.01),TFE组血糖略有下降,但无统计学差异(P>0.05),BUN和 Cr含量明显低于模型组(P<0.05,表2),表明淫羊藿总黄酮对糖尿病肾功能有明显改善作用。
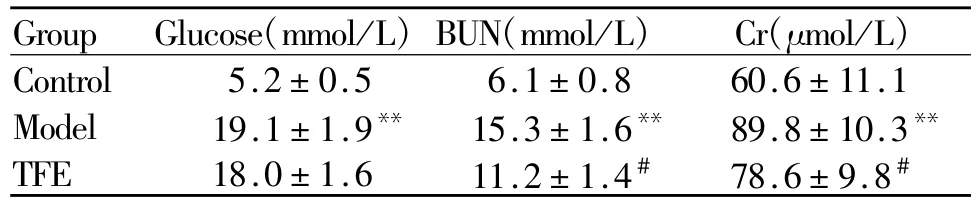
Tab.2 Comparison of blood glucose,BUN and Cr(¯x±s,n=10)
2.3 淫羊藿总黄酮对糖尿病大鼠肾组织SOD活力和MDA含量的影响
与对照组相比,模型组大鼠肾组织中SOD活力显著降低(P<0.01),MDA含量显著升高(P<0.01),表明大鼠肾组织中存在过度的氧自由基,机体抗氧化能力下降。TFE组上述状况得以改善(P<0.05,P<0.01,表 3),提示淫羊藿总黄酮某种程度上能够提高机体的抗氧化能力。
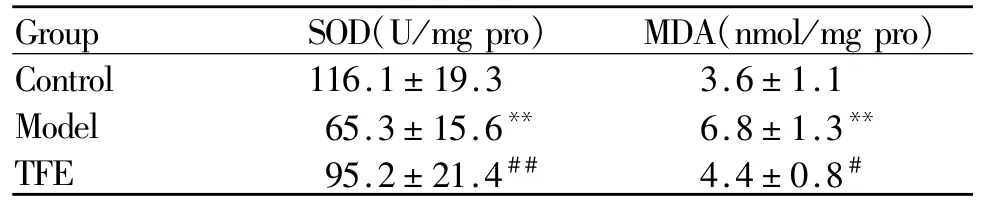
Tab.3 Comparison of SOD and MDA(¯x±s,n=10)
2.4 Masson染色法观察肾脏组织结构
Masson图像染色光镜下可见,对照组肾小管细胞排列整齐,仅可见少量胶原纤维分布。模型组肾小管细胞排列紊乱,肾小管-间质细胞之间、血管周围胶原纤维显著增多,分布紊乱呈蓝色。TFE组较模型组有所改善,胶原纤维分布正常,血管周围、肾小管-间质细胞间仅有少量浅蓝色着色(图1)。
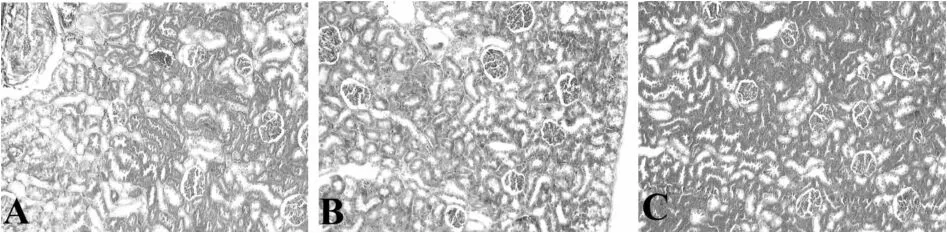
Fig.1 Expression of collagen protein in renal tissue of rats(Masson×100)A:Control group;B:Modelgroup;C:TFE group;TFE:Total flavonoids of epimedium
2.5 肾脏组织中TGF-β1表达的变化
免疫组化结果显示,对照组部分肾小管间质仅有微量转化生长因子β1(transforming growth factor-β1,TGF-β1)阳性棕黄色颗粒;模型组(0.39±0.06)肾小管系膜区、基底膜可见大量棕褐色阳性颗粒,呈强阳性反应,与对照组(0.16±0.03)比较有统计学差异(P<0.01);TFE组(0.25±0.02)较肾小管间质 TGF-β1阳性着色明显减轻(P<0.01,图 2)。
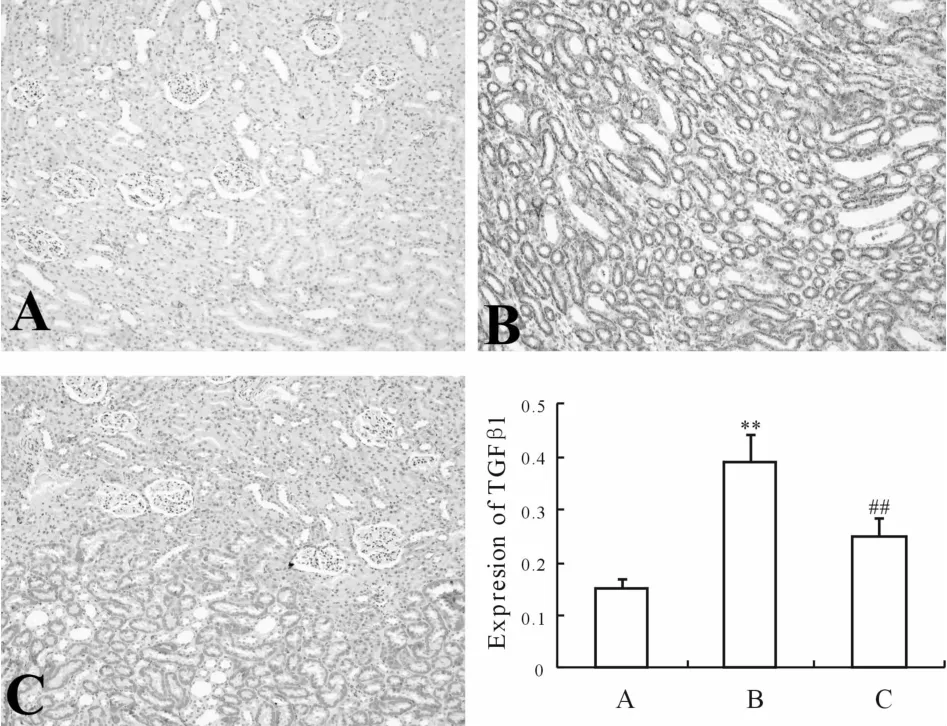
Fig.2 Expression of TGF-β1 in renal tissuesof rats(Immunohistochemical×100)A:Control group;B:Model group;C:TFE group;TFE:Total flavonoids of epimedium**P<0.01 vs A;##P<0.01 vs B
3 讨论
糖尿病肾病临床表现为肾小球滤过率降低、蛋白尿、动脉血压升高、体液潴留等症状,最终导致肾功能衰竭,是糖尿病患者死亡的重要原因[6]。新近研究表明,DN源于高血糖下的代谢紊乱,导致纤维化因子和炎症因子合成释放增加、氧化应激增强导致肾脏结构和功能改变[7]。本实验以STZ诱导大鼠糖尿病肾病模型,肾功能降低,肾脏抗氧化能力减弱,Masson染色显示肾脏结构排列紊乱,肾小球和肾小管纤维化明显,表明糖尿病肾病模型建立成功。TFE能够提高糖尿病肾病大鼠肾组织抗氧化能力,减轻肾组织纤维化,对肾脏起保护作用。
中医学认为:糖尿病肾病乃糖尿病日久伤阴耗气,使肾体受损,肾用失司所致[8]。治疗上以补肾活血、益气养阴、活血化瘀等为主。淫羊藿为小檗科植物淫羊藿的全草,是我国传统中医学中的一味补益中药,具有滋阴补肾、强筋健骨等功效,是中医药医治DN的常用处方之一。TFE是从其茎叶中提取的主要有效成分,作为一种植物黄酮,具有较好的抗氧化活性,推测其能保护肾脏,延缓DN进展。本实验观察到TFE对糖尿病大鼠血清尿素氮和肌酐具有明显的改善作用,表明其可保护糖尿病大鼠肾功能;此外,我们对大鼠肾组织中MDA含量和SOD活性的检测发现,经TFE治疗,糖尿病大鼠肾组织中脂质过氧化物含量明显减少,抗氧化酶SOD活性有显著提高,提示TFE能够提高经STZ诱导的糖尿病大鼠肾脏抗氧化能力,降低氧化应激水平,这与我们的推测相一致。此外,TFE组血糖较模型组并未有明显降低,表明TFE可能是通过提高抗氧化能力而不是通过降低血糖保护糖尿病大鼠肾脏。
肾小球和肾小管间质细胞外基质(extra cellular matrix,ECM)进行性积聚是DN的重要特征,也是肾小球硬化、肾小管坏死和肾功能衰竭的关键[9]。在这一过程中,TGF-β1参与并发挥重要作用,其通过破坏ECM的合成与降解平衡造成ECM过度积聚。一方面,TGF-β1可上调纤溶酶原激活物抑制物-1(plaminogen activator inhibitor-1,PAI-1)表达,从而抑制纤溶酶原激活物对纤溶酶原的活化,进而使ECM降解减少。另一方面,TGF-β1可直接促进肾小管细胞、系膜细胞、间质成纤维细胞合成胶原Ⅰ、层粘连蛋白和纤维连接蛋白[2],促进ECM积聚;此外,TGF-β1也可上调结缔组织生长因子(connective tissue growth factor,CTGF)和血管内皮生长因子(vascular endothelial growth factor,VEGF),间接增加 ECM合成。两方面共同作用,最终加剧DN病情。本实验Masson染色、TGF-β1免疫组化及半定量结果显示,糖尿病大鼠经TFE治疗后,肾组织TGF-β1蛋白表达明显降低,纤维化情况明显得到改善,提示TFE可能通过上述机制减轻糖尿病肾脏损伤。
综上所述,高水平的氧化应激和TGF-β1蛋白表达加剧DN过程,TFE能较好减轻DN引起的肾脏损伤,其可能机制包括增加机体抗氧化能力和下调TGF-β1蛋白的表达而不是通过降低血糖。由于目前对DN缺乏有效的治疗手段,因此研究TFE保护DN大鼠肾脏的作用和机制,对开发中药治疗DN具有重要意义。
[1] Yamabe N,Kang KS,Goto E,et al.Beneficial effect of Corni Fructus,a constituentofHachimi-jio-gan,on advanced glycation end-product-mediated renal injury in Streptozotocintreated diabetic rats[J].Biol Pharm Bull,2007,30(3):520-526.
[2] Arora MK,Singh UK.Molecularmechanisms in the pathogenesis of diabetic nephropathy:an update[J].Vascul Pharmacol,2013,58(4):259-271.
[3] Chung AC,Yu X,Lan HY.MicroRNA and nephropathy:emerging concepts[J].Int JNephrol Renovasc Dis,2013,25(6):169-179.
[4] 付立波,夏映红,于 丽,等.淫羊藿总黄酮对大鼠动脉血压影响及其机制的实验研究[J].中国应用生理学杂志,2007,23(1):115-116.
[5] 杨钧杰,宫 燕,史 杰,等.熊果酸对实验性糖尿病小鼠心肌纤维化作用的研究[J].中国应用生理学杂志,2013,29(4):353-356.
[6] Moressco RN,SangoiMB,De Carvalho JA,et al.Diabetic nephropathy:traditional to proteo-mic markers[J].Clin Chim Acta,2013,421:17-30.
[7] Chaudhuri A,Umpierrez GE.Oxidative stress and inflammation in hyperglycemic crises and resolution with insulin:implications for the acute and chronic complications of hyperglycemia[J].JDiabetes Complications,2012,26(4):257-258.
[8] 洪昱钤.糖尿病肾病的中医药研究进展[J].北京中医杂志,2002,21(3):187-189.
[9] 王国光,张 翠,陆晓华,等.核黄素对STZ诱导的大鼠糖尿病肾病的治疗作用[J].中国病理生理杂志,2010,26(7):1395-1398.

