枯草芽孢杆菌甘露聚糖酶基因优化及表达
■聂金梅 李阳源 钟开新
(广东溢多利生物科技股份有限公司,广东珠海519060)
本研究首次采用去除基因信号肽、定点突变、重叠PCR等方法克隆得到来源于枯草芽孢杆菌的中性甘露聚糖酶基因,采用基因工程手段构建筛选得到一株高效分泌表达甘露聚糖酶的毕赤酵母工程菌株;初步研究了该甘露聚糖酶酶学性质,为将枯草芽孢杆菌甘露聚糖酶用作工业用酶提供参考。
1 材料与方法
1.1 试验材料
1.1.1 菌株和质粒
大肠杆菌Top10、毕赤酵母感受态细胞X33、pPICZαA均为本实验室保存。菌株(Bacillus subtilis编号GIM 1.259)购自广东省微生物研究所菌种保藏中心。
1.1.2 培养基
LB、LBZ、BMGY培养基参见Invitrogen公司毕赤酵母操作手册。
1.1.3 试剂
SacI购自Fermentas公司,其它限制酶、DNA聚合酶、T4 DNA连接酶购自NEB公司。
1.2 试验方法
1.2.1 设计引物
根据甘露聚糖酶全基因序列,设计引物WBmanF/WBmanR;WBman mutF/WBman mutR,引物序列设计见表1。

表1 研究所用引物序列
1.2.2 测定甘露聚糖酶活性方法
吸取2.00 ml经过适当稀释的酶液,37℃平衡10 min,加入2.0 ml槐豆胶溶液(0.5%),37℃平衡10 min,加入到50 ml比色管中,再加入5 mlDNS试剂,电磁振荡3 s,以终止酶解反应。沸水浴加热5 min,用自来水冷却至室温,加水定容至25 ml,电磁振荡3 s。以标准空白样为对照,在540 nm处测定吸光度值。酶活性定义:在37℃、pH值5.5条件下,1 min从浓度为1 mg/ml的甘露聚糖溶液中降解释放1 μmol还原糖所需要的酶量为一个酶活力单位。
1.2.3 提取枯草芽孢杆菌基因组
枯草芽孢杆菌干粉于营养肉汁培养基中复壮2 d,30℃,静置培养,此为第一代G1;划线于LB培养基,长出单菌落,此为第二代G2;将G2代单菌落制成悬液,制备甘油冷冻管G2;挑取单菌落转接斜面菌种,此为工作用菌种G3;制成悬液G3,提取枯草芽孢杆菌基因组,置于-20℃保存。
1.2.4 克隆甘露聚糖酶基因
用枯草芽孢杆菌基因组为模板、引物WBmanF/WBmanR,通过PCR方法克隆甘露聚糖酶编码序列(WBMAN),经1%琼脂糖凝胶电泳分析,切胶回收约1.1 kb的片段。
1.2.5 定点突变法和重叠PCR法
设计一对突变引物WBman mutF/WBman mutR,采用重叠PCR方法扩增其编码区基因序列。重叠PCR分四步进行,分别为PCR1、PCR2、PCR3和PCR4,PCR3反应体系是以PCR1和PCR2作模板兼做引物进行扩增,共18个循环;其余PCR扩增体系见表2,PCR反应条件见表3。

表2 PCR扩增体系

表3 PCR反应条件
将PCR1和PCR2产物用1%浓度的琼脂糖凝胶进行电泳分析,分别切胶回收大小约为0.5 kb和0.6 kb的基因片段并纯化,置于-20℃保存,具体操作参照PCR纯化试剂盒。以上述PCR1和PCR2产物片段为模板和引物,进行PCR扩增,PCR3共18个循环;以PCR3产物为模板,以WBmanF及WBmanR为引物,进行PCR4扩增,将PCR4产物用1%琼脂糖凝胶进行电泳分析,并切胶回收大小约1.1 kb基因片段,置于-20℃保存。取5 μl纯化后的DNA进行琼脂糖电泳分析。
1.2.6 体外构建重组质粒V-pPIC-WBmanmut
取甘露聚糖酶突变基因 WBmanmut以及pPICZαA各20 μl,用Not1和EcoR1双酶切(37 ℃、3 h),T4连接酶连接(4℃过夜),转化大肠杆菌Top10,转化步骤如下:冰上放置30 min,42℃孵育90 s,冰上放置20 min,加1 mlLB培养基后37℃振荡培养1 h,涂布LBZ平板,37℃培养过夜,挑取单菌落共20个,采用菌落PCR法鉴定阳性克隆子,菌落PCR反应条件:94℃、4 min;94 ℃、30 s,60 ℃、30 s,72 ℃、2 min,72 ℃、10 min,30个循环。取10 μl PCR产物进行琼脂糖凝胶电泳分析。对阳性克隆进行酶切鉴定以及测序序列,DNA测序由深圳华大基因公司完成。
1.2.7 构建重组工程菌株
将重组质粒V-pPIC-WBmanmut用DpnI线性化,采用电击法将线性化的V-pPIC-WBmanmut转化至毕赤酵母X33,涂布于YPDZ平板,30℃下静置培养2~3 d,直至长出单菌落。
1.2.8 筛选高效分泌表达的葡萄糖氧化酶毕赤酵母工程菌株
挑取单菌落接种于装有5 mlBMGY的50 ml离心管中,于28~30 ℃、200 r/min培养至OD600nm为2~6时,添加甲醇至终溶度为0.6%,每隔24 h补加甲醇并留样,采用测定酶活性的方法初步筛选高产菌株,再以1%的量接种至装有50 mlBMGY的500 ml三角瓶中,用双层纱布封口,于28~30℃、200 r/min的摇床培养,复筛得到一株高效分泌表达的甘露聚糖酶突变基因工程菌株,将它命名为V-X33-pPIC-WBmanmut。离心收集摇瓶发酵上清液,进行枯草芽孢杆菌甘露聚糖酶的酶学性质研究。
2 结果
2.1 甘露聚糖酶基因的克隆
以枯草芽孢杆菌基因组为模板,PCR扩增得到甘露聚糖酶基因,切胶纯化目的片段(约1 100 bp)(见图1)。测序分析由深圳华大基因公司完成,结果表明甘露聚糖酶基因大小为1 104 bp,编码362个氨基酸。该基因与GenBank中已登录的同类基因(NC_014976.1)的氨基酸序列具有95%以上的同源性。
2.2 含甘露聚糖酶基因的毕赤酵母表达质粒wbman-pic的构建
PCR4产物加入Taq酶扩增5个循环,在甘露聚糖酶基因3'端连接polyA尾部结构,再与PMD20-T载体连接,连接产物转化至Top10,LBZ平板筛选阳性转化子,挑取单菌落进行菌液PCR验证(见图2),提取质粒,将稀释1 000倍的质粒作为模板,重叠PCR法扩增含突变位点的甘露聚糖酶基因,切胶纯化目的片段(见图3);提取质粒,用EcoRI和NotI将重组突变甘露聚糖酶质粒和pPICZαA进行酶切,用PCR纯化试剂盒纯化,T4连接酶连接(4℃过夜),转化至Top10细胞,LBZ平板筛选阳性转化子,菌液PCR验证后(见图4),提取质粒,用EcoRI和NotI酶切质粒应得到1.1kb目的基因条带和3.6 kb载体pPICZαA的基因条带,酶切产物经琼脂糖凝胶电泳鉴定,结果如图5所示。

图1 枯草芽孢杆菌基因组扩增甘露聚糖酶产物琼脂糖凝胶电泳
图2 重组质粒甘露聚糖酶PMD20-T PCR鉴定

图3 枯草芽孢杆菌突变甘露聚糖酶基因PCR产物琼脂糖凝胶电泳

图4 突变型甘露聚糖酶重组质粒PCR鉴定

图5 突变型甘露聚糖酶重组质粒酶切分析
2.3 甘露聚糖酶基因的分泌表达
用Dpn1酶切突变型甘露聚糖酶重组质粒,柱式纯化,将线性化的重组质粒电转入毕赤酵母X33感受态细胞中,YPDZ平板筛选阳性表达载体。从140个单菌落中筛选出一株酶活力最高的工程菌株,接种至摇瓶诱导表达48 h后,产酶活性为120 U/ml。
2.4 枯草芽孢杆菌甘露聚糖酶的酶学性质研究
2.4.1 温度对重组β-甘露聚糖酶的影响
在 pH 值 6.0的条件下,分别在 30、40、50、60、70℃,用DNS法测定重组β-甘露聚糖酶的酶活力,结果表明,在40℃时测定的酶活力最高(见图6)。
为了研究重组甘露聚糖酶在不同温度下的稳定性,分别将上清液在30、40、45、50、55、60、65、70 ℃ 静置5 min,然后在40℃、pH值6.0的条件下用DNS法测定酶的残存活力,以40℃所测得的酶活力为100%,结果显示,当温度达到70℃时,剩余酶活力仍保留48%(见图7)。
2.4.2 pH值对重组β-甘露聚糖酶的影响
在40 ℃条件下,分别在pH值为3.0、4.0、5.0、6.0、7.0和8.0时,用DNS法测定重组β-甘露聚糖酶的酶活力,结果显示,当pH值为6.0时,酶的催化活力最高,以40℃、pH值6.0时酶的催化活力为100%,pH值5.0~8.0时相对催化活力均在最适催化活力的80%以上(见图8)。
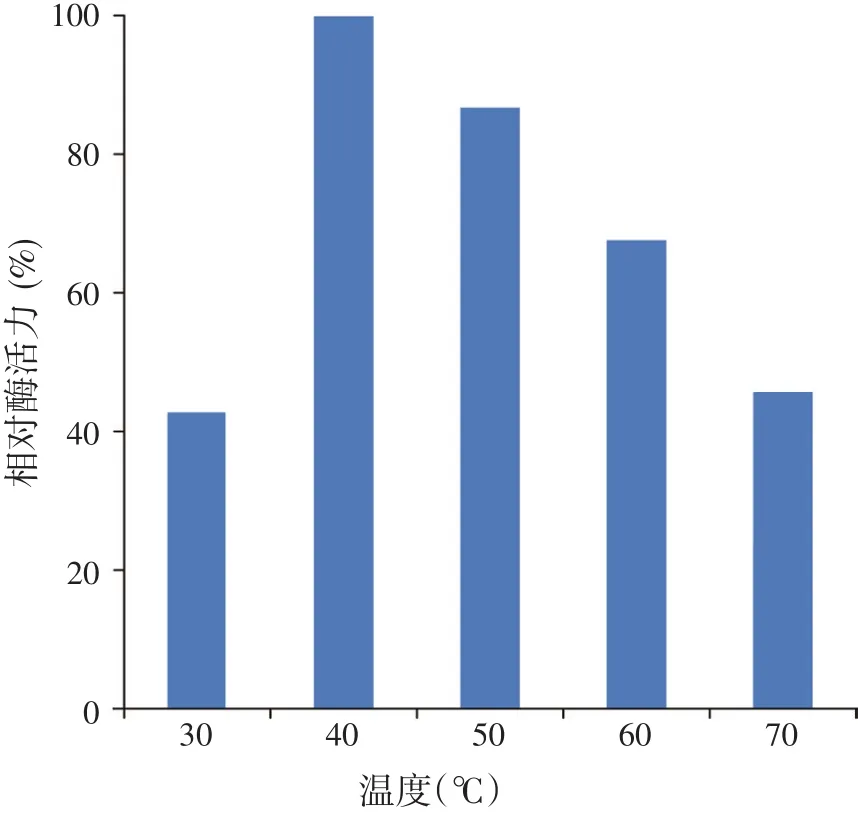
图6 甘露聚糖酶的最适催化温度

图7 甘露聚糖酶的耐温性能

图8 甘露聚糖酶的最适催化pH值
为了研究重组β-甘露聚糖酶在不同pH值条件下的稳定性,分别将酶液在pH值为3.0、4.0、5.0、6.0、7.0和8.0的缓冲液中,置于4℃静置4 h,然后在40℃、pH值6.0条件下,用DNS法测定甘露聚糖酶的残存活力,以pH值为6.0时测得的酶活力为100%,结果表明,pH值在6.0~8.0范围内,剩余酶活力均保留50%以上,具有较好的耐碱性(见图9)。
2.4.3 金属离子对重组β-甘露聚糖酶的影响
在酶上清液中分别加入终浓度为10 mM的Na+、Fe3+、Cu2+、Li+、Mg2+、Ca2+、K+、Mn2+、Fe2+、Zn2+、Co2+、EDTA,室温静置20 min后测定酶的残余酶活力。以不添加任何离子的酶上清液作对照,所测定的酶活力为100%。其它各组所测定的酶活力结果见图10,各种离子对重组β-甘露聚糖酶的影响各不相同,但均保持59%以上的酶活。

图9 甘露聚糖酶的耐酸碱性能
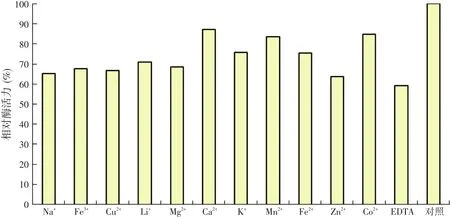
图10 金属离子以及EDTA对甘露聚糖酶活性的影响
3 讨论
3.1 不同来源的甘露聚糖酶酶学性质(见表4)
甘露聚糖酶普遍存在于动物、植物和微生物中,其中微生物是甘露聚糖酶的主要来源,包括细菌、真菌和放线菌等。其中细菌包括芽孢杆菌[1]、假单胞菌,真菌中的曲霉菌[2]、里氏木霉菌[3]以及放线菌中的链霉菌[4]、酵母[5]等。已发现100余种来源于微生物的甘露聚糖酶,在实际生产和基础研究中已得到了广泛应用,它具有活性高、成本低、提取方便等优点。来源于不同微生物的甘露聚糖酶性质存在一定差异,细菌来源的多属于中性酶,真菌来源的多为酸性酶。
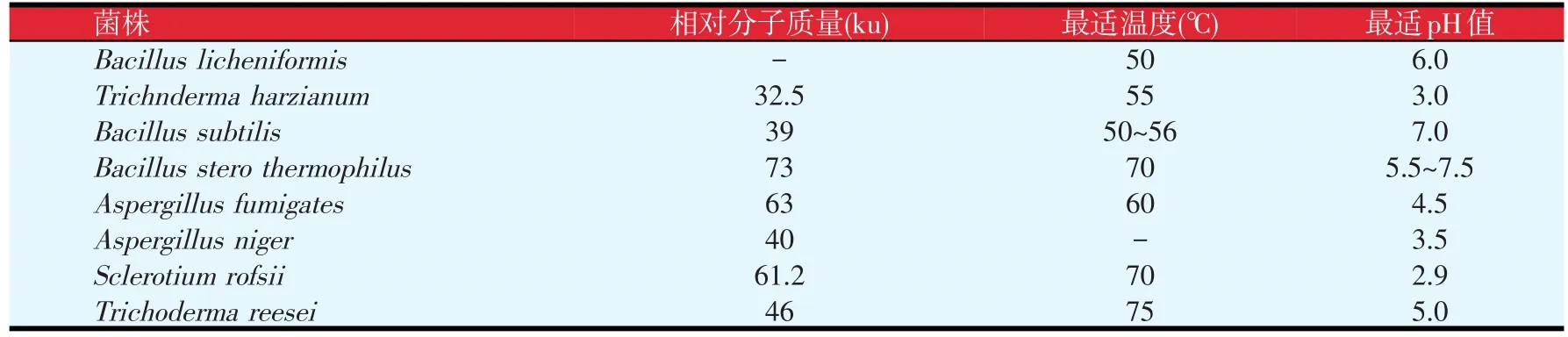
表4 部分微生物产β-甘露聚糖酶及其酶学特性
3.2 甘露聚糖酶的应用
3.2.1 甘露聚糖酶在饲料工业中的应用
甘露聚糖酶可降解β-D-甘露聚糖、破坏植物性饲料细胞壁,使营养物质与消化酶充分接触,提高动物内源酶(如胰蛋白酶、淀粉酶等)的活性,消除抗营养因子的作用,降低动物消化道内容物黏稠度,改善肠道微生物环境,改善动物的健康状况,促进生长,减少粪便排泄,减轻环境污染。
3.2.2 甘露聚糖酶用作工具酶
在复杂多糖中常常有β-甘露糖苷键存在,作为工具酶添加β-甘露聚糖酶将其切除,再测定水解产物中各组分的含量和类型,进一步进行分析便可推测多糖物质可能的结构。
此外,β-甘露聚糖酶可用于食品的加工贮藏和果汁澄清,是一种优质的食品添加剂。也可应用于纸浆的漂白工艺、洗涤工业以及纺织工业,还可用作油井石油压裂液的优质生物破胶剂,具有高效、价廉、适用范围广且对地层伤害小等优点。
4 结论
本研究从枯草芽孢杆菌基因组中克隆出中性甘露聚糖酶基因,采用定点突变、重叠PCR酶切和连接等方法,体外构建重组表达载体,利用毕赤酵母表达系统高效稳定地表达甘露聚糖酶,最适作用温度和pH值分别是40℃和6.0,摇瓶培养诱导表达48 h后产酶活性为120 U/ml,为枯草芽孢杆菌甘露聚糖酶的应用提供参考。

