青岛啤酒酵母和高浓酵母原生质体融合选育高浓酿造菌株
李居宁,易庆平
(荆楚理工学院生物工程学院,湖北 荆门 448000)
青岛啤酒酵母和高浓酵母原生质体融合选育高浓酿造菌株
李居宁,易庆平
(荆楚理工学院生物工程学院,湖北 荆门 448000)
以青岛啤酒酵母和高浓酵母为供试菌株,通过原生质体融合得到融合子。对融合子利用铜抗性初筛,利用耐压和发酵性能为指标进行实验室和100 L发酵复筛,并对融合子进行鉴定及遗传稳定性实验。结果表明:通过原生质体融合选育出的高浓菌株与青岛啤酒酵母菌株相比,表现出酵母数峰值高、降糖和还原双乙酰快的优势,且代谢风味物质组成与青岛啤酒酵母接近;经过连续使用8代后,其总染色体DNA指纹图谱保持一致,证明该菌株的遗传稳定性高。
原生质体融合;高浓酵母;青岛啤酒酵母;选育;高浓酿造
啤酒质量的关键是发酵菌种,酵母是啤酒的灵魂[1]。酵母菌种的优化、培育、筛选工作被啤酒生产厂家放在非常重要的位置。选育一株耐高酒精度、耐高糖度、耐高渗透压、同时分泌良好风味物质的酵母菌是高浓酿造啤酒的核心工作。近年来,国内外许多酿造工作者在啤酒菌株性能及选育方面进行大量研究[2-4]。国外部分研究者利用酵母融合技术选育酿酒菌种,取得了较理想效果[5]。通过原生质体融合得到的菌株具有遗传亲本的许多优良性状,啤酒酵母原生质体融合菌株在实验室的研究较多[6-12],工业上的应用鲜有报道[13-14]。在啤酒酿造中菌种代谢产生的酶催化一系列生化反应产生的双乙酰、乙醛和高级醇等物质会影响啤酒口感及质量。本研究以选育优良的啤酒高浓酿造生产菌株为目的,通过青岛啤酒酵母和高浓酵母为亲株进行原生质体融合,对融合子进行实验室复筛和100 L发酵复筛,获得既能适应高浓酿造、高酒精环境,又能保持青岛啤酒基本风味的融合菌株,对满足工业生产所要求的高浓酿造、提高啤酒产量具有指导意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与培养基
根据青岛啤酒公司酵母菌种库的档案数据,从中挑选S.cerevisiae属中的优质的青岛啤酒酵母和高浓酵母作为融合亲株通过初筛和100 L发酵分析筛选得到4株供试菌:青岛啤酒酵母T1(T2318)、青岛啤酒酵母T3(T2360)、高浓酵母H4(1300)、高浓酵母H6(1325)。
11°P麦芽汁培养基加蛋清澄清处理后,115℃、20 min湿热灭菌后使用。铜抗性筛选培养基:YEPD固体培养基融化后冷却至55~60℃,无菌操作加入一定量灭菌的1 mol/L CuSO4,使培养基中CuSO4的浓度达到实验要求。
1.1.2 试剂[15]
限制性内切酶Bcl I、EcoRI、Eco RV、Dra I,0.1 mol/L Tris[15]饱和酚、氯仿(分析纯) 南京市华美日化工有限公司。
1.1.3 仪器与设备
90-B型PCR仪 中国科学院遗传研究所;生化培养箱 上海精宏实验设备有限公司;CHEF-DR Ⅲ脉冲场电泳系统 美国Bio-Rad公司;DYY-5稳压稳流电泳仪北京六一仪器厂;1100型高效液相色谱分析仪 美国安捷伦公司;1 000 L糖化设备 德国Jacalb Karl公司;100 L啤酒发酵设备 哈尔滨汉德酿造设备有限公司。
1.2 方法
1.2.1 糖化工艺
糖化工艺的设计原则为在遵循青岛啤酒的生产工艺基础上提高原麦汁浓度到150°P,具体配方及工艺如表1所示。
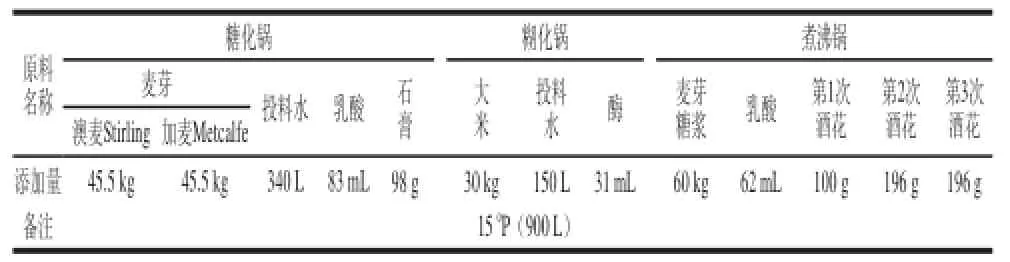
表1 糖化配方Table 1 Formulation of raw materials used in saccharification
糖化工艺曲线如图1所示。
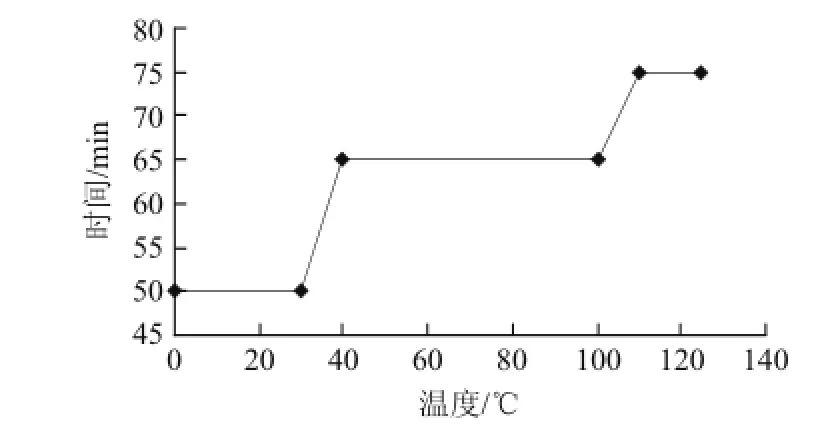
图1 糖化工艺曲线Fig.1 The curve of saccharification process
1.2.2 酵母扩培[16]
试管斜面5 mL液体麦汁培养基试管(25℃培养24 h)10 mL液体麦汁培养基试管(25℃培养36 h)240 mL液体麦汁培养基三角瓶(20℃培养36 h)2 000 mL液体麦汁培养基三角瓶(18℃培养36 h)2瓶2 000 mL培养液进100 L发酵罐。
1.2.3 发酵工艺
麦汁温度(8.0±0.5)℃进罐,满罐后24 h内排渣1次;自然升温至9.0~9.5℃发酵;当糖度降至4.8~5.2oBx,升温至12 ℃,还原双乙酰;当糖度降至3.8~4.2oBx,封罐,保持罐压0.8~1.0 kg/cm2;封罐24~48 h回收酵母,以后每2 d排1次酵母;双乙酰降至0.05 mg/L时降温,温度降至0 ℃后贮7 d。
1.2.4 原生质体制备及再生[17-18]
制备:取处于对数生长中期的酵母菌液5 mL,3 500 r/min、5 min离心收集菌体,菌体经PB离心机离心洗涤2次,悬浮于2 mL 0.3%β-巯基乙醇-0.1%EDTA-Na2中,于37℃水浴保温10~15 min,3 500 r/min离心5 min收集菌体,0.18 mol/L KCl溶液洗涤2次,悬浮于1 mL 2%的蜗牛酶液中,37℃恒温水浴酶解。酶解结束后,4 000 r/min离心10 min去除蜗牛酶液,pH 6.12高渗缓冲溶液洗涤2次,收集原生质体。
再生:双层平板法,首先在培养皿中铺一底层含琼脂2.5%的高渗YEPD再生培养基,放温箱中烘数小时,使其表面脱水。然后将10 mL预先保温在40℃、含有0.5%琼脂并混合了l mL原生质体悬液的YEPD高渗再生培养基倒入至底层平板中制成双层平板,30℃培养48 h。
原生质体融合方案:T1+H4;T1+H6;T3+H4;T3+H6。
1.2.5 融合子铜离子抗性初筛
将培养出的菌落挑至无菌水中,饥饿,用饥饿后的菌悬液点板,分别将融合子及其亲株点至含Cu2+浓度为4、6、8、10 mmol/L的YEPD固体培养基平皿上,点板后倒置培养,比较不同的Cu2+梯度平板上菌落的生长情况。
1.2.6 实验室水平复筛
将初筛获得的菌株进行实验室发酵实验,每株1瓶,以耐酒精度、耐压指标、抗自溶能力、发酵力为指标进行筛选,分别筛选出耐酒精度≥9%的融合子、蛋白酶活力≤0.25U/mg、起发快、还原双乙酰快、CO2减重多的融合子。
1.2.7 100 L发酵复筛
糖化生产15oP麦汁,将1.2.7节筛选出来的融合子与青岛啤酒酵母菌株接入100 L发酵罐发酵,连续15 d,每天稀释菌液在YEPD固体培养基培养后测定酵母菌数量、双乙酰质量浓度[19],发酵完成后测定发酵度[20]、菲林试剂测糖度[21]、pH值、酵母凝聚性[19]、α-N同化率[21]、可发酵性残糖[22]和风味物质[23]分析。
1.2.8 限制性片段长度多态性(restriction fregrmeat length polymorphisms,RFLP)实验
分别用4种酶包括Bcl I、EcoRI、Eco RV、Dra I对不同的酵母菌株总DNA进行酶切分析。供试酵母菌株的总DNA提取方法参照文献[24]。Bcl I酶切体系(5 μL):0.5 μL Buffer E+0.5 μL BSA+0.2 μL Bcl I+2 μL DNA+1.8 μL dH2O,37 ℃条件下处理10~16 h;EcoRI酶切体系(5 μL):0.5 μL Buffer H+0.5 μL BSA+0.2 μL EcoRI+2 μL DNA+1.8 μL dH2O,37 ℃条件下处理10~16 h;Eco RV酶切体系(5 μL):0.5 μL BufferH+0.5 μL BSA+0.2 μL Eco RV+2 μL DNA+1.8 μL dH2O,37 ℃条件下处理10~16 h;37 ℃条件下处理10~16 h;Dra I酶切体系(5 μL):0.5 μL Buffer T+0.5 μL BSA+0.2 μL Dra I+2 μL DNA+1.8 μL dH2O,37 ℃条件下处理10~16 h。
1.2.9 遗传稳定性实验
在生产厂连续使用8代筛选获得的融合子,回收后贮存于-80℃,同时采用CHEF电泳技术[25]对高浓酵母菌株的总染色体结构进行分析。
2 结果与分析
2.1 融合子的筛选
酵母原生质体融合获得的融合子,其重组率相对较高,根据前期确定的铜抗性筛选标记,首先对融合子进行初步筛选,挑选出200支融合子。虽然原生质体融合具有定向育种的含义,但是融合子的性能不同的情况依然存在,只是性状变化的范围有所限制,所以要根据需要,对融合子作进一步的定向筛选。
2.1.1 铜抗性标记初筛
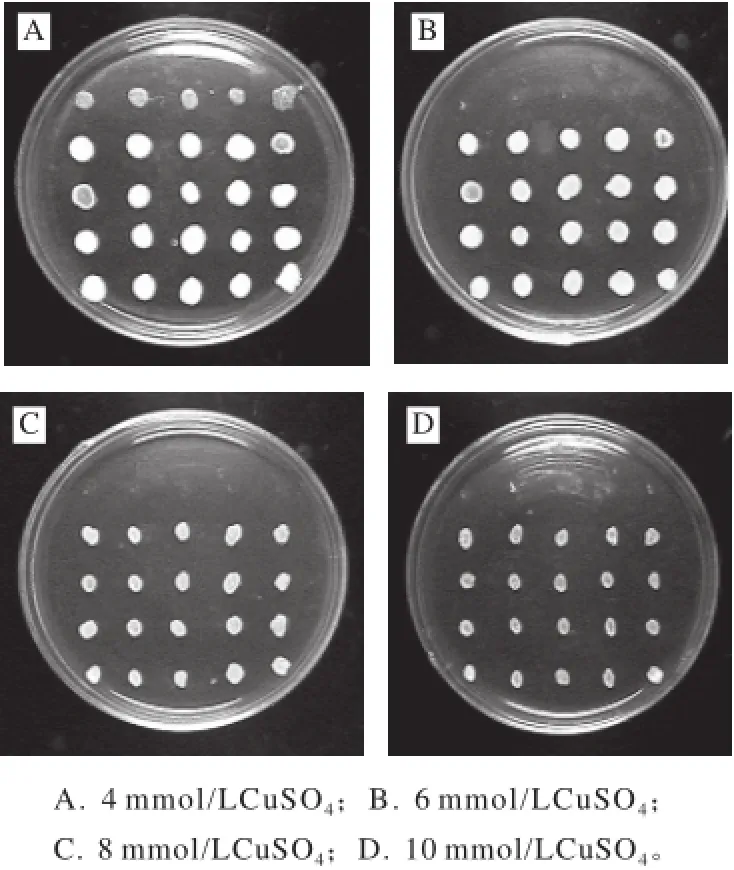
图2 融合子菌株铜抗性筛选Fig.2 Copper resistance of the parental strains and their fusants
将培养出的菌落挑至无菌水中,饥饿,用饥饿后的菌悬液点板,分别将融合子及其亲株点至含Cu2+浓度为4、6、8、10 mmol/L的YEPD固体培养基平皿上,点板后倒置培养,观察结果如图2所示。每个平皿中最上方5个菌落为融合亲株,后面的20个菌落为融合子。结果说明在4 mmol/L CuSO4的YEPD培养基中融合亲株还能生长,而在高于4 mmol/L CuSO4的YEPD培养基中融合亲株不能生长,而融合子生长良好。比较不同的Cu2+梯度平板上菌落的生长情况,将在较高Cu2+浓度平板上长出的融合子200支接斜面,4 ℃保存。
2.1.2 实验室水平复筛
利用耐压指标和发酵性能作为筛选标记,逐步筛选优良高浓酵母,通过耐酒精度为指标筛选81支耐酒精度≥9%的融合子;以抗自溶能力为指标筛选出蛋白酶活性≤0.25 U/mg的融合子43支;以发酵力为指标,选择启发快、双乙酰还原快、CO2减重多的融合子共2支(融合子1、融合子2)。
2.2 100 L发酵复筛
2.2.1 酵母数变化
啤酒发酵是依赖于啤酒酵母,对麦汁某些组分进行一系列的代谢过程,产生酒精等各种风味物质构成独特风味的饮料,整个发酵笼统地可分3个阶段:酵母恢复阶段,有氧呼吸阶段,无氧发酵阶段。融合子2在酵母接种后,开始在麦汁充氧的条件下,恢复其生理活性;然后以麦汁中的氨基酸为主要氮源和以可发酵性糖为主要碳源,进行呼吸作用,并从中获得能量而生长繁殖,在5 d内就达到酵母数最大值[26];之后即进入无氧发酵阶段。而青岛啤酒酵母和融合子1分别在12 d和10 d才达到酵母数最大值,无氧发酵阶段很短。融合子2酵母峰值明显高于其他菌株。
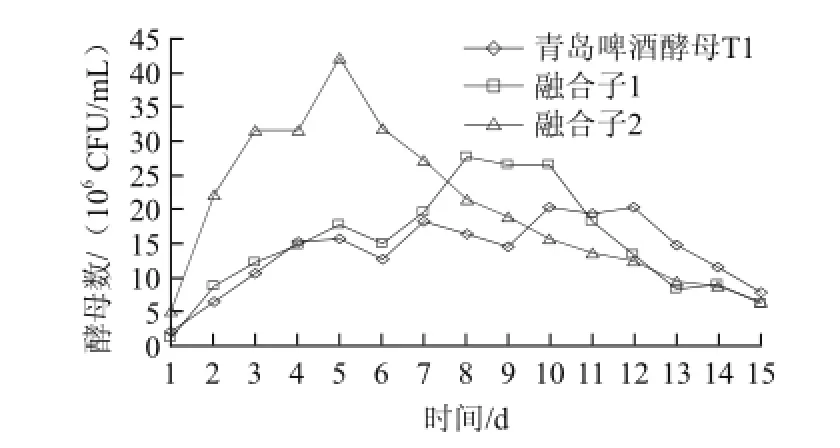
图3 融合子100 L发酵实验酵母数变化Fig.3 The growth curves of the original strain T1 and two fusants during cultivation in a 100 L fermenter
2.2.2 糖度变化
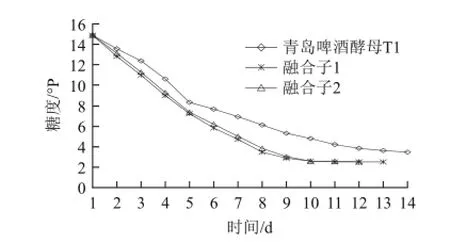
图4 融合子复筛100 L发酵实验糖度变化Fig.4 Time-dependent changes in wort concentration during cultivation of the original strain T1 and two fusants in a 100 L fermenter
融合子发酵过程中糖度变化见图4所示。融合子1和融合子2发酵液的糖度降低比青岛啤酒酵母T1多,说明融合子1和融合子2利用的可发酵糖比青岛啤酒酵母T1多,融合子1、融合子2降糖能力明显强于普通青岛啤酒菌株。
2.2.3 双乙酰变化
如图5所示,融合子2发酵液中双乙酰的质量浓度在发酵过程的12 d就达到要求≤0.1 mg/L,而融合子1发酵液中双乙酰的质量浓度在发酵过程的14 d达到要求,青岛啤酒酵母发酵液中双乙酰的质量浓度在发酵过程的15 d还没有达到要求,仍在0.3 mg/L。融合子2、融合子1双乙酰峰值低于普通青岛啤酒酵母菌株,而还原速度明显快于普通青岛啤酒菌株,特别是融合子2表现更为突出。
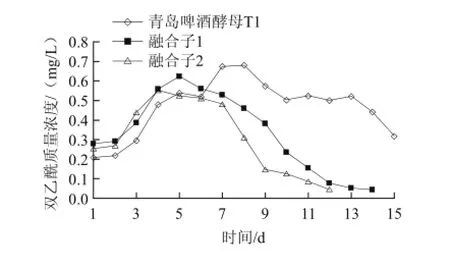
图5 融合子复筛100 L发酵实验双乙酰变化跟踪Fig.5 Time-dependent changes in diacetyl concentration during cultivation of the original strain T1 and two fusants in a 100 L fermenter
2.2.4 发酵液其他指标
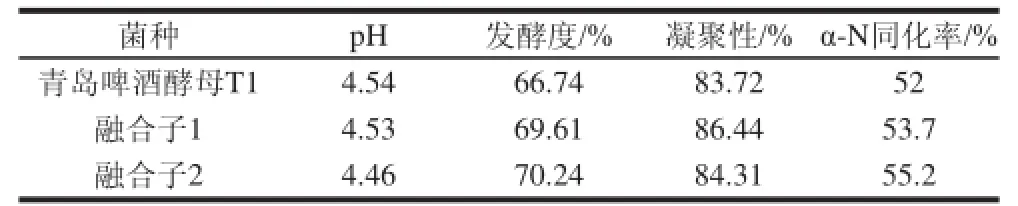
表2 融合子菌株发酵实验发酵液分析Table 2 Analysis of the fermentation broths of the original strain T1 and two fusants
由表2可知,各种指标中,3种菌株均达到啤酒要求,而融合子2的pH值、发酵度、α-N同化率3种指标要优于其他两种菌株,其凝聚性高于青岛啤酒酵母T1,低于融合子1。不同啤酒酵母菌株凝集性差异很大。强凝集性酵母,从发酵液中分离早、沉淀快,因而酒液中酵母数量少、发酵慢、发酵度低;弱凝集性酵母,与发酵液分离晚,酒液中酵母细胞密度大、发酵快、发酵度高、回收酵母量少,滤酒困难。因此在选择菌种时,要求酵母的凝聚性适中,既能达到较高的发酵度,又沉淀结实、容易分离的菌株。综合以上因素,融合子2的pH值、发酵度、α-N同化率、凝集性4种指标要优于其他两种菌。
2.2.5 可发酵性残糖分析
由表3可知,3种菌株对果糖、葡萄糖和蔗糖的利用率都很高,在发酵液中都没有检测到3种糖,青岛啤酒酵母对麦芽糖的利用率好于融合子,而融合子2对麦芽三糖的利用率好于其他2种酵母菌株。

表3 融合子菌株发酵实验发酵液可发酵性糖残留分析Table 3 Analysis of fermentable sugar residues in the fermentation broths of the original strain T1 and two fusants
2.2.6 风味物质组成
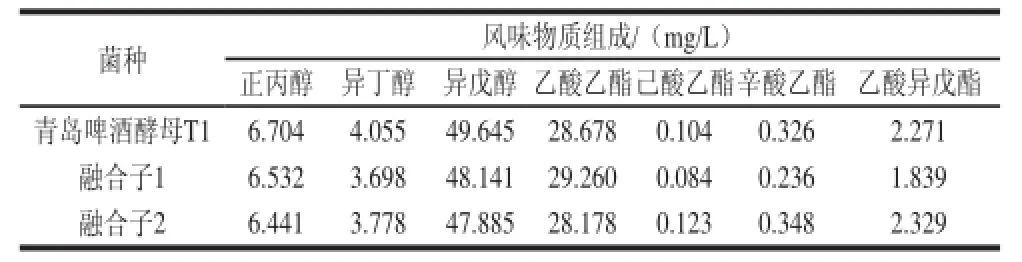
表4 发酵液风味物质分析Table 4 Flavor components of the fermentation broths of the original strain T1 and two fusants
由表4可知,3种菌株的风味物质组成没有明显区别。综合以上实验数据可以看出,融合子1和融合子2(都是T1+H6的融合方式)与青岛啤酒酵母T1相比,都表现出酵母数峰值高、降糖和还原双乙酰快的优势,且代谢风味物质组成与青岛啤酒酵母T1非常接近。其中融合子2的优势更突出,最终选择融合子2作为青岛啤酒高浓酵母。
2.3 融合子的鉴定
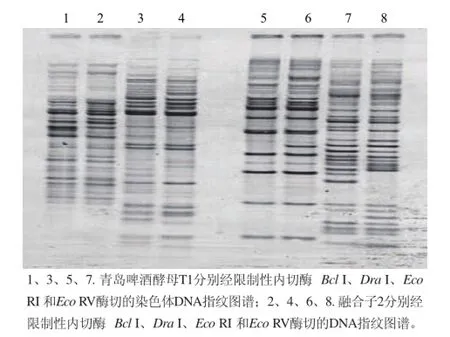
图6 青岛啤酒酵母与融合子2染色体DNA指纹图谱比较Fig.6 Comparison of chromosomal DNA fingerprint between Tsingtao brewer’s yeast and fusant 2
铜抗性的初筛和耐压指标、发酵性能的复筛,也可以看作是对融合子的鉴定,但只限于外观表型的鉴定,还需要从酵母细胞的染色体DNA水平对融合子进行了遗传本质的鉴定。利用RFLP技术分别对青岛啤酒酵母T1和融合子2做染色体DNA指纹图谱鉴定,电泳条带如图6所示。利用Eco RI 和Eco RV酶切的DNA指纹图谱显示融合子2与青岛啤酒酵母T1的16S rDNA的序列存在差异,融合子2的DNA-DNA杂交的同源性在90%以上,说明两株酵母的DNA存在不同,但亲缘关系很近。
2.4 高浓酿造酵母的遗传稳定性
由于原生质体的融合会产生两种情况,一种是真正的融合,即产生杂合双倍体,或单倍重组体;另一种是暂时的融合,形成异核体。前者一般是较稳定的,而后者则是不稳定的,会分离成亲本类型,有的甚至可以异核状态移接几代[27]。在生产厂连续使用8代高浓酵母融合子2,回收后贮存于冰箱中,同时采用CHEF电泳技术对高浓酵母菌株的总染色体结构进行分析,总染色体DNA指纹图谱如图7所示。高浓酵母经过连续使用8代后,其总染色体DNA指纹图谱基本保持一致,证明该菌株的遗传稳定性较高。
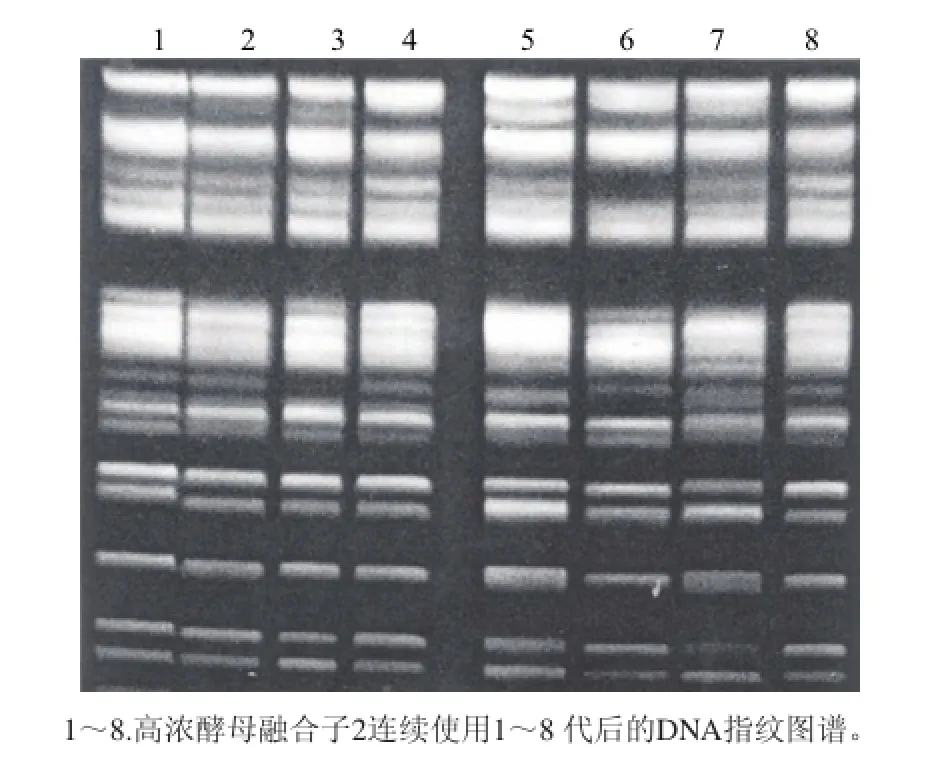
图7 高浓酵母融合子2连续使用8代指纹图谱Fig.7 The fingerprints of funsant 2 during 8 successive passages
3 结 论
应用酵母融合技术选育既适应高浓、高酒精环境,又能保持青岛啤酒基本风味的菌株对满足高浓酿造、提高啤酒产量意义重大。从本实验结果可以看出,培育出的高浓菌种杂合子与青岛啤酒酵母菌株相比,都表现出酵母数峰值高、降糖和还原双乙酰快的优势,且代谢风味物质组成与青岛啤酒酵母非常接近,达到预期目标。杂合子2经过连续使用8代后,其总染色体DNA指纹图谱保持基本一致,证明该菌株的遗传稳定性高。
[1] 梅丛笑, 方元超, 王福荣. 啤酒酵母的改良途径[J]. 食品工业科技, 2000, 21(3): 70-73.
[2] DUTTON I. Corn syrup brewing adjuncts-their manufacture and use[J]. Technical Quarterly-Master Brewers Association of the Americas, 1996, 33(1): 47-53.
[3] PIERPOINT D J. Glouse syrups and specialty syrups for beer brewing[J]. Drink Technology Market, 1998, 2(3): 11-12.
[4] PIERPONT D. Glucose syrups, dextrose and speciality adjuncts for beer brewing[J]. Biotechnology, 1998, 23(4): 28-35.
[5] VENTURINI F, CEREDA W G. Cassava starch hydrolysate as an adjunct in beer production: chemical and sensory evaluation[J]. Ciencia Technologia Aliment,1998, 18(2): 156-161.
[6] JAVADEKAR V S, SIVARAMAN H, GOKHALE D V. Industrial yeast strain improvement: construction of a highly floccu-lent yeast with a killer character by protoplast fusion[J]. Industrial Microbiology, 1995, 15: 94-102.
[7] 邓红梅. 利用原生质体融合提高酿酒酵母赖氨酸含量的研究[J]. 贵州大学学报: 自然科学版, 2002, 19(3): 227-231.
[8] 孙君社, 李雪, 李军席. 原生质体融合构建耐高温酵母菌株[J]. 食品与发酵工业, 2002, 28(5): 1-5.
[9] 蔡车国, 刘月英, 戴玉聪, 等. 用原生质体融合法优化啤酒酵母的凝絮性和发酵性能[J]. 厦门大学学报: 自然科学版, 2006, 45(1): 110-113.
[10] 王芬, 由媛, 全丽, 等. 双亲灭活的原生质体融合株啤酒酵母DR9-2的构建及其特性的研究[J]. 酿酒, 2007(5): 72-75.
[11] 蔡车国, 刘月英, 戴玉聪, 等. 啤酒酵母融合株GR8发酵特性的初步研究[J]. 酿酒, 2005, 32(4): 60-61.
[12] 戴玉聪. 啤酒酿造酵母原生质体融合株GR5的中试[J]. 酿酒, 2005 (2): 51-53.
[13] 全丽. 啤酒酵母原生质体融合株GR8的中试研究[J]. 酿酒科技, 2005 (8): 69-73.
[14] 刘月英, 王芬, 由媛, 等. 啤酒酵母原生质体融合株HN31-6的啤酒酿造中试研究[J]. 厦门大学学报: 自然科学版, 2006, 45(6): 855-858.
[15] 范秀英. 富硒及高谷胱甘肽酵母菌选育的研究[D]. 天津: 天津科技大学, 2004.
[16] 刘杰璞. 啤酒新产品的开发及风味研究[D]. 北京: 北京化工大学, 2006.
[17] 陈海昌, 唐屹, 张岭花, 等. 原生质体融合技术提高啤酒酵母凝絮性的研究[J]. 微生物学通报, 1994, 24(4): 213-217.
[18] BALASUBRANMANIAN N, ANNIEJUIET G, SRIKALAVANI P, et al. Release and regeneration of protoplasts from the fungus Triehotheeium roseum[J]. Canadian Journal of Microbiology, 2003, 49(4): 263-268.
[19] 母茜. 高SOD、低双乙酞啤酒酵母工程菌的构建[D]. 雅安: 四川农业大学, 2008.
[20] GUAN Dunyi. Handbook of brewing industry[M]. Beijing: Ligt Industry Press, 1982: 467-470.
[21] 中国食品发酵工业研究院. 啤酒工业国家标准与分析技术手册[M]. 北京: 中国食品工业出版社, 2001.
[22] 李斌, 徐智斌, 冯波, 等. 糯小麦与普通小麦糖化过程的比较[J]. 中国农业科学, 2011, 44(13): 2760-2767.
[23] 王家林, 薛长湖, 付雪艳, 等. 啤酒风味物质及游离脂肪酸的气相色谱研究[J]. 分析化学, 2006(6): 875-878.
[24] 蔡勇. 低乙醇脱氢酶II活性的抗老化啤酒酵母工程菌的构建[D]. 雅安: 四川农业大学, 2008 .
[25] 边银丙, 翁曼丽, 罗信昌, 等. 酿酒酵母染色体DNA样品制备和CHEF分析[J]. 菌物系统, 1999, 18(3): 284-287.
[26] 寇凤莲. 大容积发酵罐啤酒醇酯比的控制研究[D]. 无锡: 江南大学, 2008.
[27] 程彬彬. 微生物絮凝剂及细胞融合技术处理印染废水的研究[D]. 南昌: 南昌大学, 2008.
Strain Improvement through Protoplast Fusion between Tsingdao Brewer’s Yeast and High-Gravity Yeast
LI Ju-ning, YI Qing-ping
(College of Biological Engineering, Jingchu University of Technology, Jingmen 448000, China)
In this study, protoplast fusants between Tsingdao brewer’s yeast and high-gravity yeast were developed and preliminarily screened for their copper resistance. On the basis of this investigation, secondary screening was carried out on a laboratory scale or in a 100 L fermentor with respect to pressure tolerance and fermentation performance. The results showed that the selected fusant strain was superior to Tsingdao brewer’s yeast, as manifested by higher alcohol peaks as well as faster sugar consumption and diacetyl reduction. Moreover, both yeast strains presented similar fl avor compounds profi le during metabolism. The total chromosomal DNA fi ngerprinting of the fusant strain after 8 successive passages remained consistent, suggesting high genetic stability.
protoplast fusion; high-gravity yeast; Tsingdao brewer’s yeast; breeding; high-gravity brewing
TS261.1
A
1002-6630(2014)03-0173-05
10.7506/spkx1002-6630-201403035
2013-02-01
李居宁(1969—),女,讲师,硕士,研究方向为现代生物技术发酵、检测。E-mail:lijuning613@163.com

