大鼠急性肾损伤后自噬相关蛋白Beclin-1的表达
郭秀全 张惠芳 王养民 吕海迪 李卫平 乔够梅 郭 娅
自噬参与急性肾损伤(AKI)临床病理过程,然而直到现在人们对自噬与AKI之间的联系了解甚少[1]。现在有越来越多的证据表明,自噬是在AKI的发病机制中扮演着重要的角色,但是目前对自噬在AKI的发病过程中的具体作用机制的研究仍处在起步阶段[2]。本研究通过研究Beclin-1在急性肾损伤肾组织中的表达,初步探讨自噬在AKI发病机制中的作用。
材料与方法
1.动物和试剂:成年雄性SD大鼠,兰州军区总医院动物实验中心提供,体质量250±30g;动物清洁度为Ⅱ级,自由饮食,室温12h∶12h昼夜节律下饲养。主要试剂:兔抗Beclin-1多克隆抗体、即用型SP免疫组化检测试剂、DAB显色试剂均购自北京中杉金桥生物有限公司,余为国内公司标准品。
2.SD大鼠急性肾损伤模型的建立:选用24只雄性大鼠SD大鼠,体重250±30g,按随机数字表法分为两组:(1)假手术组(Sham组,n=12):大鼠常规麻醉后行开腹手术,立即切除右肾用作正常肾脏标本,游离左侧肾蒂血管,不夹闭,观察30min关闭腹部;(2)缺血-再灌注组(I/R组,n=12):切除右肾,左肾蒂血管分离,观察30min后用无损伤动脉夹持续夹闭左肾蒂血管45min后,恢复左肾血流,关闭腹部;术后12、24、48h 3个相应时间点收获肾脏标本。HE染色观察肾脏病理变化,测定自噬相关蛋白Beclin-l的表达情况,透射电镜观察肾脏组织自噬现象。
3.样品制备:大鼠在缺血-再灌注不同时间,断头处死取左侧肾脏10%甲醛溶液中备用,右侧放入2.5%的戊二醛溶液中做透射电镜备用。
4.标本HE染色病理切片观察:大鼠处死以后立即10%甲醛常规灌注固定后常规石蜡包埋、切片、染色。
5.Beclin1蛋白表达测定:10%甲醛常规灌注固定,取材并置20%蔗糖溶液(4℃)中过夜。蜡块制作。切片、贴片。加入配好的0.3%的过氧化氢甲醇溶液30min,以消除内源性过氧化物酶的影响;加入配好的0.3%Triton×100 30min,以增加细胞的通透性,加入用血清稀释液稀释的一抗、二抗(1∶500),加入显色液,进行免疫组织化学显色,脱水之后,封片,拍照。
6.透射电镜观察自噬体:①2.5%戊二醛固定;②0.1mol/L PBS漂洗两次,10分钟/次;③1%锇酸后固定2h;④丙酮梯度脱水;⑤环氧树脂618包埋;⑥半薄切片定位;⑦超薄切片,铀染,铅染;⑧电镜观察,拍照。
结 果
1.HE染色病理:I/R组大鼠造模后肾组织切片HE染色显示部分肾小球逐渐萎缩,球囊腔出现空隙,球囊腔空隙增大明显,毛细血管攀萎缩,肾小管上皮细胞变性。随造模时间延长,肾小球缩小较前更为明显,球囊腔更大,肾小管上皮细胞变性显著,但未见明显的出血,未见小球渗出病变。对照组大鼠肾组织切片显示肾小球无明显萎缩、球囊腔不明显,肾小管细胞排列规则,肾小血管开放良好(图1)。
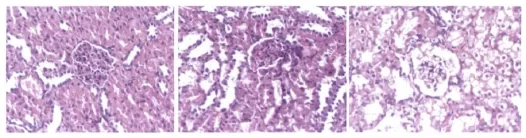
图1 12、24、48h 肾组织病理切片(HE,×200)
2.免疫组化:Beclin1在对照组可见肾小管表达,正常肾小球未见明显表达。在I/R组肾组织中肾小管及肾小球均可见表达,且表达显著增加(P<0.05),其中12h表达弱于24h,48h表达最强(P<0.05,图2)。阴性对照未见棕黄色颗粒沉积。
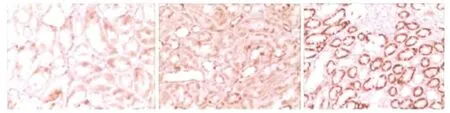
图 2 12、24、48h 肾组织免疫组化(×100)
3.透射电镜:透射电镜结果可见I/R组大鼠肾组织内皮细胞肿胀,在肾小管细胞部分区域可见大量次级溶酶体,内有深染区域。内织网改变不明显,I/R组造模后在透射电镜下可见损伤的细胞器如线粒体的肿胀变性,其周围出现空泡状双层膜样结构、继而双层膜环绕成自噬体、进而与溶酶体融合、消化,也可见自噬溶酶体内最终不能降解的残体等(图3)。对照组大鼠肾组织可偶见带有双层膜结构的囊泡样结构,主要位于肾小管区,数量较少。
讨 论

图3 透射电镜见肾组织中自噬体
自噬是参与细胞质内大分子物质和细胞器降解的一种高度保守的生理行为[3],其一般通过双层膜结构包裹待降解物质形成自噬体,转运其至溶酶体并与之结合形成自噬溶酶体而降解。细胞营养缺乏时,自噬可通过把衰老的细胞器等废物降解成合成细胞最基本的元素重新利用,维持细胞稳态[4]。不同于泛素-蛋白酶体系统(UPS),自噬的吞噬是没有选择性的,在人体发育过程可清除有害和过剩的细胞器及病原体,有利于细胞组织的重塑[5]。到目前为止,已知自噬的作用机制过程包括:①由双层膜结构始发;②双层膜结构的扩张延伸;③分化成熟成为自噬小体;④与溶酶体结合形成自噬溶酶体;⑤包裹摄入物质的降解[6]。
AKI是由导致肾脏结构或功能变化的损伤引起的肾功能突然(≤48h)下降,涵盖了从肾功能的轻微受损到需要进行肾脏替代治疗的严重病变,是一个严重的疾病谱。急性肾损伤的特点是肾小球滤过率的降低,导致含氮废物如尿素氮等的积累以及电解质和酸碱平衡紊乱,导致肾功能的丧失[7]。此外,AKI的发病率近年来有所增加,越来越多的患者需要采用肾脏替代疗法,这也进一步医疗系统的负担。
Chang等[8]发现在缺血再灌注大鼠肾小管中自噬相关基因(ATG)蛋白Beclin-1和LC3表达增加,发现肾组织在此病理条件下自噬被激活。进一步研究发现人肾近端小管细胞株(HK-2)缺氧后大批LC3和LAMP2阳性液泡生成,在大鼠肾脏缺血-再灌注期间也有明显增多。LC3阳性液泡与LAMP2阳性液泡增殖提示自噬小体与溶酶体为降解而产生了融合。通过电子显微镜(EM)在肾脏移植患者的小管细胞中也发现自噬小体。再灌注压力促进活性氧的释放,增加缺血性压力和导致所谓的缺血再灌注(IR)损伤,IR损伤激活自噬[9]。事实上,氧化应激上调包括Beclin-1和LC3在内的自噬表达从而促进自噬。这为上调自噬在治疗肾损伤提供了前景和方向。含BCL2L1 cDNA重组人类腺病毒在缺血前动脉灌注可通过通过抑制细胞凋亡和自噬保护肾脏肾缺血再灌注损伤,BCL2L1可抑制线粒体外膜透化作用和活性氧的生产[10]。此外BCL2L1增强减少急性肾小管坏死和改善肾功能不全。
BCL2L1或BCL2/Bcl-xl在AKI患者肾小管细胞自噬中的抑制作用一直在被研究。在大鼠缺血再灌注后含Bcl2l1基因的血液可减少自噬的发生,在这种情况下通过 GFP-LC3 BCL2双转基因小鼠BCL2也可抑制自噬的发生,顺铂诱导自噬被BCL2完全抑制[11]。自噬是BCL2-BCL2L1通过BCL2同调因子3(BH3)结构域结合Beclin-1来抑制Beclin-1在Ⅲ类PtdIns3K复合体上组装,且只有具有ER靶点的 BCL2可抑制自噬,这是公认的 BCL2-BCL2L1调节自噬的机制。研究发现表明,营养剥夺自噬因子1(NAF1)在内质网中结合BCL2通过Beclin-1、BCL2之间的相互作用抑制自噬[12]。内质网内的BCL2除了联合Beclin-1,也可以通过减少应激激活Ca2+的释放和顺向钙调素依赖的蛋白激酶AMPK的信号通路抑制自噬[13]。
研究也发现AKI中小管细胞自噬可能导致细胞死亡。Lai等在大鼠的肾脏缺血-再灌注实验中发现在损伤的肾小管中Beclin-1和LC3表达以及细胞凋亡表达同时增加。自噬和凋亡均能被BCL2L1过表达或缺血性预处理所抑制,同时肾损伤的程度得到改善[14]。Suzuki等发现GFP-LC3转基因小鼠肾缺血-再灌注后肾小管中自噬小体的形态发生变化,而且伴随BCL2-GFP-LC3双转基因小鼠中自噬减少,肾小管的损伤也相应减轻,在体外观察到自噬抑制剂对H2O2引起的HK2细胞死亡具有保护作用说明在肾缺血-再灌注自噬可能是有害的。Gozuacik等研究发现ER应激诱发的细胞凋亡和自噬在相同的小管细胞产生同等的损伤,自噬本身的抑制并不能改变细胞死亡或生存的状态。Dapk1基因敲除小鼠因自噬受到抑制使其对ER应激导致的肾小管细胞损伤不耐受。因此自噬可作为在ER应激中协同细胞凋亡引起肾损伤的第2个细胞损伤机制。
哺乳动物自噬调控基因 Beclin 1是酵母 ATG6的同系物,1998年Beth等在酵母的杂交克隆筛选中得到,是自噬过程中的一个重要调节分子,它通过与磷酸肌醇3激酶(PI3K)结合而参与早期自噬的调节,参与自噬体的形成及调节其他自噬蛋白在自噬前体膜的定位[15]。Beclin-1参与早期的自噬,促进自噬小泡的成核和从细胞溶质招募蛋白质,是自噬体形成的标志。Beclin 1通过与 PI3K、Vps34形成复合体,此过程需要VMP1-AtgD的参与,使磷脂酰肌醇磷酸化,在自噬小体膜上产生三磷酸磷脂酰肌醇(PI3P)。PI3P在自噬前体复合物的形成及自噬小体膜的来源中发挥重要作用[16]。Beclin-1在诱导自噬发生时形成的复合物中,除 Vps34外还包括UVRAG、Ambra1和Bif-1。VMP1表达可诱导自噬,并且这种跨膜蛋白的表达是哺乳动物细胞自噬形成必不可少的。VMP1表达诱导的自噬是通过VMP1-AtgD和Beclin-1-BH3结构域结合而介导的。这导致自噬体形成位点Ⅲ类PI3K的定位。VMP1-AtgD结构域与Beclin-1、BH3结合可促进其取代自噬负调节因子bcl 2位点,促进Beclin-1进入自噬途径。本研究结果显示大鼠肾组织对照组Beclin-1染色表达较空白明显增强。
最近的发现为Beclin-1存在于的Ⅲ类PI3K复合体上提供了生化证据。Beclin-1复合体参与自噬作用机制的不同时期,而且每个复合体的核心都由Beclin-1、hVps34、hVps15组成,Beclin1-hVps34复合体控制自噬小体的形成。VMP1-Beclin-1之间的相互作用是哺乳动物自噬VMP1-Beclin-1-hVps34复合体形成所必需的。VMP1-Beclin-1复合体可促进自噬小体膜上生成。然而,雷帕霉素干预或VMP1过表达促进自噬体形成位点PI3P的生成。VMP1-Beclin-1通过VMP1-AtgD的相互作用是哺乳动物自噬需要的PI3K活性的定位所必需的。
本研究中,在缺血再灌注诱导急性肾损伤肾组织中随着缺血时间的延长,急性肾损伤程度的加重,自噬蛋白Beclin-1表达明显增多,提示急性肾损伤肾组织中发生了自噬,文献报道自噬在AKI损伤中对肾小管细胞具有保护作用,通过自噬的研究可为AKI的预防及治疗提供了一个新的方向和思路,进一步的研究可能为AKI的预防和治疗开辟一个新的领域。
1 Mizushima N,Levine B,Cuervo AM,et al.Autophagy fights disease through cellular self- digestion[J].Nature,2008,451(7182):1069-1075
2 Huber TB,Edelstein CL,Hartleben B,et al.Emerging role of autophagy in kidney function,diseases and aging[J].Autophagy,2012,8(7):1009-1031
3 Yang Z,Klionsky DJ.Eaten alive:a history of macroautophagy[J].Nat Cell Biol,2010,12(9):814 -822
4 Weide T,Huber TB.Implications of autophagy for glomerular aging and disease[J].Cell Tissue Res,2011,343(3):467 -473
5 Li PK,Burdmann EA,Mehta RL,et al.Acute kidney injury:global health alert[J].Transplantation,2013,95(5):653 - 657
6 Wu HH,Hsiao TY,Chien CT,et al.Ischemic conditioning by short periods of reperfusion attenuates renal ischemia/reperfusion induced apoptosis and autophagy in the rat[J].J Biomed Sci,2009,16(19):1-10
7 Isaka Y,Suzuki C,Abe T,et al.Bcl-2 protects tubular epithelial cells from ischemia/reperfusion injury by dual mechanisms[J].Transplant Proc,2009,41(1):52-54
8 Chang NC,Nguyen M,Germain M,et al.Antagonism of Beclin 1-dependent utophagy by BCL-2 at the endoplasmic reticulum requires NAF -1[J].EMBO J,2010,29(3):606 -618
9 Wu HH,Hsiao TY,Chien CT,et al.Ischemic conditioning by short periods of reperfusion attenuates renal ischemia/reperfusion induced apoptosis and autophagy in the rat[J].J Biomed Sci,2009,16(19):1-10
10 Chifenti B,Locci MT,Lazzeri G,et al.Autophagy-related protein LC3 and Beclin -1 in the first trimester of pregnancy[J].Clin Exp Reprod Med,2013,40(1):33-37
11 Funderburk SF,Wang QJ,Yue Z.The Beclin 1-VPS34 complexat the crossroads of autophagy and beyond[J].Trends Cell Biol,2010,20(6):355-362
12 Molejon MI,Ropolo A,Re AL,et al.The VMP1 -Beclin1 interaction regulates autophagy induction[J].Sci Rep,2013,3:1055
13 Herzog C,Yang C,Holmes A,et al.zVAD -fmk prevents cisplatin-induced cleavage of autophagy proteins but impairs autophagic flux and worsens renal function[J].Am J Physiol Renal Physiol,2012,303(8):F1239-1250
14 Wu S,Yuan L,Zhang Y,et al.Probiotic lactobacillus rhamnosus GG mono-association suppresses human rotavirus-induced autophagy in the gnotobiotic piglet intestine[J].Gut Pathog,2013,5(1):22 - 22
15 Lee YJ,Song HO,Lee YH,et al.Proliferation of Toxoplasma gondii Suppresses Host Cell Autophagy[J].Korean J Parasitol,2013,51(3):279-287
16 Baspinar S,Bircan S,Yavuz G.Beclin 1 and bcl-2 expressions in bladder urothelial tumors and their association with clinicopathological parameters[J].Pathol Res Pract,2013,209(7):418 -423

